1.(2019·内蒙古包头四校联考)已知x溶液能与氢氧化钠溶液反应,现有四份20 mL 4 mol·L-1的氢氧化钠溶液分别与下列四种x溶液反应,其中反应最快的是( )
A.10 ℃,20 mL 3 mol·L-1的x溶液
B.20 ℃,30 mL 2 mol·L-1的x溶液
C.20 ℃,10 mL 5 mol·L-1的x溶液
D.10 ℃,10 mL 2 mol·L-1的x溶液
2.(2021·银川模拟)在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是( )
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率一定加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率一定加快
3.(2019·福州质检)某恒容密闭容器中进行反应:SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=a kJ·mol-1;某科研小组通过实验测出SO2的转化率(SO2、NO起始量一定)随条件P的变化情况如图所示,下列说法中正确的是( )

A.10~15 min内反应速率小于15~20 min的反应速率,P为升高温度
B.10~20 min内反应速率小于20~40 min的反应速率,P为减小SO3的浓度
C.10~15 min内反应速率大于40~50 min的反应速率,P为减小压强
D.该反应中,随着反应物浓度的减小,反应速率一直减小
4.(2020·安徽省含山中学月考)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )

A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
5.(2020·辽宁省实验中学东戴河分校高二月考)生物浸出是用细菌等微生物从固体中浸出金属离子,有速率快、浸出率高等特点。氧化亚铁硫杆菌是一类在酸性环境中加速Fe2+氧化的细菌,其浸出ZnS矿机理如图所示。下列说法不正确的是( )

A.浸出过程中不需要补充铁盐
B.温度越高,ZnS浸出速率越快
C.反应Ⅱ的方程式为2Fe3++ZnS===Zn2++2Fe2++S
D.理论上反应Ⅰ中每消耗3.36 L O2(标准状况)可浸出19.5 g Zn2+
6.(2020·四川省新津中学高二月考)某小组探究实验条件对反应速率的影响,设计如下实验,并记录结果如下:
|
编号 |
温度 |
H2SO4溶液 |
KI溶液 |
1%淀粉溶液体积 |
出现蓝色时间 |
|
① |
20℃ |
0.10 mol·L-1 10 mL |
0.40 mol·L-1 5 mL |
1 mL |
40 s |
|
② |
20℃ |
0.10 mol·L-1 10 mL |
0.80 mol·L-1 5 mL |
1 mL |
21 s |
|
③ |
50℃ |
0.10 mol·L-1 10 mL |
0.40 mol·L-1 5 mL |
1 mL |
5 s |
|
④ |
80℃ |
0.10 mol·L-1 10 mL |
0.40 mol·L-1 5 mL |
1 mL |
未见蓝色 |
下列说法正确的是( )
A.由实验①②可知,反应速率v与c(I-)成正比
B.实验①②③④中,应将H2SO4溶液与淀粉溶液先混合
C.在I-被O2氧化过程中,H+只是降低活化能
D.由实验③④可知,温度越高,反应速率越慢
7.(2021·简阳市阳安中学高二月考)下列说法正确的是( )
A.使用催化剂能够降低化学反应的反应热(ΔH)
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.探究温度对硫代硫酸钠与硫酸反应速率的影响时,应用以下操作顺序:先将两种溶液混合并计时,再用水浴加热至设定温度,测反应速率
D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象
8.(2020·北京延庆期中)某同学在实验室研究锌与酸的反应,实验数据如下:
|
实验序号 |
锌质量 |
锌状态 |
c(H2SO4) |
V(H2SO4) |
金属消失时间 |
|
1 |
0.10 g |
颗粒 |
0.5 mol·L-1 |
50 mL |
500 s |
|
2 |
0.10 g |
粉末 |
0.5 mol·L-1 |
50 mL |
50 s |
|
3 |
a g |
颗粒 |
1.0 mol·L-1 |
50 mL |
125 s |
分析上述数据,回答下列问题
(1)实验1和2表明,________对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a=________。
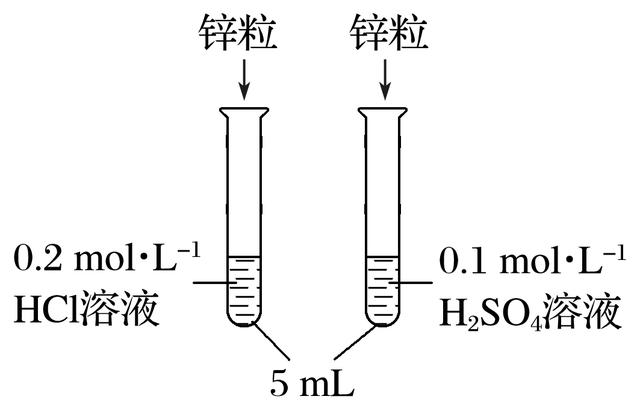
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如右图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。
该同学对产生这一现象的原因,提出两种假设:
a.氯离子对反应起促进作用,加快了反应的进行;
b.____________________________________________________________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5 mL 0.2 mol·L-1盐酸,一份加入一定量的固体______(填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是________________________________________________________________________
__________________________________________________(结合化学方程式作出合理解释)。
9.(2020·安徽省含山中学月考)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
|
实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
|
① |
4 |
60 |
10 |
30 |
|
② |
5 |
60 |
10 |
30 |
|
③ |
5 |
60 |
_______ |
_______ |

测得实验①和②溶液中的Cr2O浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化的离子方程式为____________________________________
________________________________________________________________________。
(3)实验①和②的结果表明__________________________________________________;
实验①中O~t1时间段反应速率v(Cr3+)=________ mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________________________________________________________________________;
假设三:________________________________________________________________________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O的浓度可用仪器测定]
|
实验方案 (不要求写具体操作过程) |
预期实验结果和结论 |
10.(2020·怀仁市第一中学高二月考)KI溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
温度/℃ |
30 |
40 |
50 |
60 |
70 |
|
显色时间/s |
160 |
80 |
40 |
20 |
10 |
(1)该反应的离子方程式为_______________________________________________________。
(2)该实验的目的是探究________对反应速率的影响。
(3)实验试剂除了1 mol·L-1 KI溶液、0.1 mol·L-1 H2SO4溶液外,还需要的指示剂是________。实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度 B.指示剂的浓度
C.试剂的用量(体积) D.试剂添加的顺序
(5)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是________________________________________________________________________。
11.碘在科研与生活中有重要作用,某兴趣小组用0.20 mol·L-1 KI、0.4%淀粉溶液、0.20 mol·L-1 K2S2O8、0.010 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O+2I-===2SO+I2(慢)
I2+2S2O===2I-+S4O(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O与S2O初始的物质的量需满足的关系为n(S2O)∶n(S2O)________________。
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是
________________________________________________________________________。
(3)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表所示:
|
实验序号 |
试剂体积V/mL |
显色时间t/s | ||||
|
K2S2O8溶液 |
KI |
水 |
Na2S2O3溶液 |
淀粉溶液 | ||
|
① |
10 |
10 |
0 |
4 |
1 |
26.8 |
|
② |
5 |
10 |
5 |
4 |
1 |
54.0 |
|
③ |
2.5 |
10 |
V1 |
4 |
1 |
108.2 |
|
④ |
10 |
5 |
5 |
4 |
1 |
53.8 |
|
⑤ |
5 |
7.5 |
7.5 |
4 |
V2 |
t1 |
表中V1=______ mL,理由是____________________________________________________;
V2=______ mL,理由是_________________________________________________________。
显色时间t1大约是________________。
(4)根据表中数据可以得出的结论是________________________________________________
______________________________________________________________________________。