
随着月评工作的持续开展,月评内容得到了越来越多关注胃肠间质瘤的医生与患者的重视与期待,月评小组在2018.7中旬召开了工作总结,并提出调整计划,以期进一步提高月评工作的质量,为更多关注胃肠间质瘤科研与临床诊疗进展的同道们提供共同学习、共同进步的机会。从本期月评开始,月评工作小组增加五名新成员,均是在国内胃肠间质瘤领域具有较深造诣的中青年佼佼者,分别为中国人民解放军总医院吴欣教授、中山大学肿瘤医院伍小军教授与邱海波教授、北京大学人民医院高志冬教授、浙江邵逸夫医院钱浩然教授,相信几位教授的火线驰援会为GIST月评工作质量的提升起到重要的作用。
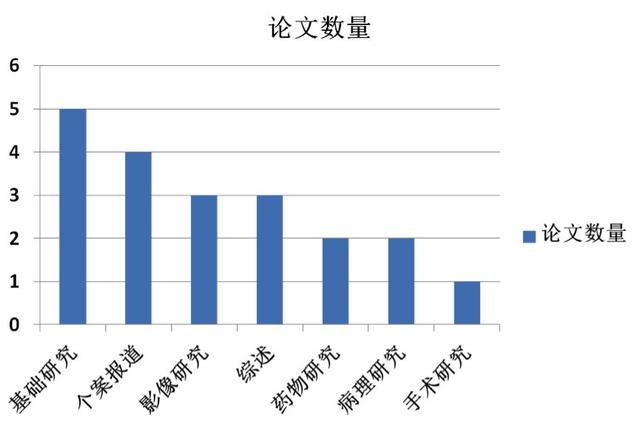
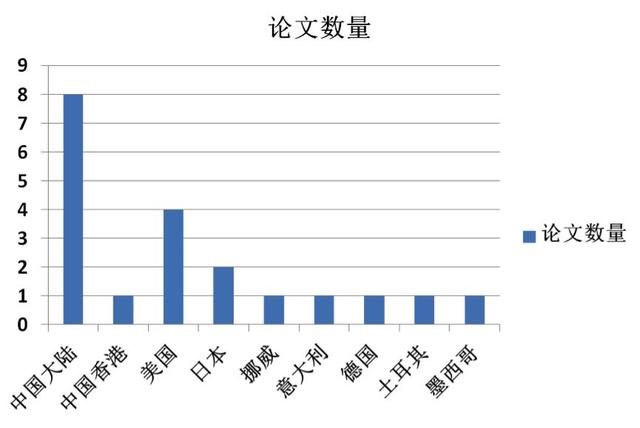
同时为增加内容可读性,本期月评开始在正式版块之前,增加每月文献的分类图示,有助于对每月科研论文发表的整体概况一目了然,每年会进行年终文献总结;月评还有另一点重中之重的调整,参加评论的中青年专家不仅在GIST领域具有高深的造诣,同时除来自北京大学肿瘤医院消化肿瘤内科的李姓医生之外,其余教授均是行业内的美女帅哥,因此,为了更好地展示教授们的卓越风采,从本期月评开始,每篇评论文章旁边都会添加评论医生的头像照片。
本期GIST月评检索了来自Pubmed 2018.07.26-2018.08.20的GIST相关文献,共18篇,补充上期月评遗漏的2篇文献,本期月评共20篇科研论文,其中中国学者GIST文献9篇(含中国香港文献1篇)。本期月评重量级文献主要推荐为:来自MSKCC基于大样本数据库筛选的人类肿瘤中SDHA基因胚系突变研究、来自哈佛医学院Dana-Farber的包含大家所关注的BLU-285与DCC-2618在内的GIST转化研究进展、来自MSKCC的泛FGFR抑制剂联合伊马替尼治疗GIST的Ib期研究、来自南方医科大学的影像组学诺模图术前预测GIST恶性潜能研究、ctDNA揭示GIST异质性与肿瘤负荷等重磅研究。
本期文献检索得到了来自辉瑞市场部范雯霏女士、诺华医学部刘宇宁先生的大力帮助,并由北京大学肿瘤医院消化肿瘤内科刘丹博士、辉瑞制药范雯霏女士协助文字排版,特表感谢。
GIST重量级
1.儿童和成人肿瘤患者中SDHA基因胚系突变情况
Germline SDHA mutations in children and adults with cancer.
Marianne Dubard Gault, Diana Mandelker, Deborah Delair, et al.
Memorial Sloan Kettering Cancer Center, New York, New York 10021, USA
Cold Spring Harb Mol Case Stud. 2018 Aug 1;4(4). pii: a002584. doi: 10.1101/mcs.a002584.
IF: 暂无
琥珀酸脱氢酶复合物(SDH)基因突变易发生在家族性副神经节瘤-嗜铬细胞瘤综合征(FPG)与胃肠道间质瘤(GIST)患者。
作者分析了Memorial Sloan Kettering癌症中心接受过靶向捕获测序患者(N=4974)的数据,发现10例患者携带SDHA胚系突变,其中有7例患者突变类型是SDHA基因c.91C>A(p.Arg31Ter)无义突变。这些患者包括1例成神经细胞瘤、1例乳腺癌、1例结肠癌、1例肾癌、1例黑色素瘤/子宫癌双原发癌、1例前列腺癌、1例子宫内膜癌、1例膀胱癌、2例GIST。作者又运用IHC方法检测了这10例患者组织标本中SDHA/B蛋白表达,发现SDHA/B蛋白在2例GIST(患者分别是21和27岁)和1例成神经细胞瘤(3岁患者)中表达缺失,而在其它肿瘤组织中均表达。结合患者肿瘤组织二次突变及LOH分析情况,结果表明,GIST是SDHA相关性肿瘤,而且SDHA胚系突变可能是成神经细胞瘤发生的驱动基因。
【简评】
该研究是单中心大样本回顾性分析,并与其它已有的数据库如TCGA进行了比较。不管是来自MSK的数据,还是其它数据,SDHA胚系突变的发生率均很低。该研究数据或许对某些类型肿瘤的遗传筛查有一定帮助,作者通过对7例携带SDHA基因c.91C>A(p.Arg31Ter)无义突变患者进行了家族史分析,发现除了GIST和成神经细胞瘤外,其它肿瘤中基因变异的外显率较低,并不扮演致癌角色。Rednam等人于2017年建议携带SDH胚系突变的个体应该从8岁开始进行常规肿瘤筛查(想想都难)。目前,肿瘤遗传筛查较过去有了很大进步,不过笔者觉得,这种筛查非常难以开展,不仅是突变发生率很低的原因,而且肿瘤发生的确也是多因素结果,先天的遗传因素和后天的表观遗传因素谁主沉浮尚未知。鉴于目前有限的数据,SDHA胚系突变与成神经细胞瘤发生的确切关系尚需后续深入研究。
点评专家:
北京大学肿瘤医院
高静 研究员
2. GIST转化研究思考和临床进展
Translational Insights into Gastrointestinal Stromal Tumor and Current Clinical Advances. M. L. Hemming, M. C. Heinrich, S. Bauer and S. George.
Center for Sarcoma and Bone Oncology, Dana-Farber Cancer Institute, Harvard Medical School, Boston, Massachusetts, USA
Ann Oncol. 2018 Aug 8. doi: 10.1093/annonc/mdy309.
III型受体酪氨酸激酶(RTKs)突变占GIST病例的85%以上,并且大多数初始KIT突变对酪氨酸激酶抑制剂(TKI)伊马替尼的治疗有效; 舒尼替尼和瑞戈非尼分别被批准用于伊马替尼耐药GIST的二线和三线治疗;对舒尼替尼和瑞戈非尼耐药后的患者,仍然需要新的治疗药物和手段;少数GIST患者为无KIT突变,目前的TKIs无效,迫切需要新的治疗药物。
目前已经开发了几种克服GIST已知耐药机制的新型、选择性TKIs药物,并且在早期临床试验中显示出不错的临床应用前景;另外一些新兴靶向疗法包括调节KIT下游的细胞信号传导途径以及以KIT和PDGFRA为靶点的抗体药物和免疫检查点抑制剂等,为GIST后续治疗带来了令人鼓舞的新希望。
(1)新型TKI药物
Crenolanib 是一种新型的III型RTKs抑制剂,用于治疗PDGFRA D842V 突变GIST,同时对其他类型 PDGFRA突变也显示出强有力的抑制作用,在II期的临床中显示出一定的疗效,III期临床正在开展(NCT02847429);Avapritinib (BLU-285) 为I型酪氨酸激酶抑制剂,当前用于治疗进展期以及PDGFRA D842V 突变GIST (NCT02508532);一种KIT 开关抑制剂(switch pocket inhibitor)—DCC2618,用于治疗TKIs的耐药突变,目前也已进入临床试验阶段(NCT02571036)。
(2)新型的靶向治疗
为了破坏或封闭KIT蛋白,并且增强机体免疫力,给予KIT-directed 单克隆抗体,可以减少细胞表面的KIT基因表达,并可以增强巨噬细胞的吞噬作用,并可以抑制肿瘤的生长。一项关于KIT-directed 单克隆抗体的早期临床试验正在开展(NCT02642016)。
PDGFR-directed单克隆抗体 olaratumab 可以阻断磷酸化并下调PDGFRA,同时控制肿瘤生长。Olaratumab联合阿霉素在非GIST的软组组肉瘤中有生存获益。
一些临床前的研究显示PI3K、AKT、FGFR、MEK 和mTOR 等信号通路抑制剂,可以抑制KIT,在体外和动物实验中看到抑制肿瘤生长的作用,但目前临床试验尚未观察到疗效。
【简评】
(1)转化研究取得了一定的进展,克服耐药的机制逐渐明晰,但相应的治疗手段还处于初级阶段。科学家们试图尝试不同通路抑制剂,体外、体内试验结果不错,但临床转化举步维艰;
(2)PDGFRA D842V 突变GIST治疗曙光乍现,Crenolanib、BLU-285、DCC2618三杆洋枪目标一致,小样本报道疗效让人眼前一亮,值得各位高度关注;
(3)封闭KIT和PDGFRA蛋白的单克隆抗体治疗是GIST治疗的新思路,初步涉足免疫治疗领域,值得期待。
(4)GIST是个“傻瓜”,大部分患者应用TKIs疗效确切。有别于其他实体瘤,针对耐药、少见突变以及野生型患者开展临床试验,病例收集困难,试验周期长,对于3-5年晋升职称的体制,涉足需谨慎!
点评专家:
解放军第八一医院
全军肿瘤中心
刘秀峰教授
3. 影像组学诺模图术前预测GIST恶性潜能
Radiomics nomogram for predicting the malignant potentialof gastrointestinal stromal tumours preoperatively
Tao Chen,Zhenyuan Ning,Lili Xu,Xingyu Feng,Shuai Han,Holger R. Roth,Wei Xiong,Xixi Zhao,Yanfeng Hu,Hao Liu, Jiang Yu,Yu Zhang,Yong Li,Yikai Xu,Kensaku Mori,Guoxin Li
广东南方医科大学南方医院
European Radiology. Published on line: 16 Aug, 2018. https://doi.org/10.1007/s00330-018-5629-2
目的:建立并评估区分GIST恶性危险度的影像组学诺模图。
方法:共纳入222例病理诊断胃肠间质瘤的患者(训练样本,本中心患者n=130;外部验证样本:其他两个中心患者n=92)。采用RELIEF算法对特征子集进行优化选择,利用支持向量机SVM建立鉴别GIST恶性风险度的影像组学模型。评估决定性临床特征和主观CT特征,分别构建相应模型。应用多变量Logistic回归分析筛选的具有统计学显著性的模型建立诺模图。利用ROC曲线对这些模型的诊断效能进行评价。应用校准曲线进一步校准诺模图。
结果:所构建的诺模图在训练样本中的AUC值0.867 (95% CI 0.803–0.932) ,在外部验证样本中的AUC值为0.847 (95%CI 0.765–0.930) 。在整体样本中,影像组学模型、主观CT征象、临床指标模型和影像组学诺模图的AUC值分别为0.858 (95% CI 0.807–0.908), 0.774 (95% CI 0.713–0.835), 0.759 (95% CI0.697–0.821) 和 0.867 (95% CI 0.818–0.915)。诺模图校准良好。
结论:影像学诺模图可较准确预测GIST恶性潜能,可作为指导GIST术前临床决策的有效工具。
【简评】
本年度第四篇GIST人工智能影像组学研究文章,终于重磅打榜,发表在影像学重量级期刊《欧洲放射学》(European Radiology),恭喜广东南方医院的李国新教授团队,早前就听闻此项多中心影像组学研究,本期终于得见真容。虽然研究切入点和之前研究有相似之处,都是发现联合了纹理分析和主观判断征象及临床信息的影像组学评估模型,可以最大效能的预测GIST恶性风险度,但本研究首次以222例的大样本和多中心外部验证设置,将AI技术在GIST的临床应用又推进了一步。针对本文应用的影像组学技术,邀请中科院自动化研究所董迪教授点评如下:研究对CT图像进行尺度和灰度上的标准化后对病灶区域进行三维分割,提取特征后建模(影像组学建模过程为:基于ICC对特征进行组内/组间可重复性测试,选择稳定的特征;使用relief算法进行特征排序;依次将排序前1~M个特征作为输入训练SVM分类器;最终模型为训练集上最高AUC对应的模型),之后再基于Logistic回归联合临床指标和主观CT指标建立影像组学诺模图。此外,还分别使用显著性临床指标和主观CT征象建立模型进行比较。主要评价指标为AUC,结果表明影像组学诺模图显著优于两种传统模型。最后要说的一点,尽管已有多篇文章,尽管本篇文章已达到相当高度,GIST影像AI的研究远未终结;正如作者在文中预言,本研究的方法学对于未来GIST新辅助靶向治疗疗效评价和复发风险度预测提供了有意义的参考。希望更多有兴趣的同道深入探索。
影像诊断科
唐磊 教授
4. GIST循环肿瘤DNA(ctDNA)的无创检测揭示了肿瘤的异质性以及和胃肠间质瘤负荷的相关性
Non-invasive detection of ctDNA reveals intratumour heterogeneity and is associated with tumour burden in gastrointestinal stromal tumour
Namløs HM, Boye K, Meza-Zepeda LA, et al.
Department of Tumor Biology, Institute of Cancer Research, Oslo University Hospital, the Norwegian Radium Hospital
Molecular Cancer Therapeutics. 2018 Aug 9. doi: 10.1007/s12029-018-0157-5.
IF: 5.764
在分子水平分析循环肿瘤DNA(ctDNA)在临床上有巨大的应用前景,该技术可通过无创的方式获得肿瘤特异性的突变结果。 众所周知,胃肠间质瘤的KIT和PDGRFA的突变分析对于临床决策的制定具有至关重要的作用,而传统的通过穿刺获得标本的途径并不利于重复取样和动态监测。
作者通过靶向的二代测序技术对50例胃肠间质瘤患者的ctDNA进行了分析,结果显示44例未进行靶向药物治疗的患者中16例患者检测结果阳性(阳性比例36%),而6例已经进行了一段时间靶向药物治疗的患者中3例阳性(阳性比例50%)。另外,ctDNA的检出和NIH复发风险评估标准密切相关,所有的已发生转移的患者均检出了ctNDA,而未发生转移的患者中检出ctDNA的中位肿瘤直径为13.4cm,未检出的则为4.4cm(p=0.006),这提示了肿瘤负荷是ctDNA能否检出的决定性因素。作者还深入分析了一例接受靶向药物治疗的患者的动态监测结果。该患者在发现伊马替尼耐药的同时即检测出ctDNA中多重耐药突变的存在,进一步分析发现这种多重耐药突变在原发病灶中并不是集中在一处,而且多重突变的丰度也随着不同靶向药物的应用而随之发生变化。
总结:作者的研究提示外周血中ctDNA的检出与否与肿瘤负荷的高低具有相关性,而通过ctDNA的检测可以明确肿瘤整体的不同突变基因及其丰度,从而在肿瘤进展时对后续的治疗起到指导作用。
简评(浙江大学医院附属邵逸夫医院 钱浩然教授):
首先这是一篇回顾性的叙述性的报告,没有研究的设计,仅汇报了50例不同GIST患者NGS的结果,从而提示该文所涉及的研究领域非常接近我们对于GIST认知的边缘,其结果也对今后该领域的研究设计起到重要的提示作用。
个人认为文章的结果给了我们几个重要提示。第一,所有的已经发生转移的患者均检测出ctDNA,这从侧面提出了一个老问题:复发转移GIST患者手术切除是否能达到严格意义上的R0切除?而外科医生必须明确此类手术的真正临床意义所在。第二,超过10cm的原发性GIST中有相当一部分已经出现了ctDNA,此类患者严格意义上是否应归为已有转移的患者?这一假设带来两个衍生的命题:其一,这类患者是否应该按原发性GIST的治疗原则直接手术?其二,这类患者术后伊马替尼治疗是应该按辅助治疗可以在一段时间后停止还是应该按晚期治疗直到病情进展不能耐受为止。第三,在靶向药物的治疗过程中,有效抑或耐药总伴随着ctDNA不同突变基因的消失抑或出现以及丰度的变化。这一现象虽然只分析了一个病例,但给我们的提示是今后研究的重点应该分析ctDNA出现或消失的时段与目前影像学上进展或退缩的时段之间的关系,从而判断应用ctDNA的监测能否提前判定靶向药物的疗效和预知靶向药物的耐药,进一步提早对治疗策略进行相应的调整。这一结果可能会延伸至诸如术前治疗的终止时间选择、术后辅助治疗停药后复发与否的检测等诸多方面。第四,作者对于血浆中ctDNA的突变基因谱和原发病灶的突变基因谱进行了比对,发现了原发病灶中基因突变分布有空间上的差异,即一个位置的标本并不能把所有存在于血浆中的突变基因都检测出。这一结果提示如下:其一,临床上穿刺标本的基因检测结果可能以偏概全。其二,目前病理科分子检测取材的部位是肿瘤细胞最丰富的位置单点取材,这对于原发GIST患者或许影响不大,但对于复发转移GIST患者的分子检测则提出了挑战。“发生了继发性突变没有?肯定有,因为进展了。但不知为什么没有测出。”这段对话大家应该不陌生。
总之,这篇文章立刻激发了我对于GIST患者ctDNA检测的热情和憧憬,多中心的中国数据收集起来,我们会对于上述的猜想有更加明确的答案,而GIST的精准诊治必将跨上一个新的台阶。
致谢:感谢我院分子病理中心江均昌博士对于文中关于ctDNA检测技术细节的解释。
点评专家:
浙江大学医院附属邵逸夫医院
钱浩然 教授
5. 泛FGFR抑制剂BGJ398联合伊马替尼治疗进展期胃肠间质瘤的Ib期临床试验
A phase Ib study of BGJ398, a pan-FGFR kinase inhibitor in combination with imatinib in patients with advanced gastrointestinal stromal tumor.
Kelly CM, Shoushtari AN, Qin LX, et al.
Department of Medicine, Sarcoma Medical Oncology Service, Memorial Sloan Kettering Cancer Center (MSKCC), 1275 York Avenue, New York, NY, 10065, USA.
Invest New Drugs. 2018 Aug 13. doi: 10.1007.
IF:3.26
背景:临床前研究表明,成纤维细胞生长因子( FGF )信号通路可以激活MAP激酶,介导胃肠间质瘤( GIST )对伊马替尼的耐药性。在FGF活化的GIST细胞系中,BGJ398---一种泛 FGFR 激酶抑制剂,联合伊马替尼具有细胞毒性作用,优于伊马替尼单药。在FGF依赖的GIST细胞中,BGJ398和伊马替尼的组合可能有效克服伊马替尼的耐药机制。
方法:这是一个Ib期临床试验,研究对伊马替尼耐药的晚期GIST患者进行BGJ398和伊马替尼联合治疗。标准的3 3给药方案是用于确定推荐的II期剂量( RP2D )。评估了两个包含伊马替尼每日400毫克联用的治疗方案,( A )BGJ每日用药,治疗3周停药1周,或( B )BGJ每日用药,治疗1周停药3周。
结果:16名患者入选。中位年龄54岁(范围: 44 - 77岁),81 %是男性,入组前平均接受过4线[2-6线,13名患者有过≥3线前期]治疗。12名患者按计划A进入试验[BGJ398剂量范围: 25–75 mg ] : 2名患者出现剂量限制毒性( DLT ) ( n = 1,心肌梗死和4级CPK升高;n = 1,3级 ALT升高)时,没有观察到明显的高磷血症,即目标效应,这意味着最大耐受剂量低于治疗剂量。协议修订后,4名患者接受计划B [BGJ398剂量范围: 75-100mg]:未观察到DLTs。最常见的治疗相关不良事件发生在15 %以上的患者中,包括CPK升高( 50 % )、脂肪酶升高( 44 % )、高磷血症( 24 % )、贫血( 19 % ),和周围水肿( 19 % )。在12名可评估的患者中,符合RECIST 1.1版和CHOI标准的最佳反应都是疾病稳定( SD ),分别为7人和9人。3名患者( 25 % )观察到疾病稳定≥32周。中位PFS为12.1周( 95 %CI 4.7-19.5周)。
结论:联合BGJ398和伊马替尼治疗观察到可预期的毒性反应。由于赞助商撤回支持,研究在RP2D或联合用药时间表确定前提前结束。在多线治疗失败的12例可评估的患者中,有3例疾病稳定超过32周。试验注册: NCT 02257541。
【简评】
靶向治疗进展确实是晚期GIST处理的难题。KIT继发突变是最常见的耐药原因,但如本文提到的,没有检测到继发突变的耐药患者,可能由于受体下游旁路激活而逃避伊马替尼的抑制效应。本试验的化合物是FGFR抑制剂,但入组的患者没有经过筛选。也就是包含了各种可能耐药机制的患者。作者解释到这是一期试验,只为爬坡找到合适的剂量和给药方案。可惜制药企业没有继续支持本研究,而导致研究提前结束。期待更多的新药能够在我国开展临床试验,也让我国的患者有机会接受新药治疗。
点评专家:
中山大学一附院
胃肠外科
张信华 教授
龙在江湖
1. 组蛋白去甲基化酶KDM4D通过HIF1β/VEGFA通路促进GIST恶性进展
Histone demethylase KDM4D promotes gastrointestinal stromal tumor progression through HIF1β/VEGFA signalling.
Hu F, Li H, Liu L, et al.
Cancer Research Institute, Tongji Hospital, Huazhong University of Science and Technology, Wuhan, China.
Mol Cancer. 2018 Jul 30;17(1):107. doi: 10.1186/s12943-018-0861-6.
IF:7.776
作者从表观遗传角度入手,结合GIST组织标本,并在体外细胞与动物中探索了组蛋白去甲基化酶KDM4D在GIST恶性进展中的功能与机制。发现KDM4D在GIST肿瘤组织中表达水平明显高于配对正常组织。基于此,在体外细胞系中上调或下调KDM4D表达可以促进或抑制细胞的增殖、迁移和侵袭能力,并且KDM4D通过上调HIF1b、VEGFA表达促进血管生成,上述结果在动物实验中得到验证。机制研究发现,KDM4D通过直接与HIF1b启动子区结合,使组蛋白H3K9me3和H3K36me3去甲基化而激活HIF1b表达。
【简评】
接触GIST这么多年,总有一个感觉:KIT/PDGFRA占据GIST舞台太牢固,别的分子很难获一席之地。这是一篇探索GIST恶性进展的分子机制研究,这种文章看起来比较容易,也是很多研究生喜好的思路,对于整个研究来讲无须过多评论。研究值得学习的地方是实验设计均从上调、下调两方面去验证,这样便提高了结果的可信度。既然作者指出KDM4D/ HIF1b/ VEGFA通路可能是潜在治疗靶点,若文中能加以相应实验探索其对imatinib敏感性影响可能会另有新发现。
消化肿瘤内科
高静 研究员
2、伊马替尼耐药GIST的基因组CRISPR-CAS9基因敲除筛选
Genome-scale CRISPR-Cas9 knock out screening in gastrointestinal stromal tumor with Imatinib resistance.
Cao J, Wei J, Yang P, Zhang T, Chen Z, He F, et al. Department of General Surgery, Guangzhou Digestive Disease Center, Guangzhou First People’s Hospital, Guangzhou Medical University, the Second Affiliated Hospital of South China University of Technology.
Mol Cancer. 2018;17(1):121. Epub 2018/08/15. doi: 10.1186/ s12943-018-0865-2. PubMed PMID: 30103756.
IF: 7.776
应用基因组规模的CRISPR-CAS9基因敲除筛选伊马替尼耐药胃肠道间质瘤(GIST)的新靶点。利用sgRNA文库筛选了20个基因和2个miRNAs,并通过CCK8和qPCR在IM耐药GIST细胞中进一步验证。本研究最终显示9个基因(DBP,NR3C1,TCF12,TP53,ZNF12,SOCS6,ZFP36,ACYP1,和DRD1)参与IM耐药的GITST-T1细胞。TP53和SOCS6可能是IM耐药信号通路中最有希望的候选基因,如凋亡途径和Wnt信号通路、JAK-STAT信号通路。在IM耐药GIST中发现新的靶点是必要的,包括DBP、NR3C1、TCF12、ZNF12、ZFP36、ACPY1和DRD1。
【简评】
CRISPR-Cas9技术操作简单且能精确地剪切基因,目前CRISPR进行功能基因的筛选是逐渐成为趋势,并在研究肿瘤耐药方面也得到了广泛的应用。此前有相关研究通过CRISPR/Cas9技术证明poly⁃comb repressive complex 2,(PRC2)的亚单位EZH2在CML的leukemia-initiating cells (LIC)中过表达,增加对TKI的耐药,为CML治疗中TKI的耐药机制提供了理论基础(1)。同时亦有研究通过整套基于CRISPR进行联合药物靶点的筛选系统,获取一系列有效的联合靶向基因,并得到一系列药物组合丰富干预措施。
而本次研究中,相关学者,通过相似的方法,得出9个参与耐药的基因以及2个最重要候选基因(TP53和SOCS6),为GIST 的IM耐药的机制研究和克服耐药的治疗提供新的思路和理论依据。
目前,尽管作为治疗策略而言,CRISPR/Cas9技术靶向患者体内癌基因尚未成熟,但这种基因治疗方式的前景依然值得期待,相信在不久的将来CRISPR技术能够进行全面的基因功能研究以及遗传性疾病的基因治疗。
点评专家:
四川大学华西医院胃肠外科
张波教授
3. MRI预测GIST靶向治疗疗效:一项基于患者个体的多参数对照研究
MRI in predicting the response of gastrointestinal stromal tumor to targeted therapy: a patient-based multi-parameter study
Lei Tang, Jian Li, Zi-Yu Li, Xiao-Ting Li, Ji-Fang Gong, Jia-Fu Ji, Ying-Shi Sun, Lin Shen
北京大学肿瘤医院影像诊断科、消化肿瘤内科
BMC Cancer (2018)18:811 https://doi.org/10.1186/s12885-018-4606-0.
IF: 3.288
目的:比较MRI各定量参数在早期预测GIST靶向治疗疗效的效能。
方法:62例患者于靶向治疗前、治疗后2周和12周分别行1.5T MRI检查,其中伊马替尼治疗44例,舒尼替尼治疗18例。在T2WI图像测量计算肿瘤长径LD及对比噪声比CNR,在DWI图像(b=0,1000)测量ADC值。比较治疗有效组和反应不良组间,上述三个参数疗前绝对值和疗后早期变化率%Δ的差异,并利用ROC曲线判断评效截割点。
结果:治疗有效患者42例,反应不良患者20例,靶向治疗两周后,ADC和LD值的变化率在两个疗效组间差异存在统计学显著性 (ADC: responder 30% vs. non- responder 1%, Z = − 4.819, P < 0.001; LD: responder − 7% vs. non- responder − 2%, Z = − 3.238, P = 0.001)。而T2WI-CNR未见统计学差异 (responder − 3% vs. non-responder 9%, Z = − 0.663, P = 0.508)。治疗两周后各参数变化率%ΔLD,%ΔT2WI-CNR和%ΔADC预测疗效的AUC值分别为0.756, 0.552 和 0.881。取 %ΔADC ≥15% 作为预测治疗有效的截割点,阳性预期值可达93.3%。
结论:GIST靶向治疗后两周的ADC值变化率,可较 T2WI-CNR和长径变化率更好的预测早期疗效。
【简评】
第一次点评自己团队的文章,须得保持清醒和客观。其实这是篇技术上没什么创新,短期内也看不到临床应用前景的文章。打动评审的亮点之处可能在于:以患者为单位的研究(之前同类研究多以病灶为单位)向临床又推进了一步,GIST DWI评效研究相对大的样本量,早期预测,多参数比较确立ADC值的地位,给出了阈值(%ΔADC ≥15%判断治疗有效,%ΔADC ≤1%判断反应不良),最后AUC达到0.881也算中等偏上水平。不管怎么说,第一篇和李健教授正式合作的文章,历经一年波折,总算嫁出去了。DWI是个好技术,可惜没生在好时代,总被各种研究亮点抢风头,又因多中心验证的诸多阻碍,难以临床推广,目前只能在人工智能的光环下踽踽前行。真心希望哪位大咖能够振臂一呼,数百上千例参数一致的多中心DWI堆叠一个GIST评效标准出来,然后像PET那样修成正果,写入指南。
4. 转移性胃肠间质瘤减瘤手术后舒尼替尼对比伊马替尼治疗的国内多中心队列研究
Cytoreductive surgery for metastatic gastro-intestinal stromal tumors followed by sunitinib compared to followed by imatinib-a multi-center cohort study
Xinhua Zhang , Ye Zhou, Xin Wu, Mingming Nie, Bo Zhang, Yongjian Zhou, Lifeng Sun, Zimin Liu, Xiufeng Liu, Youwei Kou, Yongpeng Wang, Yefan Zhang, Chunyi Hao, Lin Shen, Jian Li.
中山大学一附院胃肠外科、北京大学肿瘤医院消化肿瘤内科
European Journal of Surgical Oncology. 2018 Aug 11. pii: S0748-7983(18)31268-X. doi: 10.1016/j.ejso.2018.08.001. [Epub ahead of print]
IF: 3.688
胃肠间质瘤出现耐药后接受减瘤手术治疗,术后的药物选择存在争议,本研究评估接受伊马替尼标准治疗出现局灶性进展或广泛性进展后接受理想减瘤手术,直接换用舒尼替尼对比继续伊马替尼治疗(包括增加剂量)的疗效差异。共97例患者入组,其中41例为术后舒尼替尼治疗组,56例为伊马替尼治疗组,30例局灶进展患者,67例广泛进展患者,43例接受R0/R1手术,54例接受R2手术,最终,减瘤术后直接换用舒尼替尼组患者PFS优于继续伊马替尼治疗组(30.0月vs 12.0月, P=0.009);亚组分析中,舒尼替尼组在广泛性进展患者中,优于伊马替尼组(25.5月vs 12.0月,p=0.008),局灶性进展患者中显示改善趋势(39.0月 vs 13.0月, p=0.156);直接换用舒尼替尼组对比继续伊马替尼耐药后再次换用舒尼替尼的总体PFS比较中,直接换用舒尼替尼依旧占优(30.0月vs 21.0月,p=0.012),两组总生存无显著性差异(37.0月 vs 33.0月)。研究认为,伊马替尼耐药后接受理想减瘤的患者,直接换用舒尼替尼对比继续伊马替尼可能获得更好的肿瘤控制时间。
【简评】
当时之所以想开展这样一项队列分析,主要基于在中国癌症基金会索坦援助项目中,关于伊马替尼耐药R0术后换用舒尼替尼是否给予赠药问题的争论,争论的根源在于缺乏临床证据,我们重新检索了pubmed文献,的确国内外尚无任何一项研究关注于这个领域,当时,徐建明老师也建议我们可以开展这里领域的研究为援助项目提供依据。本项研究也得到了辉瑞的支持与索坦探索者俱乐部成员的积极响应,在短期内收集了比预想中高出很多的高质量病例,使得这项队列分析得以快速并顺利地完成,并在今年ASCO年会进行了汇报交流。
这个研究从总体结果分析,有两个主要关注点,(1),耐药接受减瘤手术后直接换用舒尼替尼可能优于伊马替尼,即使在局灶性进展患者也显示了改善的趋势,(2),PFS的改善显然超出了舒尼替尼对比伊马替尼在晚期GIST III期临床研究中的数据,提示高质量的减瘤手术与克服耐药的后续TKI结合,可起到彼此疗效放大的作用。在ASCO汇报期间与几位国际GIST大牛关于本文的讨论及投稿期间审稿人(高度怀疑是芬兰的Joenssu教授)给予直接的问题挑战与建议,均使大家获益良多。不过本文作为回顾性的队列分析,依旧存在着诸多局限,文章的结果仅仅是为耐药术后患者的TKI选择提出了新的问题与研究方向,期待未来能开展前瞻性对照研究去给予更加明确的答案。
当然,这个研究还有一个最大的遗留问题,处理不好必将会对未来的多中心研究带来灾难性的后果,参与中心的临床研究观察费笔者还没有付呢!
李健 教授
5. 内镜下切除胃间质瘤时的肿瘤破裂:是腹膜转移的危险因素吗?
Tumor rupture of gastric gastrointestinal stromal tumors during endoscopic resection: a risk factor for peritoneal metastasis?
Shiyi Song, Wei Ren, Yi Wang, Shu Zhang, Song Zhang, Fei Liu, Qiang Cai, Guifang Xu, Xiaoping Zou,Lei Wang
Department of Gastroenterology, The Affiliated Drum Tower Hospital of Nanjing University, Medical School, Nanjing, China.
Endosc Int Open. 2018 Aug;6(8):E950-E956. doi: 10.1055/a-0619-4803. Epub 2018 Aug 1.
IF:暂无.
背景与研究目的:胃肠道间质瘤是最常见的消化系统间质源性的肿瘤。目前对于直径>2cm的肿瘤,公认的最佳治疗方法是采用外科手术将其完整切除。众所周知,术中肿瘤破裂是腹膜转移的一个独立的危险因素。然而,目前尚不清楚肿瘤在内镜切除术中破裂是否会增加腹腔转移的风险。
患者和方法:本研究自2014年1月至2016年12月共治疗195例患者。根据内镜手术中肿瘤是否破裂而将他们分成两组。根据随访结果调查两组穿孔患者的腹膜转移率。
结果:所有患者中约55.4%为女性,研究组平均年龄为59±10.3岁。195例患者中,27例肿瘤破裂,168例患者行整块切除。两组性别、年龄差异无统计学意义。所有患者的中位肿瘤大小(最大直径)为1.5厘米(0.3-5.0cm):肿瘤破裂组和全切除组分别为2.5cm(0.8~5.0cm)和1.4cm(0.3~4.0cm)(P<0.001)。肿瘤大多位于胃底。中位随访18.7±10.2个月,既未发现肿瘤复发(肝转移、腹膜转移、局部复发),也未发现与GIST相关的死亡率。
结论:内镜下胃间质瘤切除术中的肿瘤破裂可能不是腹膜转移的危险因素。
【简评】
GIST瘤体破裂作为独立危险因素这一观点成为国际共识已有10年,国内外关于GSIT复发评分体系的补充和完善也一直在进行中。本文结果的准确性和可重复性暂且不论,但是对内镜下小GIST危险因素的思考值得学习。在内镜医生“大展拳脚”的背景下,我们不可否认内镜手术的优点,但对于其并发症还是要有抱有冷静客观的态度,拿出更多高级别的证据。回到本研究,其出发点是好的,但是结果主要受限与以下几点:1随访时间过短,短的甚至难以观察到临床事件;2样本数量较小,说服力较弱。另外我们注意到肿瘤破裂组与全切组瘤径分别为2.5cm和1.4cm。说明直径较大的肿瘤其肿瘤破裂发生率也越高,而且内镜下肿瘤的切除与内镜医生的操作水平密切相关,这是影响研究结果的重要因素。在上期月评中一篇内镜切除小GIST长期疗效分析的文章中,其内镜肿瘤破裂发生率3.5%,本文为13.85%,不同中心10%左右的差距足以说明该问题。最后,文章中“内镜下胃间质瘤切除术中的肿瘤破裂可能不是腹膜转移的危险因素”的结论仍需要更多研究支持。
点评专家:
南京医科大学第一附属医院
胃肠外科
徐皓教授
6.利用Joensuu提出的复发风险评分评估接受伊马替尼辅助治疗胃肠间质瘤患者的复发风险:一项回顾性队列分析
Using the recurrence risk score by Joensuu to assess patients with gastro-intestinal stromal tumor treated with adjuvant imatinib: A retrospective cohort study.
Tang J, Zhao R, Xu M, et al.
Department of Gastrointestinal Surgery, West China Hospital, Sichuan University, Chengdu, Sichuan Province, China
Medicine (Baltimore). 2018 Jul;97(29):e11400. doi: 0.1097/ MD.0000000000011400.
IF:2.028
研究利用Joensuu教授在2014年发表的基于SSGXVIII/AIO研究得出的复发风险评分RRS标准,回顾性评估华西医院2005-2017年期间接受伊马替尼辅助治疗的高危GIST的复发风险。共137例患者入组,依据计算的RRS,分别以1.62与2.61为界,分为低危、中危、高危三组,最终无论在伊马替尼辅助治疗≤36月,或辅助治疗≥36月患者中,三组患者的RFS具有显著性差异。提示RRS评分可有效用于接受伊马替尼辅助治疗GIST患者的复发风险评估。
【简评】
这是一篇可以看做对Joensuu教授提出的RRS进行验证的研究,尽管是回顾性分析,依旧有借鉴价值,特别是在中高危GIST术后均在接受伊马替尼辅助治疗的年代。RRS评分与NIH危险度分级分别用于两个不同的阶段评估,NIH分级用于评估患者术后的复发风险以及是否需要接受辅助治疗以降低风险,RRS评分是评估在接受伊马替尼辅助治疗之后患者的复发风险,因此,随着越来越多的患者接受辅助治疗,RRS评分会更多的用于风险的预测,更直接的价值可能用于评估患者辅助治疗的时间,对于RRS评分预测复发风险较高的患者,延长伊马替尼辅助治疗时间能否进一步降低风险,同样需要前瞻性RCT来确认。
近日,北大医学部已经正式通告,Medicine和几个所谓的水刊已明确不被学校认可,包括毕业与晋升,笔者认为这对致力于治学严谨的高等学府来说是好事,但对于已经投稿接受或刚刚发表在几个被禁刊物的年轻医生来说是不公平的,水刊的问题在于期刊而不在投稿者,用别人的错误惩罚自己的孩子怎么说都不太合理!但是我等屁民也只有发发牢骚的份,要想改变规则只有一个办法:努力去成为制定规则的人!
点评专家:
北京大学肿瘤医院消化肿瘤内科
李健 教授
7.胃肠间质瘤评估预后的分子标志
Molecular biomarkers for prognosis of gastro-intestinal stromal tumor.
Liu X, Chu KM.
Department of Surgery, The University of Hong Kong, Pokfulam, Hong Kong.
Clin Transl Oncol. 2018 Jul 12. doi: 10.1007/s12094-018-1914-4.
IF:2.392
这是一篇关于胃肠间质瘤预后分子标志物的综述,包括经典的kit/PDGFRA突变、野生型GIST的基因检测、miRNA的预后价值、液体活检在GIST预后的意义等。其中,kit/PDGFRA突变分析中,依旧回顾了不同基因分型的影响,特别是557-558缺失的不良预后与PDGFRA突变患者的惰性生物学行为;野生型GIST中,回顾了BRAF突变与SDHB缺陷型患者的特征与预后;在miRNA的分析中,系统回顾了8个与预后正性或负性相关的miRNA,以及对Kit通路下游信号传导的影响;液体活检回顾了cfDNA研究、伊马替尼治疗前后外周血kit水平的变化,与NGS在液体活检中的应用。
【简评】
感觉又是一篇clin transl oncol杂志的约稿,近期该杂志频繁约稿发表各种GIST相关述评,其中不乏热点话题的精品,在前几期的月评中也分别有所推荐。本期综述新颖度不高,但还是回顾了与GIST预后相关较为详细的数据。在预后分析中,传统的危险度分级与基因分型依旧是评估预后最为直接、客观且便捷的指标,而液体活检相信会成为GIST未来精准治疗领域中非常重要的环节,无论是克服GIST异质性、动态实时检测、生物学样本的获取等,都具备明显的优势,液体活检不仅限于外周血,其实尿液、唾液中肿瘤DNA与相关特异性标记的检测等完全有可能成为评估肿瘤的重要生物学样本,到那时,人们常说“撒泡尿照照自己”将会真的成为现实。
8.肝脏原发性胃肠道间质瘤一例
Primary gastrointestinal stromal tumor of the liver.
Hai-Jie Hu, Yi-Yun Fu, Fu-Yu Li. Author Affiliations: Department of Biliary Surgery; Department of Pathology; West China Hospital of Sichuan University, Chengdu 610041, Sichuan Province, China.
Clinical Gastroenterology and Hepatology. 2018 Aug 2. pii: S1542-3565(18)30800-0. doi: 10.1016/j.cgh. 2018.07.035.
IF:7.683
一位79岁老年女性患者因“上腹不适”2周就诊。增强CT提示肝右后叶低密度病灶,大小约3.2cm,边界清晰,增强不均,内见液化坏死。行根治性手术切除,病理诊断为胃肠道间质瘤(CD117 , DOG-1 ,CD34 )。术后胃、肠内镜检查未发现占位病变,腹部增强CT未发现其他病灶。患者术后1月予伊马替尼辅助治疗。对比胃和小肠GIST,原发肝GIST生存更差。
简评(中山大学附属肿瘤医院结直肠科 ,伍小军教授、肖斌毅医生):
这是一篇来自我国四川华西医院胆管外科和病理科的个案报道,报道1例原发于肝脏的胃肠道间质瘤。一般认为,胃肠道间质瘤起源于胃肠道节律细胞——Cajal细胞,但原发于胃肠道以外的间质瘤(E-GIST)也偶有报道。有学者认为这些病灶为转移瘤可能性大,而原发瘤尚在胃肠道,只是仍未发现,且转移的胃肠道间质瘤目前无法通过免疫组化判断出起源部位。该报道中,患者虽然通过胃肠镜和增强CT检查排除原发于消化道的可能,但由于GIST起源于黏膜下,当呈外生性生长时内镜下难以发现,且小肠GIST瘤体较小时CT下亦有漏诊可能。笔者在临床中还未碰到这样的病例,如果在服药前有全身PET-CT或鹰眼检测进一步排除原发灶或许就更有说服力。或是否存在,找不到原发灶,只有转移灶存在的隐匿性GIST的可能?或是否可能起源于肝迷离瘤上的Cajal细胞?总而言之,该报道的原发于肝的GIST病例极为罕见,进一步扩展了GIST的起源部位,略遗憾的是未见基因检测的结果,值得大家进一步关注其病情变化和预后情况,这类患者也值得进一步汇总和研究。
点评专家:
中山大学附属肿瘤医院
结直肠科
伍小军 教授
肖斌毅 医生
百家争鸣
1. 舒尼替尼及其异构体在临床治疗药物监测中的分析方法
Analytical aspects of sunitinib and its geometric isomerism towards therapeutic drug monitoring in clinical routine.
Posocco B,Buzzo M, Toffoli G, et al.
Experimental and Clinical Pharmacology Division, Department of Translational Research, IRCCS - National Cancer Institute, Italy.
J Pharm Biomed Anal. 2018 Aug 8;160:360-367. doi: 10.1016/j.jpba.2018.08.013.
IF: 暂无
舒尼替尼,一种口服多靶点TKI药物,可用于治疗晚期肾癌,胃肠间质瘤以及高分化的神经内分泌肿瘤,被认为是一种可以用于确认药物监测方法的潜力药物。然而,临床上对舒尼替尼及其活性代谢物(N-去乙基舒尼替尼)的药物浓度测定的方法,却因为舒尼替尼Z型/E型异构体暴露在光下面不稳定而受到限制。已经发表的几种LC-MS/MS方法都需要在样品处理过程中避光,以防止形成E型异构体,但是这样对于临床应用来说操作性并不强。
为了寻求一个简单而快速的方法来重新转化E型异构体,在样品收集和处理过程中要避光,并且为了让Z型异构体峰值单独可以被测量,我们特别研究了在血浆基质逆反应条件下的Z/E型光降解方案。
在曝光30分钟后,E型异构体在两种分析物达到最大比例(E-舒尼替尼的44%和E-N-去乙基舒尼替尼的20%,这两个比例之和用于对应计算E Z型异构体总和)。除此之外,在降低溶液的PH值后E型异构体的形成增加至20%。由于当曝光的溶液重制于暗处会发生逆反应,我们遵循E型到Z型转换的药代动力学进行自动取样器操作。当自动取样器设置为4摄氏度时转化率非常慢(4小时后,舒尼替尼的E型异构体的平均百分比为50%,N-去甲基舒尼替尼的平均百分比为22%)。 当温度增加时,转化比例显著增加。而当分析夜在70度的水温中水浴加热5分钟,我们却可以得到E型向Z型异构体99%的再转化,并且当酸被抑制时,未观察对到浓度的影响。
基于这些结果,我们得到一种简单而快速的方法可以用来在无光保护的情况下样品采集和处理过程中进行E型异构体的转化,从而能够得到单一的峰来测量。 由于其可操作性高和速度快,该附加步骤的应用使得新开发的LC-MS/MS方法更符合临床实践。
----总结、翻译:辉瑞制药 范雯霏女士
【简评1】
文章介绍了一种快速、简单的检测舒尼替尼及其活性代谢物(N-去乙基舒尼替尼)血药浓度的方法。舒尼替尼有两种异构体(E型和Z型),Z型异构体比较稳定,容易测定。E型异构体不稳定,临床难以测量其血液浓度。而且当暴露于光线下时,Z型异构体会向E型异构体转换,使得舒尼替尼及其活性代谢物的血药浓度变得难以测量。过去的试验方法,都是在避光的情况下提取和测量血药浓度,来确保Z型异构体不向E型转化。但是过往报道的这些方法临床操作性都不是很好。并且影响E型/Z型转化的原因并不仅仅是光照,还包括溶剂、PH值等。本文主要是介绍了一种全新的测量舒尼替尼血药浓度的方法:快速有效,不受光线影响,且能使E型异构体都向Z型异构体转换的方法。
临床医生对于伊马替尼的血药浓度监测都非常感兴趣,且开展血药浓度检测的单位越来越多。伊马替尼的血液浓度与药物的不良反应以及药物疗效相关,临床医生希望通过监测伊马替尼的血药浓度来调整患者的服药剂量。近年来,随着舒尼替尼的应用越来越多,大家对于舒尼替尼的不良反应也越来越关注。很多临床医生都希望通过监测舒尼替尼的血药浓度来调整药物剂量,从而来降低不良反应。但是舒尼替尼的有效血药浓度的阈值是多少,是一个国际上都没有给出答案的问题。近期很多临床医生都希望进行舒尼替尼的血药浓度检测相关的研究,但是也都停留在有想法的阶段而已。对于如何检测舒尼替尼血药浓度的方法学的探索,在国内并未真正开启。希望本篇文章能够为有兴趣开展舒尼替尼血药浓度检测试验的单位提供帮助。
客座点评员:
辉瑞制药
范雯菲 女士
【简评2】
首先感谢具有资深药学背景的范雯霏女士对本文给予精确的翻译、总结及精彩的点评,这篇文章研究方向属于药学专业,着实超出了笔者的理解能力,对于本篇关于方法学的内容笔者不做过多论述(当然也论述不出来什么),从临床应用角度来说,舒尼替尼的血药浓度检测对于指导临床治疗还是很有帮助的,一方面是大家所熟悉的药物浓度可以协助处理药物不良反应,另一方面,临床中可以见到舒尼替尼耐药后,部分患者增加舒尼替尼剂量后可能获得进一步的肿瘤控制,同时未发生严重的不良反应,如果能进行血药浓度的检测将有助于我们确认是否随着服药时间的延长,舒尼替尼的血药浓度会出现下降,从而导致部分患者后期出现肿瘤控制不佳的现象。
这篇文章还给临床医生另一个重要的提示,即,我们在关注一些检测方法能否为解决临床问题的同时,也需要了解我们所选择的检测方法是否合理,选择的检测中心资质是否可靠,但临床医生对其他领域的知识肯定是相对缺乏的,所以经常被一些“志不在科研而在圈钱”的公司们描绘出的新英格兰大饼忽悠得一愣一愣的!
2. Ki67指数与胃肠间质瘤复发的相关性研究
Association of ki67 Index with Recurrence in Gastrointestinal Stromal Tumors.
Segales-Rojas P, Lino-Silva LS, Aguilar-Cruz E, et al.
1.Surgical Pathology, Instituto Nacional de Cancerología, Mexico City, Mexico;
2.Gastrointestinal Pathology Division, Instituto Nacional de Cancerología de México (Mexico’s National Cancer Institute, Av. San Fernando # 22, Sección XVI, Tlalpan, CP 14080 Mexico City, Mexico;
3.Surgical Oncology, Instituto Nacional de Cancerología, Mexico City, Mexico.
J Gastrointest Cancer. 2018 Jul 31. doi: 10.1007/s12029-018-0150-z.
IF:暂无
目的:胃肠间质瘤(GIST)具有复发和转移的潜能。既往已有一些影响预后指标的研究进展,然而在临床实际当中病理医生在面对微小活检标本时很难去评价核分裂像。我们的研究旨在探讨Ki67指数以及其他临床病理特征对于影响GIST复发的关系。
方法:43例连续GIST病例纳入研究。所有病例均没有远处转移。我们比较了术后复发组和没有复发组的临床病理特点。Ki-67指数通过每平方毫米进行检测。
结果:中位年龄55岁(IQR45-63),最常见的发病部位是胃(约占48.8%),中位肿瘤直径为10cm(IQR5.5-17.5)。26例为梭形细胞型肿瘤(60.5%),13例为混合型(30.2%),4例为上皮型(9.3%)。50个高倍视野下中位核分裂像为4(IQR-16),而换算成每平方毫米则核分裂像为1(IQR0-5,范围0-32)。中位KI67增殖指数为5%(IQR1-20)。在研究期间,共计11例(25.6%)患者发生了复发。复发组和无复发组之间只有性别和肿瘤大小存在显著差异。
结论:我们没有发现Ki67与复发相关。影响复发的因素主要为更大的肿瘤直径(>10cm)和男性病人。
【简评】
这是一篇来自墨西哥的小样本回顾性单中心横断面研究,研究跨越了2000年至2015年,共计纳入43例病人。作者将研究期间是否发生复发作为分组标准分为了复发组和无复发组。然后通过单因素分析,纳入包括年龄、性别、治疗方式、预后、肿瘤部位、组织学类型、是否有丝团样纤维、淋巴结受侵、血管受侵、肿瘤大小、核分裂像、Ki67指数、肿瘤内淋巴细胞个数、横纹样细胞、粘膜受累或溃疡、呈现多型性等临床病理指标。单因素结果显示只有男性和肿瘤直径大于10cm显著增加肿瘤复发。本文通过ROC曲线发现Ki67指数在3.5%对于肿瘤复发是cutoff值。但文中以3.5%为界,复发组和无复发组中0-3.5%和大于3.5%的比率卡方检验未见明显差异。随后研究也进行了多因素分析发现只有男性是唯一影响复发的独立影像因素。通常Ki67指数代表了肿瘤细胞的增殖指数,是判断肿瘤细胞活跃程度的一个非常重要的指标。其实近年来对于Ki67是否可以作为预测胃肠间质瘤恶性程度的指标,是争论的热点。部分研究支持Ki67与核分裂像成正相关,甚至在预测预后方面要好于核分裂像。另一部分研究则得出相反结论,发现Ki67与预后无关。上述研究均存在Ki67判读标准不统一的问题,要么借鉴其它肿瘤进行Ki67数值节点分析,要么进行分层分析找到节点,本文则采用ROC曲线方法找到影响肿瘤复发的Cutoff值,然后运用卡方检验证实在复发组和无复发组Ki67分布比例未见差异,因此得出Ki67不影响预后的结论。评阅本文后我们认为这种统计学方法可能存在问题,需要统计学专家好好判读。一般来讲影响预后的单因素分析通常使用Kaplan-Meier曲线log-rank检验分析。尽管文中在方法中描述了对于预后分析中单因素和多因素采用log-rank检验。但我们认真阅读全文后发现表1为计数资料采用卡方检验,表2为计量资料采用秩和检验。而表3应为单因素预后分析,该文中仍采用卡方检验,貌似不妥。我相信这也是本文ROC曲线得到Cutoff值,但单因素分析又无统计学差异的原因。Ki67指数是否与预后相关未来还得寄希望于基于人口的大样本多中心数据库结果的高质量研究来揭示。
点评专家:
北京大学人民医院
胃肠外科
高志冬 教授
3. 动脉期CT影像对胃肠间质瘤肝转移诊断敏感性的评估
Evaluating the Sensitivity of Arterial Phase CT Images for Detection of Hepatic GIST Metastases.
Patel M, Jilani D, Oto A, Patel P.
Department of Radiology, The University of Chicago Medicine, Chicago, Illinois.
Tomography. 2017 Jun;3(2):101-104. doi: 10.18383/j.tom.2017.00007
IF:不详
【简评】
本文认为动脉期对于GIST肝转移的诊断意义不大,有误导之嫌,试验设计也不够严谨,不建议刊出。
文献综述
1. 瑞戈非尼Regorafenib
Thomas J. Ettrich and Thomas Seufferlein
Department of Internal Medicine I, University of Ulm, Albert-Einstein-Allee 23, 89081 Ulm, Germany
Recent Results Cancer Res. 2018;211:45-56. doi: 10.1007/978-3-319-91442-8_3.
IF:不详
瑞戈非尼(BAY 73-4506,stivarga®)是一种口服的多激酶抑制剂作用靶点为血管生成(VEGFR1-3,TIE2)、间质(PDGFR-b, FGFR )以及致癌受体酪氨酸激酶(KIT,RET和RAF)。瑞戈非尼是在转移性结直肠癌所有标准治疗后,第一个被证实可以有生存获益的小分子多激酶抑制剂。因此,美国食品药品管理局(FDA)在2012年批准了瑞戈非尼的该项适应症。此外,在标准治疗后进展的转移性胃肠间质瘤(GIST),瑞戈非尼与安慰剂对比,明显改善了患者的无进展生存(PFS),而在2013年被FDA批准了新适应症。在2017年,FDA批准瑞戈非尼用于经索拉菲尼治疗后进展的晚期肝癌,因瑞戈非尼与安慰剂对比,明显改善患者的PFS和总体生存时间(OS)。瑞戈非尼同样在其他瘤种中开展了临床研究(大部分为II期),包括肾细胞癌(RCC)、软组织肿瘤(STS)以及其他正在进行的III期研究(如二线和三线治疗甲状腺髓样癌,nct02657551)。
【简评】
瑞戈非尼自2012年FDA批准用于转移性结直肠癌开始,后续增加了胃肠间质瘤和肝癌的适应症,目前也是临床研究的较为热门药物之一。该文作者详细的介绍了瑞戈非尼的结构、作用机制、药物动力学、临床前研究、临床试验数据、毒副反应以及药物之间相互作用,是篇大而全的综述。本文作者早在2014年在同一杂志上曾经发表了该综述,在此基础上进行了更新,特别是肝癌相关的数据,但大部分文字是原封不动的复制黏贴了2014年的内容。在胃肠间质瘤领域,主要引用了2013年发表在Lancet杂志的GRID研究数据,在标准一线伊马替尼二线舒尼替尼治疗失败后的患者,瑞戈非尼与安慰剂对比明显延长PFS(4.8个月vs 0.9月),且总体耐受性良好,一举奠定了瑞戈非尼三线标准治疗的地位,随着2017年在中国的上市,国内使用该药物的患者也越来越多,治疗上的优化也值得进一步研究,2018年ASCO年会不少关于瑞戈非尼的报道,包括剂量改良、时程改变以及寻找生物标记物鉴别优势人群等。我们也期待随着对该药物研究的深入,不断提高临床疗效和降低不良反应。
点评专家:
中山大学肿瘤医院胃外科
邱海波教授
经典个案
1.气垫征阳性的胃GIST囊性变1例(病例报道)
Atypical presentation of a cushion sign-positive stomach gastrointestinal stromal tumor with cystic formation: A case report
Okagawa Y, Sumiyoshi T, Ihara H et al.
Department of Gastroenterology, Tonan Hospital, Sapporo, Hokkaido 060-0004, Japan.
Mol Clin Oncol. 2018, 9(2):168-172. doi: 10.3892/mco. 2018.1639.
IF: 无
胃肠间质瘤(GIST)通常表现为实性肿块,囊性变少见。伴囊性变的胃GIST多发生于胃壁外,常误诊为胰腺或肝脏来源的囊性肿瘤。本文报道了一位无症状的72岁男性接受胃镜检查,发现胃角前壁一直径约5cm黏膜下肿瘤(SMT),质地柔软,内镜下气垫征阳性(见图1)。内镜超声及增强CT显示该囊性变肿瘤伴部分实性成分(见图2A)。经过腹腔镜和内镜双镜联合手术切除肿瘤(见图2B),组织病理学检查显示肿瘤为GIST伴囊性变。据作者所知,这是首例有文献记载的气垫征阳性胃GIST伴囊性形成。该病例提示,当肿瘤具有固体成分时,即使内镜下表现为气垫征阳性SMT,临床上也应警惕GIST囊性变的可能。
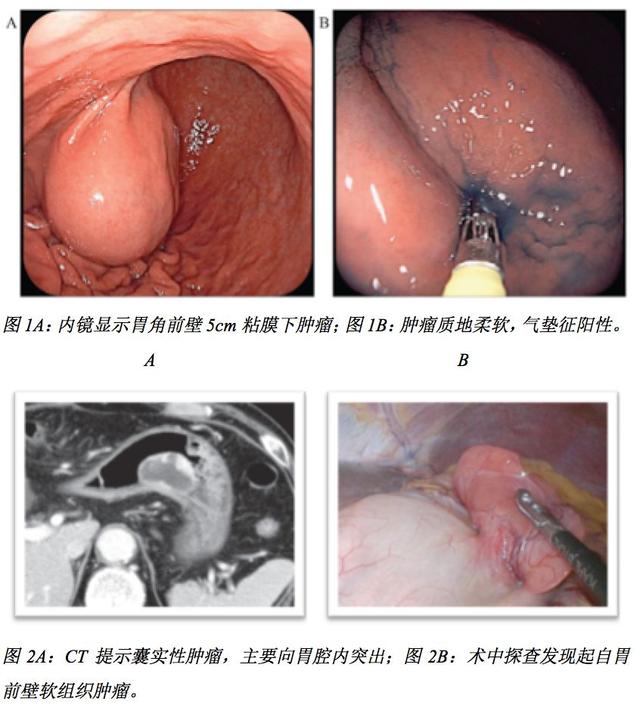
【简评】
刚看了本文标题还以为是一例合并库欣综合征的GIST,读完才发现闹了乌龙,此cushion sign(气垫征)非彼Cushing syndrome(库欣综合征)。“cushion征”是啥,相信不是搞内镜的未必了解(太多sign了,就算以前记住也忘了,此处心疼医学生30秒),容我科普一下:cushion征是指内镜下对粘膜下肿瘤(SMT)以活检钳进行压迫,瘤体会出现受压部分光滑的凹痕,一般见于质地柔软的良性肿瘤如脂肪瘤或淋巴管瘤。本文以“cushion征”为卖点,写出一篇“首例报道”的病例报道,但是该患者的后续治疗乏善可陈:未做基因检测,未辅助治疗,随访40个月未见复发。其实临床上cushion征阳性的GIST并非罕见,只是缺少有心人加以总结。本文的图2B术中探查照片让我想起一年前我中心收治的1例年轻女性GIST患者,同样表现为胃粘膜下囊实性肿瘤,术中探查所见与本文照片中相当相似,最后这例患者的基因突变类型为少见的PDGFRA 12外显子突变,也许本文报道的病例具有同样的基因型。不过作者在最后讨论部分提出了一个值得临床探讨的问题:在预测肿瘤复发风险时,那部分囊性变的肿瘤是否应该以把囊性变成分计算在内?作者对此持否定态度,因此最终患者没有接受辅助治疗(如果纳入囊性变成分,本例属于中度复发风险,有辅助治疗指证)。但是由于囊性变GIST临床上病例相对较少,要回答这个问题尚有待于进一步的积累探索。
点评专家:
上海交通大学医学院附属仁济医院
胃肠外科
汪明教授
2. 经肛门微创手术治疗直肠高危GIST 1例
Management of a case of high-risk gastro-intestinal stromal tumor in rectum by transanal minimal invasive surgery.
Nepal P, Mori S, Kita Y, et al.
Department of Digestive Surgery, Breast and Thyroid Surgery, Graduate School of Medicine, Kagoshima University, Sakuragaoka 8-35-1, Kagoshima, 890-8520, Japan.
World J Surg Oncol. 2018 Aug 11;16(1):165. doi: 10.1186/s12957-018-1463-x.
IF: 1.792
背景:直肠GIST是一种临床罕见的胃肠道肿瘤,其手术治疗需要特别注意保留肛门和泌尿功能。经肛门微创手术(TAMIS)是一种用于局部切除良性和早期恶性肿瘤的成熟的微创技术,然而,将TAMIS用于直肠GIST的报道鲜见。我们现在报告1例将TAMIS技术创新应用于直肠GIST并且保留肛门和泌尿功能的案例。
病例报告:一位有便血病史的67岁女性,被诊断为直肠右后壁黏膜下GIST,肿瘤直径4.5cm,距离肛缘7cm。活检组织学显示:大量的梭形细胞成束排列,CD34阳性,c-kit、desmin、SMA和S-100均阴性。采用TAMIS技术成功切除肿瘤。最终组织病理显示:肿瘤为pT2且c-kit阳性伴核分裂像10/50HPF。患者术后无并发症,伊马替尼辅助治疗3年。
结论:在综合评估肿瘤大小、深度、部位之后,有经验的外科医生可以将TAMIS技术安全地应用于直肠GIST的治疗。
【简评】
这是一篇来自日本鹿儿岛大学医学院的经肛门微创手术(TAMIS)治疗直肠GIST的临床个案报道。直肠GIST虽在临床罕见,但因其部位特殊,并且涉及控便和泌尿功能,一旦处理不当将严重影响患者的生活质量;所以,临床治疗直肠GIST在考虑完整切除的同时,还应尽可能保留其肛门、泌尿功能。报告者成功使用TAMIS技术完整切除了一例最后组织学证实为高危的直肠中段GIST。相应的经验值得外科医师学习借鉴。GIST的R0完整切除是临床治疗GIST的基本原则。对于直肠GIST而言,具体术式需要依据肿瘤的大小、部位、深度和主诊医师的临床经验来综合考量和选择,术前的影像学检查(盆腔CT或MRI)对于评估上述参数非常重要,肿瘤位于后壁需警惕损伤骶前静脉丛和下腹下神经分支、位于前壁需警惕损伤阴道或尿道、位于侧方需要警惕损伤闭孔血管分支。国内学者已经开始将TaTME技术推广用于低位直肠癌的治疗,相比TAMIS而言,TaTME操作更加复杂,切除也更加完整和彻底。所以,当遇到常规手术处理特别困难的直肠GIST时(比如高危、侵犯全层、骨盆狭窄的男性等),TaTME也不失为一种术式选择。
点评专家:
空军总医院
普通外科
顾国利 教授
3. 急诊腹腔镜胃切除术治疗胃GIST腹腔内破裂出血
Emergency Laparoscopic Gastrectomy for Intraperitoneal Ruptured Gastric Gastro-intestinal Stromal Tumor
Kutay Saglam, Fatih Sumer, Cihan Gokler, Ayse Nur Akatli, Cuneyt Kayaalp
1.Department of Gastrointestinal Surgery, Inonu University, 44315 Malatya, Turkey.
2.Department of Pathology, Inonu University, Malatya, Turkey.
Journal of Gastrointestinal Cancer. https://doi.org/10.1007 /s12029-018-0157-5
背景:胃肠道间质瘤(GISTs)是最常见的胃肠道间叶源性肿瘤。可发生位于胃肠道的任何部位,最好发于胃,其次是小肠。多数没有临床症状,但出现的主要症状与肿瘤大小相关。随着肿瘤进展,甚至会出现致命的并发症。本文介绍一例9cm的胃GIST腹腔破裂出血的患者,经急诊完全腹腔镜下楔形切除病灶,成功救治的过程.
病例报告:一位57岁的男性患者因腹痛急诊入院,既往无相关疾病和手术史。入院后检查,生命体征平稳,血红蛋白水平10.7 g/dl,白细胞计数为13000 0/mm;血小板计数为179 000 /mm3。腹部超声和CT均提示胃后壁有一10×10cm大小的肿块伴血肿。鉴于患者情况,给予腹腔镜手术。术中发现,腹腔1500ml积血,在胃后壁可见9×7cm大小的外生肿瘤,伴有破溃出血。用腔镜下切割闭合器楔形切除病灶,完成手术。术后回复顺利,术后一天进食,2天拔除腹腔引流管,3天出院。术后病理报告为胃GIST,给予甲磺酸伊马替尼治疗,随访5个月无复发。
结论:在适合的条件下,出现胃GIST破裂的患者可以急诊腹腔镜手术治疗。
【简评】
作者报道了采用完全腹腔镜下楔形切除胃GIST术成功急诊治疗一例胃GIST(9cm)破裂出血患者的临床过程,结果是满意的。该文作者认为治疗的亮点在于:1.胃GIST巨大(9cm)伴破裂出血;2.急诊完全腹腔镜下完成手术,术后恢复顺利。但对于我们国内腹腔镜外科医生来说,可能吸引力不大。因为类似病例甚至更复杂的病例国内早有报道。但我认为有以下几点还是值得注意:1.腹部肿瘤出血急诊手术前,最好能明确是肿瘤出血和大概的病变部位;2.腹腔镜技术在腹部外科急诊中是很重要的手段,有时可明确急诊病变情况;但急诊腹腔镜手术治疗要慎重,因为急诊手术应以简单有效为宜,腹腔镜是技术手段,不是目的,不能为腹腔镜而腹腔镜,尤其对于腹腔镜经验不足的医生。GIST治疗争取R0治疗,避免触摸肿瘤导致破溃和播散。3.随着腹腔镜技术和器械的不断发展,胃GIST的大小并不是腹腔镜手术的瓶颈,而需要综合评价肿瘤部位、生长方式、术者及团队对腹腔镜技术熟练程度及患者身体状况等情况来决定是否需要采用腹腔镜手术。因此我同意作者提出的“在适合的条件下,出现胃GIST破裂的患者可以急诊腹腔镜手术治疗”的观点。但对于此类患者的预后还有待于大样本的数据研究来证实。4.该例患者GIST已破裂出血,污染腹腔,但作者文章中未提及术中是如何隔离肿瘤,避免在分离和切除肿瘤时进一步扩大破口加重腹腔污染,难免让人心存疑惑。但术后快速康复确实令人印象深刻。总之,腹腔镜技术在胃肠道间质瘤治疗中的作用还有许多值得完善和总结的地方,希望国内同道能携手一起发出中国最强音!
专家点评:
中国人民解放军总医院
普通外科
吴欣教授
,




