
2022年3月23日,Pluvicto(lutetium Lu 177 vipivotide tetraxetan,177Lu-PSMA-617)获FDA批准,用于治疗前列腺特异性膜抗原(PSMA)阳性、既往接受过雄激素受体 (AR)抑制剂和紫杉烷类化疗的转移性去势抵抗性前列腺癌 (mCRPC)成人患者。
同天,Locametz (gallium Ga 68 gozetotide) 获FDA批准,一种用于 PSMA 阳性病灶正电子发射断层扫描 (PET) 的放射性诊断剂,以选择可使用Pluvicto治疗的转移性前列腺癌患者。Locametz 是首个获批用于选择放射性配体疗法的放射性诊断剂。
基于肿瘤PSMA 的表达情况,应选择使用 Locametz 或另一种获批的PSMA-11显像剂来选择既往经治mCRPC患者。
PSMA在超过80%的前列腺癌中高表达。177Lu-PSMA-617是一种靶向PSMA的放射性配体疗法。它由靶向化合物(配体)与治疗性放射性同位素组成,药物可与表达PSMA的前列腺癌细胞结合,随后放射性同位素的释放将会损害肿瘤细胞,破坏肿瘤细胞复制能力,并引发肿瘤细胞死亡。
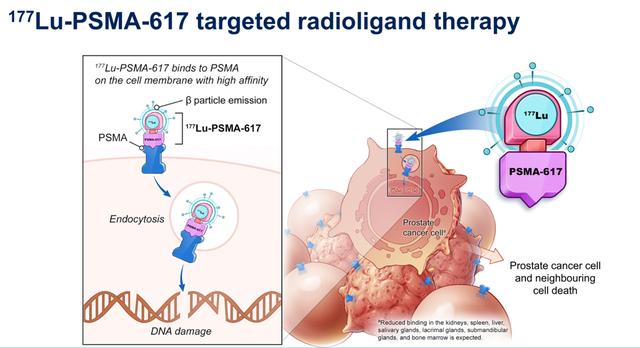
177Lu-PSMA-617靶向放射配体疗法机制模式图
此次获批是基于III期VISION研究结果。今年ASCO大会上,VISION研究以LBA摘要形式重磅公布研究结果。该研究首次证实靶向PSMA的放射性配体疗法(177Lu-PSMA-617)可显著改善mCRPC的生存,继Ra-223之后,为晚期前列腺癌增加了一种新型核素疗法。
VISION是一项国际性、开放标签、多中心的III 期临床研究,旨在评估177Lu-PSMA-617联合研究者选择的最佳标准治疗(SOC)(n=551)对比SOC (n=280)
用于PSMA 阳性mCRPC的疗效和安全性。
所有患者均接受了 GnRH 类似物治疗或既往进行了双侧睾丸切除术。入组患者至少接受过一种 AR 抑制剂,以及1种或 2中紫杉烷类化疗方案。患者每 6 周接受一次177Lu-PSMA-617治疗 SOC(7.4 GBq,200 mCi,至多 6剂量)或仅SOC。主要终点为影像学无进展生存期(rPFS)。
中位随访20.9个月时,与SOC组相比,177Lu-PSMA-617 SOC组的影像学进展或死亡风险降低60%,177Lu-PSMA-617 SOC组和SOC组的中位rPFS分别为8.7个月和3.4个月(HR=0.40,99.2%CI:0.29~0.57;P<0.001)。
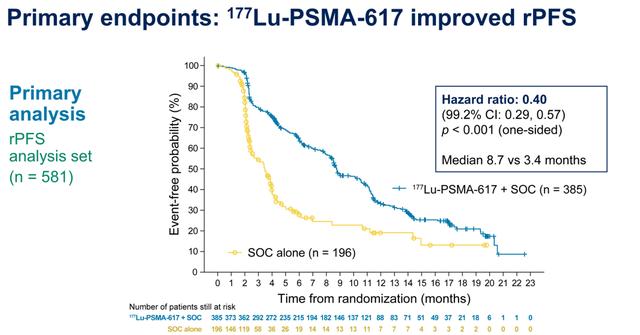
rPFS结果
两组的中位总生存期分别为15.3个月和11.3个月,死亡风险降低38%(HR=0.62,95%CI:0.52~0.74;P<0.001)。

OS结果
此外,ORR(29.8% vs 1.7%)、DCR(89.0% vs 66.7%)、至首次骨症状时间(11.5个月 vs 6.8个月)也均有改善。
试验组未发现不可预期不良事件及不可控不良事件。

安全性分析
VISION研究显示,177Lu-PSMA-617加入标准治疗可改善经治mCRPC患者PFS和OS,且耐受性良好。结果支持该联合方案可作为mCRPC患者新的治疗选择。
参考文献:
[1] https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pluvicto-metastatic-castration-resistant-prostate-cancer
[2] Phase 3 study of 177Lu-PSMA-617 in patients with metastatic castration resistant prostate cancer(VISION).LBA4.2021 ASCO.
审较:XY
排版:XY
执行:XY
,




