*仅供医学专业人士阅读参考
一文理清!
驱动突变阳性的NSCLC患者脑转移发生率更高,分子靶向药的快速发展为NSCLC脑转移患者提供了更多的治疗手段,在一定程度上提高了NSCLC脑转移患者的生存期及生活质量。本文总结近年来用于NSCLC脑转移的靶向药物颅内缓解的相关数据,以飨读者。
非小细胞肺癌领域中9大公认的驱动基因
针对亚洲人群的IPASS研究[1]拉开肺癌靶向治疗的序幕,也开启了表皮生长因子受体(EGFR)突变阳性非小细胞肺癌(NSCLC)酪氨酸激酶抑制剂TKI个体化治疗的新时代。随着基因检测技术的发展,越来越多的NSCLC被证实存在驱动基因突变,突变的基因驱使正常细胞变成癌细胞,使癌细胞能够长期存活、快速复制、扩散和进化。这些基因突变也因此被叫做驱动突变,也会被叫做“靶点”,有些分子靶向药物就是专门为它们设计。
图1列举了NSCLC的驱动基因突变类型以及发生频率[2]。目前NSCLC领域有9大公认的驱动基因,包括EGFR、KRAS、ALK、MET、ROS1、HER2、BRAF、RET和NTRK。在中国,驱动突变阳性的NSCLC患者较多。有研究[3]显示大约73.9%的中国NSCLC患者存在至少一个美国国家综合癌症网络(NCCN)指南推荐的治疗相关变异,其中EGFR基因组改变(包括突变和扩增)和ALK基因融合的比例分别为50.1%和7.8%,明显高于西方人群。
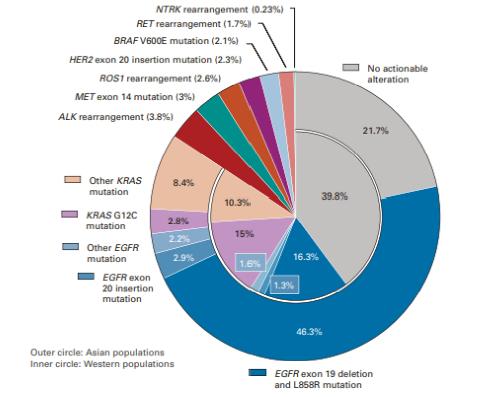
图1:肺腺癌中靶向驱动基因突变发生率
驱动突变阳性的NSCLC患者脑转移发生率更高
随着靶向治疗的不断探索及相关靶向药物的成功研发,将会有更多患者受益于靶向精准治疗。然而,一旦NSCLC患者出现了脑转移,预后仍然很差。约20%-40%的NSCLC患者会发生脑转移[4]。在EGFR、ALK、ROS1、BRAF和KRAS等致癌驱动突变的NSCLC患者中,脑转移的发生率更高,基线时为30%-40%[5],病程累积发生率高达60%-70%[6]。
表1:基线及累积脑转移发生率[6]

NSCLC脑转移的治疗包括局部(手术和放疗)和全身治疗(分子靶向药物、化疗和免疫治疗)。医生在临床决策时需要考虑诸多因素。开始治疗前根据是否有症状评估是否需要前期局部治疗,控制毒性风险以及颅外疾病的需求。同时也要评估患者能从全身治疗中有何获益,临床医生需要了解各种治疗方法的颅内和颅外缓解率、治疗反应的开始时间、免疫治疗后假性进展的发生风险,以及延迟放疗的毒性风险。治疗的最终目标是治疗转移病灶、改善患者症状和生活质量,最大程度地延长患者的生存时间。
靶向治疗延长脑转移患者生存期,提高生活质量
既往NSCLC脑转移的治疗手段多局限于放疗和化疗,根据特殊诊断评估预后分级系统(DS-GPA),只有评分3.5以上的患者获得1年以上的中位总生存期(OS)[7];一项对比前期放疗与延迟全脑放疗的Ⅲ期临床研究显示,二者疗效无差异且中位OS均低于半年[8]。
近年来分子靶向治疗的迅速发展为NSCLC脑转移患者提供了更多的治疗手段,在一定程度上提高了NSCLC脑转移患者的生存期及生活质量。
1. EGFR
FLAURA研究亚组分析结果显示,对于初治EGFR突变阳性伴脑转移患者,奥希替尼显著延长疾病进展时间到15.2个月,较一代EGFR-TKI降低53%颅内疾病进展风险[9]。
2. ALK
CROWN研究亚组分析显示,对于ALK阳性的NSCLC患者,洛拉替尼组颅内客观缓解率(ORR)高达83.3%,其中有72.2%基线伴有可测量脑转移病灶的患者使用洛拉替尼达到颅内完全缓解(CR),体现出洛拉替尼的惊人入脑能力[10]。
3. MET14号外显子跳跃突变
在中国获批的首个MET-TKI赛沃替尼的Ⅱ期研究事后分析显示,患者的颅内病灶均在赛沃替尼治疗后有所缩小或保持稳定,其中有3例达到部分缓解(PR),15例患者的颅外病灶ORR达到46.7%,脑转移患者的中位OS达到17.7个月,提示MET14号外显子跳跃突变的NSCLC脑转移患者从赛沃替尼治疗中可以得到显著的获益[11,12]。
此外,Capmatinib和Tepotinib的临床II期研究中,分别纳入了13例和15例基线存在脑转移灶且颅内疗效可评价的患者。Capmatinib使12例患者的颅内病灶得到控制,其中7例达到颅内缓解,包括4例完全缓解(CR)[13];Tepotinib治疗的15例患者中,则有13例颅内病灶得到控制,包括3例CR、9例PR和1例病情稳定(SD)[14]。上述数据提示,这两种MET-TKI用于颅内病灶也有一定的疗效。
4. KRAS G12C
靶向治疗大幅提高了患者的生存时间,且不良反应可控,新一代靶向药物在控制脑转移病灶方面取得了令人鼓舞的结果。2022年ASCO年会中发布了一项NSCLC脑转移靶向治疗的重磅研究结果。KRYSTAL-1研究首次发现adagrasib在活动性中枢神经系统(CNS)转移KRAS G12C突变NSCLC中显示出活性[15]。
在多队列I/II期KRYSTAL-1的Ⅰb期队列研究中,Adagrasib在携有KRAS G12C突变、未经治疗的活动性中枢神经系统转移的实体瘤患者中获得32%的ORR,及84%的疾病控制率。此外,通过腰椎穿刺评估时,Adagrasib表现出优异的 CNS 浓度,其在脑积液与血浆的平均浓度比(Kp,uu)为0.47,高于在其他已知有颅内活性药物中观察到的浓度比。众所周知,KRAS属于难治疗的靶点,未来希望有更多的研发数据突破预期。
NSCLC脑转移靶向治疗的局限性及未来前景
靶向药物的广泛使用一定程度上改变驱动突变基因阳性NSCLC脑转移的治疗策略,精准医学时代需基于多学科团队,根据患者的特定因素和肿瘤特异性变量(体能状态、预后、靶向性突变、脑转移是否有症状、颅外疾病状态,以及NSCLC分子基因组特征和PD-L1表达)决定治疗策略[16,17]。但其主要局限性之一是NSCLC和未治疗的脑转移患者通常被排除在评价全身治疗的随机临床研究之外。随着脑转移患者发生率的不断增加,以及纳入或专门针对脑转移患者的临床研究的出现,这一局面正在发生改变。
驱动突变基因阳性的NSCLC未来如何,Lizza Hendriks教授在2022 ASCO年会中提出观点如下:① 利用液体活检技术如脑脊液(CSF)追踪EGFR-TKI在CNS的耐药机制;② 关注正在进行的评估TKI剂量递增研究(NCT04739358);③ 奥希替尼单药的数据可能不太理想,化疗联合抗血管生成药物可能改善脑转移患者的临床结局(NCT02971501、NCT02521051);④ 共突变已被证明与较高的脑转移发生率相关,根据共突变调整全身治疗方案;⑤“全身进展时是否继续TKI治疗以控制CNS?CNS进展时能否在TKI治疗的同时进行放疗?”仍然是一个有争议的话题,需要进一步的工作来指导不同反应情况下的临床决策。
参考文献:
[1]Mok TS, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med. 2009 Sep 3;361(10):947-57.
[2]Tan AC, Tan DSW. Targeted Therapies for Lung Cancer Patients With Oncogenic Driver Molecular Alterations. J Clin Oncol. 2022 Feb 20;40(6):611-625.
[3]Wen S, et al. Genomic Signature of Driver Genes Identified by Target Next-Generation Sequencing in Chinese Non-Small Cell Lung Cancer. Oncologist. 2019 Nov;24(11):e1070-e1081.
[4]Villano JL, et al. Incidence of brain metastasis at initial presentation of lung cancer. Neuro Oncol. 2015 Jan;17(1):122-8.
[5]Patil T, et al. The incidence of brain metastases in stage IV ROS1-rearranged non-small cell lung cancer and rate of central nervous system progression on crizotinib. J Thorac Oncol. 2018;13:1717-1726.
[6]Schoenmaekers JJAO, et al. Central nervous system metastases and oligoprogression during treatment with tyrosine kinase inhibitors in oncogene-addicted non-small cell lung cancer: how to treat and when? Transl Lung Cancer Res. 2020 Dec;9(6):2599-2617.
[7]Sperduto PW, et al. Diagnosis-specific prognostic factors, indexes, and treatment outcomes for patients with newly diagnosed brain metastases: a multi-institutional analysis of 4,259 patients. Int J Radiat Oncol Biol Phys. 2010 Jul 1;77(3):655-61.
[8]8 Robinet G, et al. Results of a phase III study of early versus delayed whole brain radiotherapy with concurrent cisplatin and vinorelbine combination in inoperable brain metastasis of non-small-cell lung cancer: Groupe Français de Pneumo-Cancérologie (GFPC) Protocol 95-1. Ann Oncol. 2001 Jan;12(1):59-67.
[9]Ramalingam SS, et al; FLAURA Investigators. Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC. N Engl J Med. 2020 Jan 2;382(1):41-50.
[10]Benjamin J. Solomon, et al. Updated Efficacy and Safety From the Phase 3 CROWN Study of First-Line Lorlatinib vs Crizotinib in Advanced Anaplastic Lymphoma Kinase (ALK)–Positive Non-Small Cell Lung Cancer (NSCLC). AACR2022, Abstract #CT223.
[11]Lu S, et al. Once-daily savolitinib in Chinese patients with pulmonary sarcomatoid carcinomas and other non-small-cell lung cancers harbouring MET exon 14 skipping alterations:a multicentre, single-arm, open-label, phase 2 study[J].The Lancet Respiratory Medicine,2021,9(10):1154-1164.
[12]Lu S, et al.2MO Final OS results and subgroup analysis of savolitinib in patients with MET exon 14 skipping mutations(METex14 )NSCLC[J].Annals of Oncology, 2022, 33(S2): S27.
[13]Wolf J, Seto T, Han J Y, et al. Capmatinib in MET exon 14–mutated or MET-amplified non–small-cell lung cancer[J]. New England Journal of Medicine, 2020, 383(10): 944-957.
[14]Le X, Sakai H, Felip E, et al. Tepotinib Efficacy and Safety in Patients with MET Exon 14 Skipping NSCLC: Outcomes in Patient Subgroups from the VISION Study with Relevance for Clinical Practice[J]. Clinical Cancer Research, 2022, 28(6): 1117-1126.
[15]Ou SI, et al. First-in-Human Phase I/IB Dose-Finding Study of Adagrasib (MRTX849) in Patients With Advanced KRASG12C Solid Tumors (KRYSTAL-1). J Clin Oncol. 2022 Feb 15:JCO2102752.
[16]Vogelbaum MA, et al. Treatment for brain metastases: ASCO-SNO-ASTRO Guideline. J Clin Oncol. 2022;40:492-516.
[17]Le Rhun E, et al; EANO Executive Board and ESMO Guidelines Committee. EANO-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up of patients with brain metastasis from solid tumours. Ann Oncol. 2021;32:1332-1347.
*此文仅用于向医学人士提供科学信息,不代表本平台观点





