横纹肌肉瘤(rhabdomyosarcoma,RMS)是儿童期最常见的软组织肿瘤,占儿童肿瘤的 6.5%左右。其临床表现多样,异质性强,预后与肿瘤原发部位、大小、压迫及侵犯周围组织、器官程度以及病理类型有关。原发部位以头颈部及泌尿生殖系统最常见,其次为四肢、躯干等其余部位。RMS 对化疗、放疗敏感,但单一治疗效果差,需要肿瘤内、外科、放疗等多学科联合的综合治疗。儿童横纹肌肉瘤研究(美国)协作组(Intergroup RMS Study Group,IRSG)和儿童软组织肉瘤研究(欧洲)协作组(European Pediatric soft tissue sarcomas study group,EpSSG)等较大儿童肿瘤研究组经过 20 余年的临床研究,并根据病理亚型、术后病理分期和TNM 分期,将 RMS 分为低危、中危和高危 3 组,进行分层和综合治疗,不断优化治疗方案,进一步改善预后,使得 RMS疗效逐年提高。
二、适用范围病理诊断明确为 RMS,未经治疗的、<18 岁的所有患儿,无严重脏器功能不全,符合儿童肿瘤诊治的伦理要求并签署知情同意书。
三、诊断(一)临床表现
RMS 可发生于全身任何部位,临床表现取决于肿瘤的原发部位。RMS 最好发的部位为头颈部(占 40%),泌尿生殖道(占 25%),以及四肢(占 20%)。头颈部的 RMS 可分为三个区域,分别为脑膜旁,眼眶及非眼眶、非脑膜旁区域。 RMS诊断时约 25%发生远处转移,其中肺是最常见的转移部位,约占 40%~45%;其次是骨髓转移,约占 20%~30%,骨转移占 10%。
(注:脑膜旁区域是指原发部位在中耳-乳突、鼻腔、鼻窦、鼻咽、颞下窝、翼腭、咽旁区等区域,以及其他距离颅骨 1.5 厘米以内病灶。)
头颈部:脑膜旁区 RMS 占头颈部 RMS 的 50%,早期不易发现,而且很难完全切除。可表现为鼻腔或者外耳道出现脓血性分泌物,耳道或鼻腔阻塞,或者吞咽困难。症状可能会被误认为是上呼吸道慢性炎症。出现颅神经系统症状或其他神经系统症状,提示颅底或中枢神经系统侵犯,需要立即行影像学检查。脑脊液中肿瘤细胞阳性可能早于影像学发现肿瘤侵犯。眼眶 RMS 占头颈部 RMS 的 25%,预后相对良好,此部位的肿瘤早期容易出现症状,如眼球突出、伴眼球固定、一侧眼睑增厚、眶周出血或斜视等。其他的头颈部 RMS 可位于颈部软组织、颅顶腱膜、口腔、唾液腺、喉、咽部、腮腺及面颊等部位。
泌尿生殖道:最常见于膀胱和前列腺,约占 30P%。膀胱肿瘤倾向于向腔内生长,多在膀胱三角区内或附近,偏向于局限,以血尿、尿路梗阻并尿中偶有黏液血性成分为主要表现。前列腺肿瘤常出现巨大骨盆内肿物,常早期转移至肺部。肿瘤也可发生于睾丸旁或女性生殖道。
四肢和躯干:肢体局部肿胀是肉瘤的特征,可也出现红肿及触痛表现。肿瘤相对较大,根据相应的原发部位,也可累及临近胸腰段脊柱,但局部淋巴结蔓延少见。
胸腔内和腹膜后骨盆区域:胸腔内和腹膜后骨盆区域位置深,诊断前可能肿瘤已经很大,常包绕大血管,不能完全切除。
其他部位:会阴-肛周区域,可类似脓肿或息肉;胆道肿瘤少见,可有梗阻性黄疸表现,常有肝内转移、腹膜后转移及肺转移。
(二)病理分型
横纹肌肉瘤是由不同分化阶段的横纹肌母细胞组成的恶性肿瘤,属于小圆蓝细胞肿瘤,肿瘤由小细胞组成,有大的、圆的深染的细胞核,镜下可见骨骼肌排列。免疫组化显示存在 desmin、myogenin、myoglobin、actin、vimentin等骨骼肌标记。
WHO 将 RMS 分为以下三种基本病理类型。
1. 胚胎型(ERMS):包括葡萄状 (botryoid cell )和梭形细胞型(spindle cell)。细胞遗传学及分子生物学研究提示,部分胚胎型存在 11 号染色体杂合缺失。
2. 腺泡型(ARMS):部分 ARMS 中存在染色体易位 t(2;13)(q35;q14)或 t(1;13)(q36;q14)。这两种易位分别形成了相应的融合基因 PAX3-FKHR 和 PAX7-FKHR。其中,PAX3-FKHR 融合蛋白与预后不良相关。
3. 多形型或间变型(pleomorphic or anaplastic RMS):儿童罕见,病理亚型为间变者预后不佳。
(三)辅助检查
1.血常规、尿常规、血生化、凝血检查
(1)血常规检查:患儿可表现为贫血;有骨髓浸润者可出现全血细胞减少。
(2)尿常规检查:泌尿生殖道肿瘤可有血尿表现。
(3)血生化检查:肝肾功能、LDH、电解质是必查项目。肿瘤负荷大的患者可出现血尿酸及乳酸脱氢酶增高。
(4)凝血功能:包括 PT、APTT、TT、FIB、D-二聚体、FDP。有骨髓浸润、高肿瘤负荷、巨大瘤灶合并肿瘤破裂出血者可出现 FIB 下降,D-二聚体升高等。
2.影像学检查
(1)X 线平片检查:原发部位的 X 线检查可以发现肿瘤钙化、骨侵犯等。可以辅助诊断肿瘤肺部转移。
(2)CT 扫描:肿瘤原发部位通常行增强 CT 扫描来辅助诊断瘤灶大小及局部软组织、骨骼侵犯情况,以及用来评估治疗反应。胸部 CT 及腹部 CT 平扫可用来判定有无肺部及肝脏的转移。
(3)磁共振扫描:可确定原发瘤灶以及对周围邻近组织器官的侵犯情况,尤其适用于眶周、脑膜旁及脊柱旁区域的肿瘤。
(4)骨扫描:用于评估骨骼转移的情况。
(5)PET/CT 检查:有条件的单位可考虑行全身正电子发射计算机断层显像,有助于全面评估瘤灶及转移部位。
(6)B 超检查:可用于原发瘤灶及转移瘤灶的评估及治疗反应的监测。
(7)心脏彩色超声:用于化疗前心脏功能的评估。
3.有创操作检查
(1)活检:通常手术活检可获取足够的标本用于组织病理及分子生物学检查。若初诊时不能行根治性手术切除,可先予辅助化疗,待肿瘤缩小后择期手术治疗。条件允许的情况下可行穿刺活检。
(2)骨髓穿刺或活检:用于评估有无骨髓浸润。
(3)脑脊液检查:病变位于脑膜旁区者,建议行脑脊液检查,包括镜下找瘤细胞,有条件的单位可行流式细胞术检查。
4.其他检查
(1)听力检查:用于治疗前听力的评估,以及铂类药物听力毒性的监测。
(2)UGTIAI 基因多态性的检测:UGTIAI 是伊立替康的主要代谢酶,有条件的单位应行 UGTIAI 基因多态性检测。UGTIAI*6 基因的突变型可降低 UGTIAI 活性,增加肠道黏膜损伤,出现腹泻风险;UGTIAI*28 基因多态性是预测化疗后发生严重粒细胞减少和腹泻风险的分子标记。
(3)荧光原位杂交检查(FISH):对于腺泡型 RMS,这项检查用来检测是否有 t(1:13)或 t(2:13)易位,即是否存在 PAX7-FKHR 和 PAX3-FKHR 融合基因。
(四)鉴别诊断
1. 尤文肉瘤:通常表现为软组织包块,特别是发生于头颈部、四肢的 RMS 需注意与尤文肉瘤鉴别,组织病理检查及 FISH 检查有助于鉴别诊断。
2. 神经母细胞瘤:发生于腹盆腔、颈部的 RMS 需注意与神经母细胞瘤鉴别,可结合肿瘤标记物神经元特异性烯醇化酶(NSE)、尿 3-甲氧基 4-羟基苦杏仁酸/香草扁桃酸(HVA/VMA)辅助诊断。
3. 白血病:有骨髓侵犯的 RMS 需注意与白血病相鉴别,骨髓肿瘤细胞免疫分型、骨髓活检病理检查有助于诊断。
4. 淋巴瘤:特别是腺泡型横纹肌肉瘤有时可误诊为淋巴瘤,需要病理会诊明确诊断。
5. 其他软组织肉瘤:如纤维肉瘤、平滑肌肉瘤、恶性外周神经鞘瘤、骨肉瘤、滑膜肉瘤等,需要通过病理诊断鉴别。
四、临床分期及危险度分组(一)临床分期
儿科肿瘤研究国际协会,根据治疗前基于影像学制定的临床分期系统(TNM-UICC,表 1),以及横纹肌肉瘤研究美国协作组(IRS)的术后-病理临床分组系统(表 2),两种分期方法相结合。
(二)危险度分组
依据病理亚型、术后病理分期和 TNM 分期,将危险度分为低危组、中危组、高危组(表 3),以便分层治疗。
五、疗效评估(一)瘤灶评估标准
1.完全缓解(CR):所有病灶完全消失大于 4 周,骨髓转移者细胞涂片检查阴性。
2.部分缓解(PR):原发肿瘤缩小≥64% ,转移瘤灶缩小≥30%,没有新的病灶。
3.疾病进展(PD):原发肿瘤较初诊时增大≥40%,转移瘤灶≥20%,或出现新病灶。
4.疾病稳定(SD):肿瘤体积介于 PD 和 PR 之间。
(二)总体疗效评价标准
1.CR:原发瘤灶和转移瘤灶均 CR,无新发病灶。
2.PR:原发瘤灶 CR,转移瘤灶 PR /SD,无新发病灶;或原发瘤灶 PR,转移瘤 CR/PR /SD,无新发病灶。
3.SD:原发瘤灶 SD,转移瘤 CR/PR /SD,无新发病灶。
4.PD:原发瘤灶、转移瘤灶任何处进展 PD。颅骨 1.5 厘米以内病灶。
(三)治疗中评估
1.手术前检查。全身检查,包括肺 CT、头颅 MRI、原发瘤灶 B 超和局部增强 CT 或 MRI。
2.化疗每间隔 2 疗程。评估原发瘤灶及转移瘤灶大小,即复查局部 B 超,选择性增强 MRI。
3.复发评估。复发是指肿瘤完全消失 1 个月后,再次出现局部或转移性肿瘤病灶。此肿瘤易原位复发,如果复查中发现原位或病初转移灶复发,或者出现相应的症状、体征,则需进一步再考虑肺 CT、头颅 MRI 等容易转移部位的检查。
4.治疗中首次评价为 CR、PR 和 PD 的患儿,间隔 6~8周再评价以确认。
5.治疗结束前评估。原发瘤灶 B 超、增强磁共振或 CT、胸部 CT、头颅 MRI,必要时行骨扫描。治疗中首次评价为 CR、PR 和 PD 的患儿,间隔 6~8 周再评价以确认。治疗结束后针对总体的治疗效果再次评价和确认。
六、治疗RMS 治疗原则和细则重点参照《美国儿童横纹肌肉瘤研究协作组(IRSG)治疗方案》和《中国儿童及青少年横纹肌肉瘤诊疗建议 CCCG-RMS-2016 和解读》【中华儿科杂志 2017第 55 卷第 10 期】。提供的以下治疗方案各医院根据各自情况选择应用,部分病人可结合所在医院实际情况适当改良。
(一)手术
最好能做完整的肿瘤切除或仅有镜下残留。如果不能完全切除或者病变累及眼眶、阴道、膀胱或胆道,为了保存器官及其功能,可先用化疗或加放疗,使肿瘤缩小,再进行手术。如第一次手术仅做肿瘤部分切除,可经化疗和(或)放疗 3~6 个月(4~8 个疗程)后再手术。为了达到完整切除肿瘤的原发病灶,可以进行二次手术,切除原遗留下的阳性边缘或原仅做活检部位。
(二)放疗
1.放疗指征:RMS 胚胎型 IRS-Ⅰ期不做放疗,Ⅱ~Ⅳ期则须放疗。腺泡型易有局部复发,故Ⅰ期也做放疗。
2.放疗剂量:常规分割放疗与超分割放疗无区别。为减少晚期损伤,放疗需采用多分次照射,单次剂量不超过。建议采用三维适形或调强放疗技术。RMS 原发和转瘤灶的推荐放疗剂量(表 4)。
3.放疗时机:手术已经完全切除瘤灶者,可于术后 1 周疗;伴颅底侵犯的患儿,有明显压迫症状,需要紧急放者,可于化疗前先放疗。肿瘤较大无法手术者,建议放疗在原发瘤灶化疗第 13 周,转移瘤灶可延迟到化疗第 25。在有条件的情况下,可以考虑采用质子放疗,能更高的靶区周围的正常组织和器官。
(三)化疗
1.总细则
(1)根据影像学及其他检查,估计肿瘤能基本完全切除者先手术;完全切除困难者仅活检,明确诊断后先化疗再手术。如选择手术,则化疗在术后 7 d 内开始。第 1 次化疗时注意病理会诊结果,如果为腺泡型建议做融合基因 PAX3-FKHR 和 PAX7-FKHR,需修正危险度分组。
(2)放疗期间避免应用放线菌素 D(ACTD)和阿霉素(ADR),化疗剂量减为半量。
(3)各期均有必要化疗。根据危险度分组,采用不同强度的化疗。
(4)剂量及化疗前要求:长春新碱最大量 2.0 mg,放线菌素 D 最大量 2.5 mg。在完全缓解后 4~6 个疗程可考虑停药,总疗程数>12 个时考虑个体化调整方案。化疗 12 周瘤灶评估处于 PD(肿瘤增大或出现新病灶)则出组。年龄<12个月化疗剂量减半或体重≤12 kg 按体重计算,剂量=体表面积剂量/30×体重(kg)。每疗程间隔 21 d。每疗程化疗前中性粒细胞(ANC)>0.75×109/L,血小板(PLT)> 100×109/L。化疗结束 24~48h,开始注射粒细胞刺激因子(G-CSF)或粒-巨噬细胞刺激因子(GM-CSF)。骨髓抑制期>28 天者下一疗程减量 25%。
(5)化疗药物毒副反应的判定标准:以 NCI 不良反应的分级标准(CTCAE version 5.0,表 5) 为依据。化疗前后均须注意检测心、肝、肾功能和听力。丙氨酸转氨酶(ALT)需小于正常值 2 倍,总胆红素小于正常值 1.5 倍。肾功能不全时按肌酐清除率(Ccr)降低比例相应减量。
(6)常规口服复方新诺明 25 mg/(kg·d), 2 次/d,最大量 0.48g/次,2 次/天,服 3 d/周,化疗开始直到化疗结束后 3 个月。
2.各危险度分组方案
(1)低危组方案:
VAC 方案(V:长春新碱 A:放线菌素 D C:环磷酰胺);VA 方案(V:长春新碱 A:放线菌素 D);长春新碱:1.5 mg/m2, 静脉滴注,d1,d8,d15;放线菌素D:0.045mg/(kg·次) 生理盐水 5min,d1;环磷酰胺:1.2 g/m2,1h,静脉滴注,d1。 2-巯基乙基磺酸钠(Mesna)360mg/(m2·次) 生理盐水 20~30min,于环磷酰胺 0、3、6、9h,静脉推注,d1。
注:年龄小于 12 个月,放线菌素 D 剂量减半或≤12kg按体重计算,剂量=体表面积剂量/30×体重(kg)。化疗 4疗程后全面评估,如果完全缓解,4 疗程后可考虑停药,总疗程不超过 10 次。
(2)中危组方案:
VAC 方案:同低危组,≤12kg 按体重计算,剂量=体表面积剂量/30×体重(kg)。
VI 方案(V:长春新碱 I:伊立替康)长春新碱同低危组,伊立替康:50mg/m²,d1~d5,VCR后静脉滴注 90min;单次最大量≤100 mg/d,伊立替康有严重粒细胞减少和腹泻等不良反应,有条件者在化疗前条件者可做 UGT1A1 基因检测。
注:VAC 和 VI 方案可交替进行。全部化疗在完全缓解后4~6 个疗程可考虑停药,总疗程数最多为 13个疗程(42 周),超过 12 个疗程时考虑个体化调整方案。化疗 12 周瘤灶评估处于 PD(肿瘤增大或出现新病灶)则出组,可考虑造血干细胞移植。
(3)高危组方案:
VAC、VI 方案:同中危组,≤12kg 按体重计算,剂量=体表面积剂量/30×体重(kg)。
VDC(V:长春新碱 D:阿霉素 C:环磷酰胺)/IE(I:异环磷酰胺 E:依托泊苷)方案。
长春新碱:同低危组;阿霉素:30 mg/m²,d1~d2;环磷酰胺:1.2 g/ ㎡,1h,d1;异环磷酰胺:1.8 g/m2,d1~d5;依托泊苷:100mg/m2,d1~d5;2-巯基乙基磺酸钠(Mesna)360mg/( ㎡·次) 生理盐水 20~30min,环磷酰胺/异环磷酰胺 0、3、6、9h,d1。
注:以上化疗方案建议术前以 VAC 和 VI 交替为主。术后以 VDC 和 IE 交替为主。放疗期间建议应用 VI 方案。全部化疗在 54 周完成,总疗程数超过 12 个疗程时可考虑个体化调整方案。化疗 12 周后评估处于 PD(肿瘤增大或出现新病灶)则出组,可考虑干细胞移植。
七、治疗相关毒副反应监测及辅助治疗(一)药物近期毒性监测及辅助治疗
化疗药物近期毒性主要表现在血液、心、肺、肝、肾和脑等,联合用药时,应注意加强对肿瘤细胞的杀伤力而不增加药物的毒性作用。在用药过程中,除注意增强营养,补充维生素,防治水和电解质紊乱,矫正贫血,控制和避免交叉感染外,并根据化疗药物急性及亚急性毒性反应,如骨髓抑制及胃肠道反应等,加强支持和对症治疗。有的药物还有特异性副作用,如长春新碱可引起肠麻痹和便秘,阿霉素可引起心脏损害,均须注意检测和预防。
1.心脏毒性:主要指蒽环类药物的心脏毒性,包括急性心肌损伤和慢性心功能损害。前者为短暂而可逆的心肌局部缺血,可表现为心慌、气短、胸闷、心前区不适等;后者为不可逆的充血性心力衰竭,与药物累积剂量相关。一旦心功能检测提示心脏射血分数< 55%或轴缩短分数< 28%,若能证明左心功能异常和细菌感染有关,可以继续使用蒽环类抗生素,否则应该暂停,直到射血分数≥55%或轴缩短分数≥28%。根据蒽环类药物使用剂量或心肌损伤程度选择右丙亚胺(Zinecard)、左旋肉碱、能量合剂等药物。
2.转氨酶升高:ALT/AST 达正常高限 10 倍或以上时可延缓化疗,1 周后仍有异常者可以在严密观察下化疗。长春新碱:长春新碱剂量不得超过 2mg。常见的轻度毒性有下颌疼痛、便秘、深反射减弱。有时可以有发声障碍。出现盲肠炎者应停药。鉴于目前无长春地辛与长春新碱在治疗疗效的随机对照报告,除以上情况外建议首选国际公认药物长春新碱。
3.预防卡氏肺囊虫感染。建议长期服用复方磺胺甲噁唑片(SMZco)预防卡氏肺囊虫感染,25mg/(kg·d),分两次,最大剂量每次 0.5,Bid,每周 3 天。直化疗结束后 2~3 个月。
4.血制品输注。贫血:一般可以通过输注红细胞缓解贫血,血红蛋白<60g/L 必须输注;血小板减少:血小板计数<20×109/L 时应输注血小板,伴有明显出血症状或感染表现时输注指征可适当放宽。
5.粒细胞刺激因子:对预期会出现较长时间粒细胞缺乏者可以使用粒细胞集落刺激因子。以上化疗药物毒性分级标准详见附表 5。
(二)化疗和放疗的远期毒副反应及随访
大剂量化疗药物的应用和放疗是造成远期毒副反应发生的主要原因,例如颅脑放疗、全身放疗,治疗年龄<3 岁,幕上肿瘤放射剂量>24Gy 等,这些均是感知神经障碍的功能缺陷的高危因素,表现在执行功能,持续注意力,记忆力,处理速率,视觉运动整合,学习障碍,智商降低,行为改变等。全身放疗影响到眼睛,颈部,眼眶,可造成视力障碍,白内障,泪管萎缩,干眼症,视网膜病变和青光眼。放疗、化疗可造成肺纤维化,间质型肺炎等慢性严重性肺病变等。因此,儿童处于生长发育期,可能出现化疗药物及放疗对机体器官的损伤,造成生长发育障碍及远期的脏器功能不良,因此,治疗肿瘤的同时,需关注儿童肿瘤的生存质量。肿瘤患者治疗结束,仍需长期随访。
八、治疗结束后随访时间点(一)第 1 年,间隔 3 个月体格检查、血常规、血生化、胸 X 线片或胸部 CT 以及原发瘤灶的影像学检查。
(二)第 2~3 年间隔 4 个月体格检查、血常规、血生化、胸 X 线片以及原发瘤灶的影像学检查。
(三)第 4 年间隔 6 个月体格检查、血常规、血生化、胸 X 线片以及原发瘤灶的影像学检查。
(四)第 5~10 年每年进行体格检查、血常规、生化和检查。
(五)10 年后尽可能每年复诊或电话随访患儿结婚生育、第二肿瘤状况等。
九、转诊标准(一)适用对象
1.存在以下可疑横纹肌肉瘤的初诊患儿:头颈、四肢、臀部、躯干等部位发现软组织包块,伴或不伴疼痛及压迫症状;
2.病理确诊的横纹肌肉瘤。
(二)转诊标准
1、Ⅰ级转诊:症状及影像学怀疑横纹肌肉瘤,如具有以下条件之一,则建议由县级医院转至上级医院。
(1)医院不具备进行 B 超、MRI、CT 等影像检查条件者;
(2)初步检查高度怀疑此类诊断,但医院不具备进行肿物穿刺、手术活检条件者;
(3)医院不具备病理诊断条件者;
(4)医院无儿童肿瘤治疗经验者。
2、Ⅱ级转诊:符合以下条件之一者建议转诊至具有儿童肿瘤专科的省或有条件的地市级医院。
(1)经就诊医院完成影像检查、活检等进一步检查仍无法明确诊断者(如当地多家医院病理会诊不一致或当地病理科无法确定诊断);
(2)当地医院无法完成肿瘤切除复杂手术者;
(3)出现肿瘤或治疗相关严重并发症,而当地医院无相关治疗经验者;
3、如具有以下条件之一,则建议由省、市级医院转诊至具有儿童肿瘤诊疗条件的当地医院。
(1)已在省市级医院明确诊断、分期、分组,及制定出治疗方案患者,但是,因无儿童患者化疗或手术或放疗条件,不能实施后续治疗,可转诊至具有儿童肿瘤诊疗条件的当地医院继续完成后续治疗、评估、随访。
(2)已在省市级医院完成复杂肿瘤切除手术、放疗、严重并发症得到控制,可转诊至具有儿童肿瘤诊疗条件的当地医院继续完成后续治疗、评估、随访。
(三)不纳入转诊标准
1.已明确诊断,且符合转诊标准,但已参加横纹肌肉瘤相关临床研究者;
2.患儿符合转诊标准,但已因肿瘤进展、复发、肿瘤和/或治疗相关并发症等原因出现生命体征不稳定,长途转运存在生命危险者;
3.就诊的医院不具备影像检查、病理诊断、手术、化疗或放疗等技术条件,但同级其它医院可进行者。
4.经转诊双方医院评估,无法接受转诊患儿进一步诊疗者。
附:
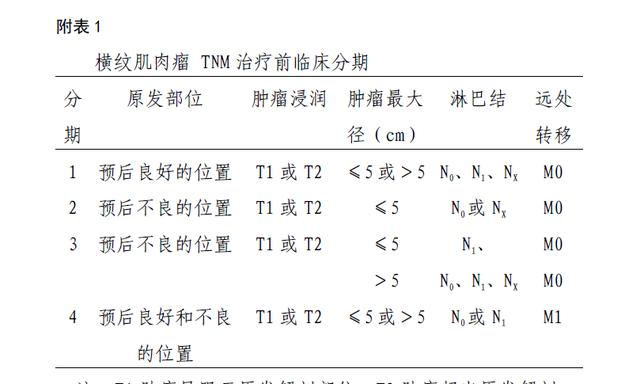
注:T1 肿瘤局限于原发解剖部位;T2 肿瘤超出原发解剖部位,侵犯邻近器官或组织; N0 无区域淋巴结转移;N1 有区域淋巴结转移;Nx 区域淋巴结转移不详; M0 无远处转移;M1 有远处转移;
注:预后良好的位置是指眼眶、头颈(除外脑膜旁区域)、胆道、非肾脏、膀胱和前列腺区泌尿生殖道;预后不良的位置是指膀胱和前列腺,肢体,脑膜,其他部位包括背部、腹膜后、盆腔、会阴部/肛周、胃肠道和肝脏。









(按姓氏笔画排序)
组长:倪鑫
成员:马晓莉、王焕民、王珊、孙晓非、吴晔明、张福泉、何乐健、汤静燕、赵强、倪鑫、翟晓文
,