选四第一章第二节知识点总结
一、热化学方程式
1.概念:能表示参加反应物质的量和反应热的关系的化学方程式

说明:
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。普通化学方程式只包含物质变化一个部分。
2.书写原则(与化学方程式的比较)
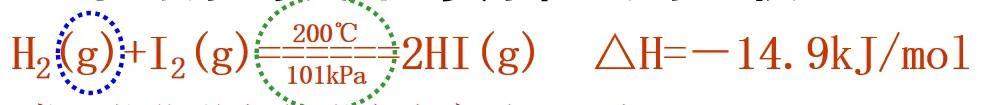
(1)应注明反应物和生成物的聚集状态(s、l、g 、aq)
由于已经注明物质的聚集状态,所以热化学方程式中不用↓和↑。不需要注明的条件是“点燃”“加热”等。
2H2(g) O2(g)==2H2O(g) △H=-483.6kJ/mol
2H2(g) O2(g)==2H2O(l) △H=-571.6kJ/mol
(2)需注明反应的温度和压强;如在25℃ 101kPa下进行的反应,可不注明。
(3)热化学方程式右端标热量数值和符号,△H:吸热用“ ”(不能省略),放热用:“-”。△H的单位为kJ/mol。
(4)系数单位是“摩”,而不是“个”,所以系数可以是分数。
(5)△H单位中的每mol是与整个反应对应的,即反应热表示每mol反应放出或吸收的热。所以对于相同的反应,当化学计量数不同时,其△H不同。
2H2(g) O2(g)==2H2O(l) △H=-571.6kJ/mol
4H2(g) 2O2(g)==4H2O(l) H=-571.6kJ/mol×2
(6)反应逆向进行,其反应热的数值与正反应相等、符号相反.
2H2(g) O2(g)==2H2O(l) △H=-571.6kJ/mol
2H2O(l) == 2H2(g) O2(g) △H= 571.6kJ/mol
【特别提醒】
注意反应物和产物的聚集状态不同,反应热数值不同。物质的气、液、固三态的变化与反应热的关系如下图

二、中和热及其测定
1.中和热
在稀溶液中,酸跟碱发生中和反应生成1 mol H2O,这时的反应热叫做中和热。(中和热的测量中碱稍过量保证酸能完全反应)
注意:
① 条件一-----稀溶液 :若是浓溶液,则在中和时还要考虑溶液的稀释,稀释过程也要放出热量,影响中和热的数值。
② 条件二-----酸碱中和:强酸与强碱的稀溶液
③ 条件三-----生成1mol水
,




