磷存在形式主要有:白磷、红磷、黑磷三种,他们都是有磷元素(磷元素符号:P)构成,但磷元素在白磷、红磷和黑磷中排列方式不同,导致他们有不同的性质。
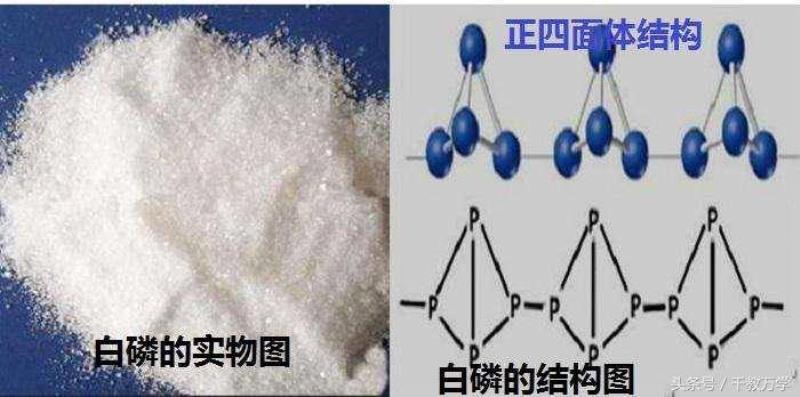

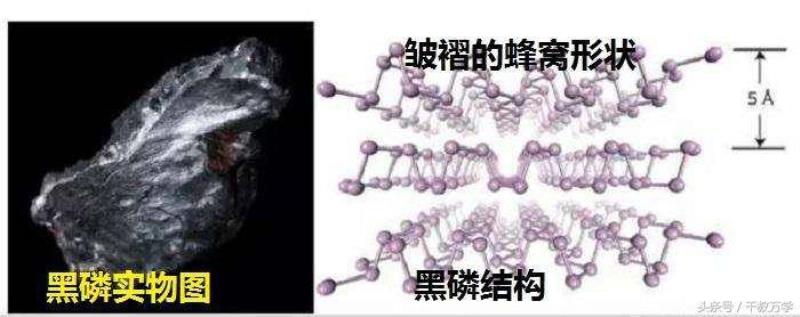
如白磷、红磷和黑磷他们构成的元素相同,但元素排列方式不同,性质不同的单质称为同素异性体。
说明:单质指由一种元素组成的物质:如1、碳(化学式:C)由碳元一种元素组成,属于单质;
2、一氧化碳(化学式:CO)由碳和氧两种元素组成,不是单质。
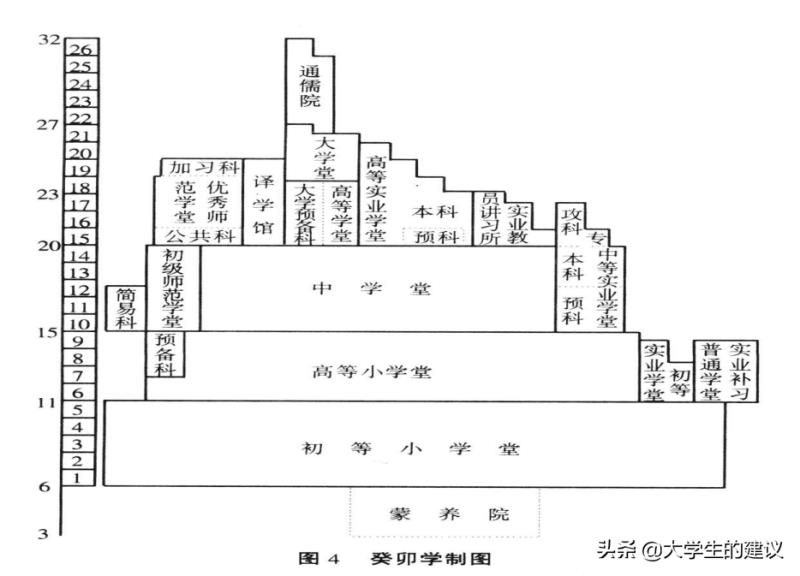
一、同素异形体的定义:指由同一种元素(整个物体只有一种元素组成)组成,元素排列方式不同,具有不同性质的单质。
1.1、判断同素异形体的条件:
所有的物质只能由一种元素组成;元素在不同种物质的排列方式不同。1.2、同素异形体举例:
红磷、白磷和黑磷为同素异形体:他们都是由磷元素(磷元素符号:P)组成,磷元素的排列方式不同,导致他们性质不同。白磷有毒,容易燃烧,红磷无毒,不易燃烧。氧气(化学式:O2)与臭氧(化学式:O3)为同素异形体:他们都是由氧元素(氧元素符号:O)组成,但氧元素的排列方式不同,导致他们性质不同。氧气可以供给人呼吸,臭氧不能供人呼吸,但可以吸收紫外线。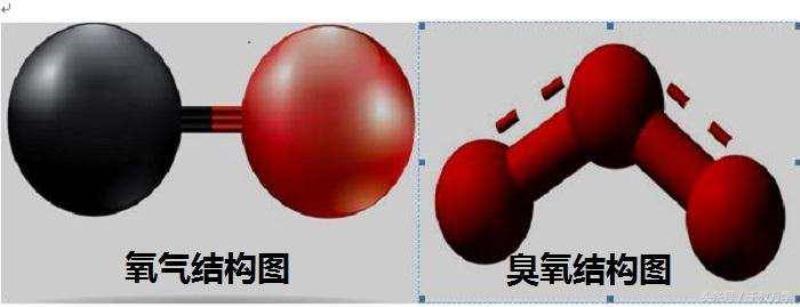

臭氧层
石墨、金刚石和C60为同素异形体:他们都是由碳元素(碳元素符号:C)组成,碳元素的排列方式不同,导致他们性质不同。石墨具有导电性,金刚石较硬,不具有导电性。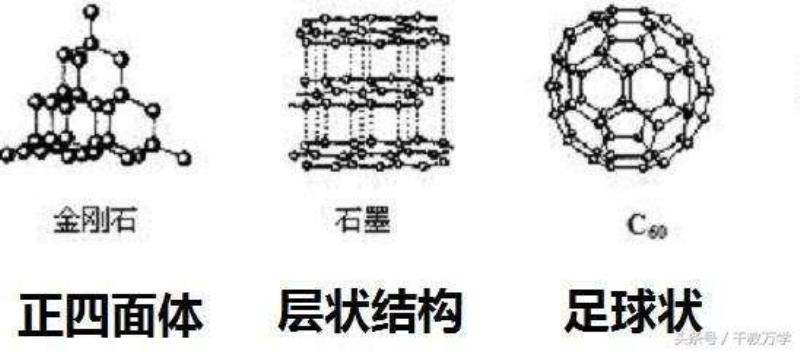
1.3、不是同素异形体举例:
一氧化碳(化学式:CO)与二氧化碳 (化学式:CO2),他们都是有碳元素和氧元素组成,性质也不同,但他们不是同素异形体,因为他们由两种元素组成,同素异形体的物质只能由一种元素组成。二、白磷的性质
白磷是白色蜡状固体,遇光会逐渐变为黄色晶体(白磷也称黄磷),有蒜臭味。
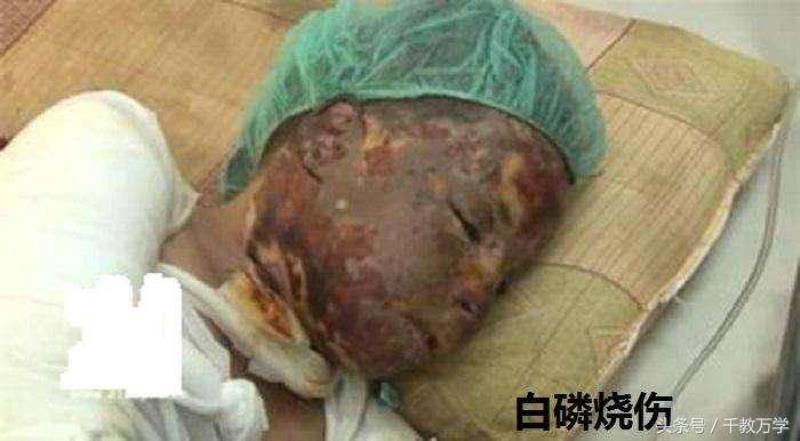
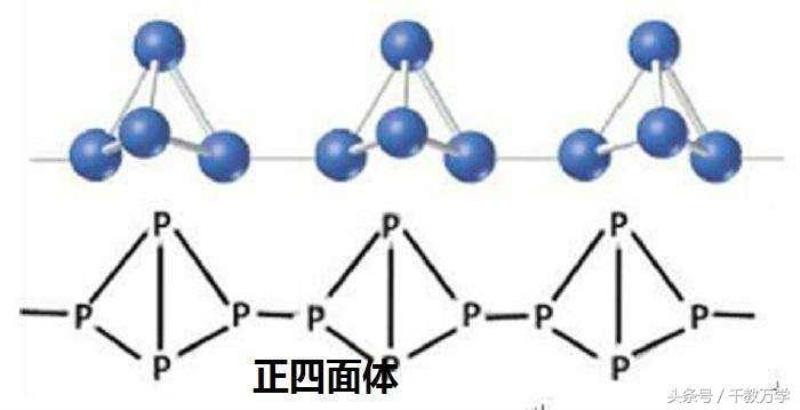
2.1、白磷燃烧:白磷在充足的氧气中燃烧生成白色固体五氧化二磷(化学式:P2O5),同时会产生大量的白烟(白烟为五氧化二磷固体小颗粒),烟有毒。

2.2、储存方法:因白磷化学性质活泼,暴露于空气中很容易与氧气反应发生自燃,挥发出的白磷蒸气,被人吸入会引起中毒,根据白磷不溶于水,密度比水小的性质,所以白磷保存在水中。

2.3、白磷的应用:可用制作烟幕弹、燃烧弹。



三、红磷的性质
红磷(也称赤磷)是紫红色略带棕色的粉末状固体,无气味,无毒,在暗处不发磷光。
3.1、红磷燃烧:红磷在氧气中燃烧生成白色固体五氧化二磷(化学式:P2O5),同时会产生大量的白烟(白烟为五氧化二磷固体小颗粒)。
红磷在氧气中燃烧的文字表达式与化学方程式
3.2、储存方法:密封储存在阴凉通风处。

3.3、红磷的应用:火柴盒上的涂层(主要是红磷与玻璃粉),制造农药。