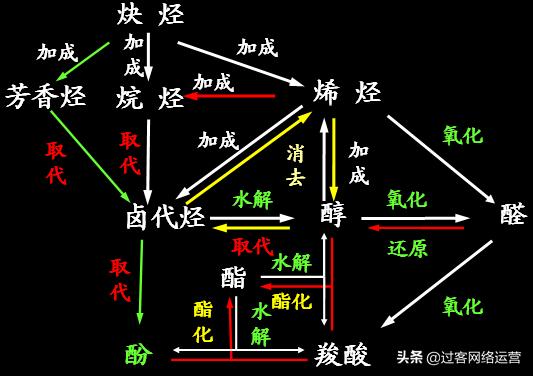
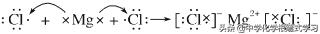考点一 原子的组成和结构及核外电子排布
【考情分析】
|
考查 特点 |
①原子、离子结构示意图及电子式的书写 ②原子核外电子排布规律及与元素性质的关系 |
|
应考 策略 |
①明确原子结构示意图各部分的意义,通过练习熟练运用两个关系式处理原子组成微粒间的关系; ②深刻理解、决定元素性质的是原子的最外层电子 |
【战场演练】
1.下列有关化学用语表示正确的是( )
A.乙酸的结构简式:C2H4O2
B.F-的结构示意图:

C.中子数为20的氯原子:
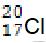
D.NH3的电子式:

解析:乙酸的结构简式为CH3COOH,C2H4O2是乙酸的化学式,A错误;F-有9个质子,10个电子,结构示意图为

,B正确;中子数为20的氯原子,其质量数为37,原子符号为

,C错误;NH3的电子式为

,N原子还有一对孤电子对,D错误。
答案:B
2.元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
解析:对于F来说它没有正价,A错;多电子原子中,能量低的电子在离核较近的区域内运动,B错;P、S、Cl的非金属性依次增强,得电子能力与最高价含氧酸(H3PO4、H2SO4、HClO4)的酸性均依次增强,C正确;过渡元素是第三纵列到第十二纵列的元素,包括了七个副族与第Ⅷ族,D错误。
答案:C
3.下列各项表达中正确的是( )
A.Na2O2的电子式为

B.106 g的乙醇和丙醇混合液完全燃烧生成的CO2为112 L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为

解析:A错,Na2O2为离子晶体,电子式应为

;B中乙醇和丙醇的比例关系未知,故无法计算;由于大多数元素存在同位素现象,故C正确;D错,Cl-的结构示意图应为

。
答案:C

考点二 元素、核素、同位素
【考情分析】
|
考查 特点 |
①核素符号
中各部分的意义及其关系, ②同位素、核素、同素异形体、同分异构体概念辨析, |
|
应考 策略 |
①理解元素、核素、同位素所表达的意义; ②分清同位素、同素异形体、同分异构体的应用范围 |
【战场演练】
1.下列叙述正确的是( )
A.乙酸与丙二酸互为同系物
B.不同元素的原子构成的分子只含极性共价键
C.

和

是中子数不同质子数相同的同种核素。
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
解析:A.乙酸分子式为C2H4O2,丙二酸的分子式为C3H4O4两者的结构不同,在分子组成上也不相差CH2原子团,所以两者不互为同系物。B.H、O两种元素可以形成H2O和H2O2两种分子,在H2O2中存在极性共价键,也存在非极性共价键。C.

和

中子数不同,是两种不同的核素。D.第ⅣA与ⅦA形成的均为AB4型共价化合物,如SiF4、CCl4、SiCl4等,均满足最外层8电子结构。
答案:D
2.16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A.16O2与18O2互为同分异构体
B.16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子
解析:16O2和18O2是由氧元素的两种不同核素分别构成的两种不同分子,两者不属于同分异构体,A错;16O与18O电子数相同,核外电子排布也相同,B错;16O与18O都属于氧原子,之间的转化不属于化学变化,C错;标准状况下 1.12 L O2的物质的量为0.05 mol,含0.1NA个氧原子,D对。
答案:D

考点三 原子结构与元素性质
【考情分析】
|
考查 特点 |
①原子结构与元素性质, ②电子排布式 主要以填空题形式考查 |
|
应考 策略 |
复习备考时要重视抽象概念的理解,多用比较的方法来理解相近概念。复习时重点抓住主干知识、关注特殊点,如泡利不相容、洪特规则等 |
【战场演练】
1.下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
解析:NH4Cl全部由非金属元素组成,但其中含有离子键和共价键,A错误;同周期元素从左到右金属性逐渐减弱,各周期中ⅠA族元素的金属性最强,B正确;同种元素的原子质子数相同,但中子数不一定相同,如同位素,C错误;ⅦA族元素的阴离子还原性越强,则元素的非金属性越弱,则其最高价氧化物对应水化物的酸性越弱,D错误。
答案:B
2.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是 7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
解析:Al、Mg价电子排布分别为3s23p1、3s2,Al的3p1上电子更易失去,所以Al的第一电离能小于Mg,A错;卤族元素中F电负性最大,没有正价,B错,利用pH的大小测溶液的酸碱性受温度影响,在常温下pH=6.8一定显酸性,C错。故选D。
答案:D
3.下列有关物质结构的表述正确的是( )
A.次氯酸的电子式

B.二氧化硅的分子式SiO2
C.硫原子的最外层电子排布式3s23p4
D.钠离子的结构示意图

解析:HClO的电子式:

;二氧化硅是原子晶体,不存在单个的分子;钠离子结构示意图

答案:C
4.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是 ;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 , ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型为 ,
SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: ;
②H2SeO4比H2SeO3酸性强的原因: ;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为 g·cm-3(列式并计算),a位置S2-离子与b位置Zn2 离子之间的距离为 pm(列式表示)。

解析:(1)S8分子中S原子采用sp3杂化。
(2)O、S、Se原子半径逐渐增大,失电子能力逐渐增强,第一电离能逐渐减小。
(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10。
(4)H2Se的酸性比H2S强,气态SeO3分子的立体构型为平面三角形,SO32-的立体构型为三角锥形。
(5)①H2SeO3和H2SeO4第一步电离程度大于第二步电离,是因为第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;H2SeO4比H2SeO3酸性强的原因是H2SeO3和H2SeO4可分别表示为(HO)2SeO和(HO)2SeO2。H2SeO3中的Se为 4价,而H2SeO4中Se为 6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H 。
答案:(1)sp3 (2)O>S>Se (3)34 3s23p63d10 (4)强 平面三角形 三角锥形
(5)①第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
②H2SeO3和H2SeO4可分别表示为(HO)2SeO和(HO)2SeO2。H2SeO3中的Se为 4价,而H2SeO4中的Se为 6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H
(6)

=4.1,

或者下图

或者135乘以下图

5.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的电负性在同周期主族元素中最大。

(1)X位于元素周期表中第 周期第 族;W的基态原子核外有 个未成对电子;
(2)X的单质和Y的单质相比,熔点较高的是 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是
。
(4)在25 ℃、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是 。
解析:按原子序数从小到大排序为W、X、Y、Z。W的质子数为8,所以W为O;X半径大于W,且与Ne核外电子相差1,则X为Na;Y为半导体材料,必为第三周期中的Si;Z在第三周期中电负性最大,为Cl。
(1)Na位于第三周期第ⅠA族,O原子价电子轨道排布式为

,有2个未成对电子。
(2)氯元素非金属性强于溴元素,故HCl稳定性强于HBr。
(4)SiH4(g) 2O2(g)=SiO2(s) 2H2O(l)共转移8 mol电子,故放热1 520.0 kJ。
答案:(1)三 ⅠA 2 (2)Si HCl (3)SiCl4 3H2O=H2SiO3↓ 4HCl
(4)SiH4(g) 2O2(g)=SiO2(s) 2H2O(l) ΔH=-1 520.0 kJ·mol-1
点评: 本题难度不大,主要考查短周期元素性质递变规律、元素在周期表中位置及热化学方程式的书写。难点在于书写热化学方程式的规范性,如标明物质聚集状态,ΔH的正负号与吸、放热的对应关系及其单位等。
6.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期第 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:XO(g) 1\2O2(g)=XO2(g) ΔH=-283.0 kJ·mol-1
Y(s) O2(g)=YO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是 。
解析:根据题目信息,X的基态原子核外电子排布式为1s22s22p2,X为碳元素,由表中其他信息可推知,Y为S,Z为Cl,W为Cu。
(1)根据同周期元素性质的递变规律,酸性:HClO4>H2SO4。
(2)在CS2中,碳原子以sp杂化与两个硫原子形成2个σ键。在H—S、H—Cl中,由于Cl的电负性大于S,键的极性H—Cl>H—S。
(3)铜的基态原子核外电子排布在全充满状态时,体系能量较低,原子较稳定,因此铜元素的基态原子核外电子排布式为1s22s22p63s23p63d104s1(或[Ar]3d104s1)。
(4)根据盖斯定律进行解答。
答案:(1)3 ⅥA HClO4 (2)2 H—Cl H—S
(3)1s22s22p63s23p63d104s1或[Ar]3d104s1 2Cu2S 3O2=(高温)2Cu2O 2SO2
(4)2CO(g) SO2(g)=S(s) 2CO2(g) ΔH=-270.0 kJ·mol-1
7.胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。
(1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
(2)铝元素的原子核外共有 种不同运动状态的电子, 种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为: 。
(4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
解析:(1)三硅酸镁的氧化物形式为:2MgO·3SiO2·nH2O,依据对角线规则与镁不同周期但性质相似的元素为锂,其电子排布式为1s22s1。
(2)铝的电子排布式为:1s22s22p63s23p1,共有13种不同运动状态的电子,1s、2s、2p、3s、3p 5种不同的能级。
(3)原子半径:Na>Mg>Al,离子半径:Na >Al3 ,NaOH与Al(OH)3反应的离子方程式为:OH- Al(OH)3=Al 2H2O。
(4)Al2O3、MgO、SiO2都不溶于水,熔点都很高,可制耐火材料。
答案:(1)2MgO·3SiO2·nH2O 1s22s1 (2)13 5 (3)大 OH- Al(OH)3=AlO2— 2H2O (4)ad
8.(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3 3C S=(引燃)A N2↑ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为
。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 ,Q2 的未成对电子数是 。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:
[CrCln(H2O)6-n]x xR—H-——Rx[CrCln(H2O)6-n] xH
交换出来的H 经中和滴定,即可求出x和n,确定配离子的组成。
将含0.001 5 mol[CrCln(H2O)6-n]x 的溶液,与R—H完全交换后,中和生成的H 需浓度为0.120 0 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为 。
解析:(1)①电负性大小是指化合物中元素原子吸引电子能力,一般半径越小电负性越强,所以顺序为O>N>C>K。②据质量守恒定律知A为K2S,离子晶体;产物中含极性共价键的分子为CO2,CO2为直线形分子,C原子杂化轨道类型为sp杂化。③H—C≡N,σ键2个,π键2个,数目比为1∶1。(2)由题知Q、T为第Ⅷ族元素,T为Ni,Q为Fe,Ni价电子排布为3d84s2;Fe2 是Fe失去4s轨道上的两个电子,价电子排布为3d6,未成对电子数为4。(3)n(H )=n(OH-)=0.120 0 mol·L-1×0.025 L=0.003 mol。
据[CrCln(H2O)6-n]x ~ xH
1 x
0.001 5 mol 0.003 mol
得x=2
据Cr的化合价为 3价,Cl的化合价为-1价,得n=1,所以化学式为[CrCl(H2O)5]2 。
答案:(1)①O>N>C>K ②离子晶体 sp ③1∶1
(2)3d84s2 4 (3)[CrCl(H2O)5]2