*仅供医学专业人士阅读参考
在抗肿瘤药物临床试验中,我们常常看到研究终点由BICR(盲态独立中心评估)、BIRC(盲态独立评审委员会)、ICR(独立中心评估)、IRF(独立评估机构)、INV(研究者)等评估。其中讨论最多的就是BICR和INV,那么BICR和INV评估的结果有何差异?导致差异背后的原因是什么?让我们一探究竟。
01 什么是BICR和INV评估?
总生存期(OS)是评价抗肿瘤药物疗效的金标准,然而由于OS数据成熟所需的时间较长,且序贯疗法、非癌症死亡、患者失访等都可能混淆结果。因此,无进展生存期(PFS)、客观缓解率(ORR)等基于医学影像评估的替代终点,常常被用作疗效终点,甚至作为支持药物上市的关键研究的主要终点[1,2]。

BICR和INV均为目前肿瘤临床试验涉及影像评估时常采用的方法:
INV评估是指由研究者评估影像学结果及相关资料,根据疗效评价标准(如RECIST 1.1)来判断肿瘤是否进展或缓解;
BICR则是指研究中心按临床试验方案要求采集影像资料及必要的临床试验数据后,提交给独立的第三方中心进行盲态阅片,并根据RECIST 1.1来判断肿瘤是否进展或缓解[3]。
BICR有多种阅片模式可供选择,目前最常采用的是“2 1”模式,即先由两位基本阅片人在盲态下完成对同一位受试者的评估。若两者的评估结果相同,则得出最终结果;若结果不相同,则进入裁决阅片阶段,由第三位独立裁决阅片人选择出“更准确”的结果[4]。
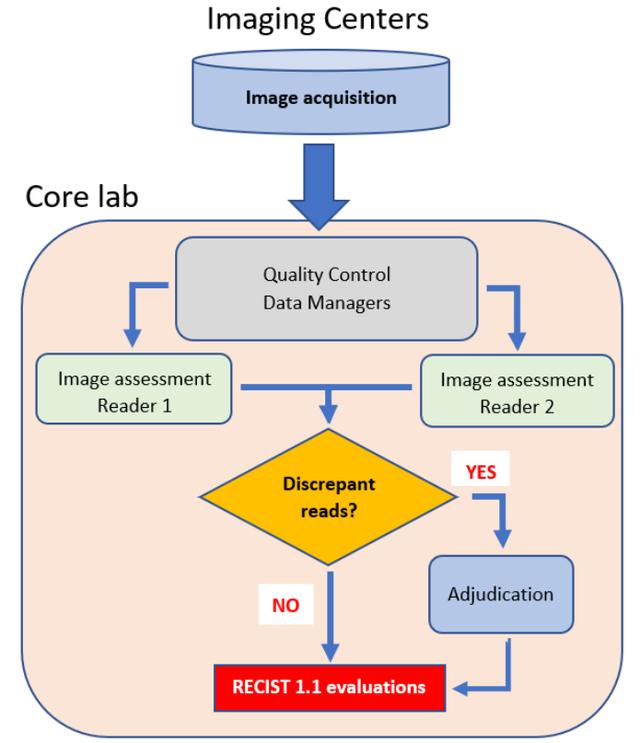
图1:BICR双盲加裁定评估工作流程图
02 BICR和INV评估存差异,应谨慎解读
与OS可以客观评估不同,PFS的评估可能受多种主观因素的影响,比如肿瘤测量的差异、靶病灶选择、新病灶检测失败、不同影像科医师和临床医师对进展的解释差异等,这些主观性都可能对治疗组之间的PFS结果评估造成不同影响[5]。
而且,阅片人本身以及不同阅片人之间的差异,可能对肿瘤缓解的评估结果产生较大的影响。阅片人在靶病变选择以及边缘测量等多方面存在差异,特别是对于交界性肿瘤[6]。
因此,在多中心研究中,虽然都采用统一的RECIST 1.1评估标准,但相比于在几十甚至上百个中心由不同的研究者分别进行阅片评估,由一个或几个BICR统一进行评估,显而易见可以更大程度地保证评估结果的一致性并减少偏倚。
中国国家药品监督管理局(NMPA)药品审评中心发布的《抗肿瘤药临床试验影像评估程序标准技术指导原则》[2]也指出:
实际上,在很多抗肿瘤临床试验中可以观察到,BICR和INV评估的PFS在数值上存在一定的差异。举例而言,在ALK-TKI相关研究中,INV评估的结果往往在数值上优于BICR评估的结果。
由此我们是否可以假设,ALK融合疾病的特点导致了在ALK相关研究中,INV结果普遍比BICR结果更长?这种差异是否可以类推到其他ALK-TKI中呢?比如CROWN研究[10]中,洛拉替尼组INV评估的中位PFS和BICR评估的中位PFS都还没到达,但是从INV 评估的HR 0.21 比BICR 评估的HR 0.28 更低来看,洛拉替尼很大可能有更长的INV 中位PFS。最终结果是否如此,让我们一起期待研究数据的出炉。
综上所述,INV与BICR评估结果在数值上可能存在一定的差异。临床医生在解读抗肿瘤药物临床研究数据时,不能简单地把INV与BICR评估的PFS混在一起进行对比,而应综合考虑评估者、评估标准等因素,在同类型的评估中进行比较(如BICR结果 vs BICR结果、INV结果 vs INV结果),知其然并知其所以然,从而更好地指导临床。
03 BICR获得国内外药监局一致推荐
虽然有研究指出,在随机双盲对照研究中,INV评估与BICR评估没有明显区别。但在开放标签的随机对照研究中,BICR评估仍十分必要。
为了确保研究数据的可靠性,美国食品药品监督管理局(FDA)建议使用BICR评估抗肿瘤药物研究的终点指标[11]。FDA指出,当主要研究终点为基于肿瘤测量的终点(如PFS、ORR)时,为了减少评估偏倚,肿瘤评估通常应由中心评估者对研究治疗进行盲法评估。BICR评估往往是III期研究获批适应证的必要条件。
同样,NMPA发布的《抗肿瘤药物试验终点技术指导原则》《晚期非小细胞肺癌临床试验终点技术指导原则》均推荐,以PFS为终点的随机对照试验采用BICR评估[12,13]。
表1:晚期NSCLC药物常用临床试验终点比较
图源:《晚期非小细胞肺癌临床试验终点技术指导原则》
总之,BICR和INV评估各有其优缺点,BICR可用于检验INV评估的结果,两者需要保持一致性。在以PFS为终点的临床研究中,两者相结合能够为研究结果带来“双保险”。需要指出的是,在解读研究结果时,虽然非头对头研究的结果不能用于直接比较,但在用作临床参考时,理清结果由BICR评估还是INV评估,采用同类评估标准的结果进行间接的比较,可更好地减少偏差,避免被误导。
参考文献:
[1].Villaruz LC, Socinski MA. The clinical viewpoint: definitions, limitations of RECIST, practical considerations of measurement. Clin Cancer Res. 2013;19:2629–2636.
[2].《抗肿瘤药临床试验影像评估程序标准技术指导原则》.
[3].Ford RR, et al. Adjudication Rates between Readers in Blinded Independent Central Review of Oncology Studies. J Clin Trials 2016, 6:5.
[4].Beaumont H, Iannessi A, Wang Y, et al. Blinded Independent Central Review (BICR) in New Therapeutic Lung Cancer Trials. Cancers (Basel). 2021;13(18):4533.
[5].Dodd LE, Korn EL, Freidlin B, et al. Blinded independent central review of progression-free survival in phase III clinical trials: important design element or unnecessary expense? J Clin Oncol. 2008;26:3791-3796.
[6].Walovitch R, Girardi, Duan F. A Simulation Study to Evaluate Accuracy and Precision of Blinded Independent Central Reviews of Progression-free Survival in Cancer Clinical Trials.J Clin Trials 2013, 3:3.
[7].Camidge D R, Dziadziuszko R, Peters S, et al. Updated efficacy and safety data and impact of the EML4-ALK fusion variant on the efficacy of alectinib in untreated ALK-positive advanced non–small cell lung cancer in the global phase III ALEX study. Journal of Thoracic Oncology, 2019, 14(7): 1233-1243.
[8].Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064.
[9].Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib Versus Crizotinib in Advanced ALK Inhibitor-Naive ALK-Positive Non-Small Cell Lung Cancer: Second Interim Analysis of the Phase III ALTA-1L Trial. J Clin Oncol. 2020;38(31):3592-3603.
[10].Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer. N Engl J Med. 2020;383(21):2018-2029.
[11].Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics Guidance for Industry. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-trial-endpoints-approval-cancer-drugs-and-biologics
[12].《抗肿瘤药物试验终点技术指导原则》.
[13].《晚期非小细胞肺癌临床试验终点技术指导原则》.
*此文仅用于向医学人士提供科学信息,不代表本平台观点
,