学习目标
1.认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化 学方程式。
2.通过实验分析、推理等方法认识盐类水解的实质、掌握盐溶液呈酸、碱性的原因和规律, 能根据盐的组成判断溶液的酸、碱性。
3.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响。
知识点 1 盐溶液的酸碱性及原因
1.探究盐溶液的酸碱性 用 pH 计测定下列溶液的 pH 与 7 的关系,按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完 成下表。

2.理论分析:盐溶液呈酸碱性的原因
(1)强酸强碱盐(以 NaCl 为例)
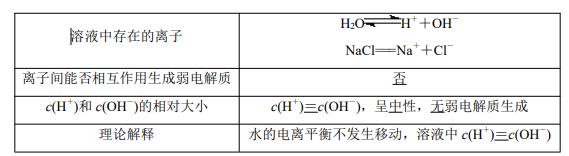
(2)强酸弱碱盐(以 NH4Cl 为例

(3)强碱弱酸盐(以 CH3COONa 为例

3.盐类水解
(1)概念:在水溶液中,盐电离出来的离子与水电离出来的 H +或 OH -结合生成弱电解质的反 应,叫做盐类的水解。
(2)实质:生成弱酸或弱碱,使水的电离平衡被破坏而建立起新的平衡。
(3)盐类水解的特点

例 1.有下列盐溶液: ①KNO3 ②CuSO4 ③K2CO3 ④FeCl3 ⑤K2SO4 ⑥NaClO ⑦NH4Cl ⑧AgNO3 呈酸性的是________(填序号,下同),呈碱性的是________,呈中性的是________。
例 2.等物质的量浓度的下列物质的溶液,其 pH 由小到大的顺序排列正确的是________。 ①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3 ⑥CH3COOH
例 3.常温下,某浓度的 NH4Cl 溶液的 pH 为 4,回答下列问题。
(1)该氯化氨溶液中含氮元素的微粒有______________________。
(2)比较该溶液中的 c(Cl- )____(填“>”“<”或“=”)c(NH + 4 ) 。
(3)该氯化氨溶液中水电离的氢离子浓度______(填“>”“<”或“=”)pH=4 盐酸中水电 离的氢离子浓度。
(4)该氯化氨溶液中 c 水(H + )与 pH=4 盐酸中 c 水(H + )比值为_______。
归纳总结

常见不水解的离子 强酸阴离子:Cl-、SO2- 4 、NO - 3、Br-、I-、ClO - 4 强碱阳离子:K +、Na+、Ca 2+、Ba 2+
知识点 2 盐类水解方程式的书写
1.盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一 般用“ ”连接,产物不标“↑”或“↓”。如:

2.多元弱酸根离子的水解分步进行,水解以第一步为主。如:


4.弱酸弱碱盐中阴、阳离子水解相互促进。 (1)NH + 4 与 S 2-、HCO - 3 、CO2- 3 、CH3COO -等组成的盐虽然水解相互促进,但水解程度较小, 书写时仍用“ ”表示。如:NH + 4 +CH3COO -+H2O CH3COOH+NH3·H2O。 (2)Al3+与 CO2- 3 、HCO - 3 、S 2-、HS -、AlO - 2 ,Fe 3+与 CO2- 3 、HCO - 3 等组成的盐水解相互促进 非常彻底,生成气体和沉淀,书写时用“===”表示。如 Al3++3HCO - 3 ===Al(OH)3↓+3CO2↑。 (一般要有弱碱沉淀生成)
例 1.写出下列物质发生水解反应的离子方程式,并指明水溶液的酸碱性:
(1)Na2S:_____________________________________________________________。
(2)CuSO4:_____________________________________________________________。 (3)CH3COONa:_______________________________________________________。
例 2.氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,用离子方程式表示其原因: ________________________________________________________________________。
归纳总结
弱酸的酸式酸根离子在水溶液中存在电离平衡和水解平衡,弱酸酸式盐溶液的酸碱性取决于 其电离程度和水解程度的相对大小。
(1)水解程度大于电离程度:如呈碱性的 NaHCO3、NaHS、Na2HPO4溶液。
(2)电离程度大于水解程度:如呈酸性的 NaHSO3、KHC2O4、NaH2PO4溶液。
知识点 3 影响盐类水解的主要因素
1.反应物本身性质的影响 盐类水解程度的大小主要由盐的性质所决定的,生成盐的弱酸(或弱碱)越难电离(电离常数越 小),盐的水解程度越大,即越弱越水解。
2.实验探究反应条件对盐类水解程度的影响
已知 FeCl3发生水解反应的离子方程式:Fe 3++3H2O Fe(OH)3+3H +,根据实验操作填 写下表:
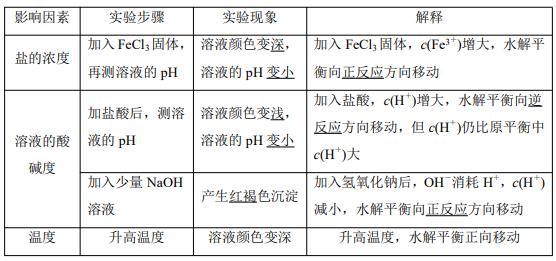
特别提醒 盐类的水解平衡移动,符合勒夏特列原理。
3.盐的水解常数
(1)表达式

由此可看出,弱酸或弱碱的电离常数越小(越弱),其生成的盐水解的程度就越大。
特别提醒 NaHCO3溶液中,水解程度和电离程度的相对大小可以以水解常数(Kh)与电离常 数(Ka2)的相对大小进行比较。
例 1.向纯碱溶液中滴入酚酞溶液: (1)观察到的现象是_____________________________________________________________, 原因是_______________________________________________________(用离子方程式表示)。 若微热溶液,观察到的现象是________,由此证明碳酸钠的水解是________(“吸热”或“放 热”)反应。
(2)Na2CO3 溶液中 cNa+ cCO2- 3 ____2(填“大于”或“小于”),能使其比值接近 2 的措施有 ________(填序号)。
①加入适量盐酸 ②加入适量的 NaOH 溶液 ③加入适量的 KOH 溶液 ④加热 ⑤加入适 量的 KHCO3固体
(3)若向溶液中加入少量氯化铁溶液,观察到的现象是 ________________________________________________________________________, 反应方程式是__________________________________________________________________。
例 2.由数据分析,室温下,NaHSO3溶液呈酸性的原因?(已知 H2SO3 Ka1=1.4×10-2,Ka2 =6.0×10-8
水解平衡移动的分析
(1)水解平衡正向移动,离子的水解程度不一定增大。若升高温度水解平衡正向移动,离子 的水解程度增大,若增大离子的浓度使水解平衡正向移动,离子的水解程度反而减小。
(2)水解平衡移动,水解平衡常数不一定改变。水解平衡常数只与温度有关。
(3)水解平衡移动符合勒夏特列原理
知识点 4 盐类水解的应用
1.在化学实验中的应用

2.在生产生活中的应用


例 1.下列事实,其中与盐类的水解有关的是________。 ①NaHSO4溶液呈酸性; ②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结; ③配制 CuCl2溶液,用稀盐酸溶解 CuCl2固体; ④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞; ⑤氯化铵或氯化锌溶液可去除金属制品表面的锈斑; ⑥加热 FeCl3·6H2O 晶体,往往得不到 FeCl3固体。
例 2.将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再灼烧,得到化学组成与原固 体物质相同的是________。 ①胆矾 ②氯化铝 ③硫酸铝 ④氯化铜 ⑤硫酸亚铁 ⑥碳酸
知识延伸
盐溶液蒸干灼烧后所得产物的判断
(1)强酸强碱盐溶液和水解生成难挥发性酸的盐溶液,蒸干后一般得到原物质,如 NaCl 溶液 蒸干得 NaCl 固体,CuSO4溶液蒸干得 CuSO4固体。
(2)盐溶液水解生成易挥发性酸时,蒸干后一般得到对应的弱碱,如 AlCl3、FeCl3溶液蒸干 后一般得到 Al(OH)3、Fe(OH)3,若灼烧则会生成 Al2O3、Fe2O3。
(3)酸根阴离子易水解的强碱盐,蒸干后可得到原物质,如 Na2CO3溶液蒸干得 Na2CO3固体。
(4)考虑盐受热时是否分解。因为 Ca(HCO3)2、NaHCO3、NH4Cl 固体受热易分解,因此蒸干 灼烧后分别为 Ca(HCO3)2→CaCO3;NaHCO3→Na2CO3;NH4Cl→NH3↑+HCl↑。
(5)还原性盐在蒸干时会被 O2氧化,如 Na2SO3溶液蒸干得到 Na2SO4;FeSO4溶液蒸干得到 Fe2(SO4)3。
,




