第一章《原子结构与性质》
考点一:原子核外电子排布
1.排布规律
(1)能量最低原理:基态原子核外电子优先占据能量最低的原子轨道,如Ge:1s22s22p63s23p63d104s24p2。
(2)泡利原理:每个原子轨道上最多只能容纳2个自旋状态不同的电子。
(3)洪特规则:原子核外电子在能量相同的各轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同。
2.表示方法:①原子结构示意图;②电子式;③电子排布式;④电子排布图;⑤价电子排布式。要求会写1至36号元素的核外电子排布,特别是第四周期的过渡金属。
(1)电子排布式:按电子排入各电子层中各能级的先后顺序,用能级符号依次写出各能级中的电子数,同时注意特例(全空、半充满、全充满时相对稳定,如24Cr 、29Cu 。。)如:Cu:1s22s22p63s23p63d104s1
(2)简化电子排布式:“[稀有气体]+价层电子”的形式表示。如:Cu:[Ar]3d104s1
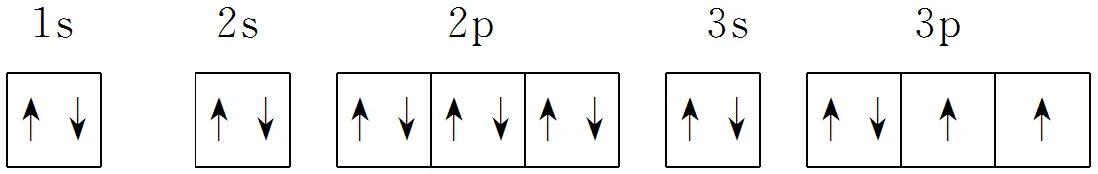
(3)电子排布图:用方框表示原子轨道,用“↑”或“↓”表示自旋方向不同的电子,按排入各电子层中各能级的先后顺序和在轨道中的排布情况书写。
如S: