肿瘤机制研究:lncRNA调控姐妹染色单体凝聚力

导语
西班牙纳瓦拉大学“应用医学研究中心”的Huarte教授发现了一个新的人源长链非编码RNA,命名为粘连调控非编码RNA(CONCR,cohesion regulator noncoding RNA);在多种癌症中通过MYC,CONCR被转录激活并表达显著上调。作者揭示了在姐妹染色单体粘连建立中,lncRNA通过调控DDX11酶活而发生的直接调控作用。
《Molecular Cell》报道摘要

《A Long Noncoding RNA Regulates Sister Chromatid Cohesion》.Available online 28 July 2016
长链非编码RNA通过多种机制参与多样的细胞生物功能以及疾病的发生发展。西班牙纳瓦拉大学“应用医学研究中心”的Huarte教授发现了一个新的人源长链非编码RNA,命名为粘连调控非编码RNA(CONCR,cohesion regulator noncoding RNA),在多种癌症中通过MYC,CONCR被转录激活,并表达显著上调。CONCR表达受到细胞周期调控,而且细胞周期进展以及DNA复制都需要CONCR。在细胞分裂过程中去除CONCR,姐妹染色单体粘连表现出严重缺陷,预示着CONCR在粘结建立中发挥重要的作用。DDX11是一个DNA依赖的ATP酶和螺旋酶,DDX11参与姐妹染色单体粘连和DNA复制,CONCR与DDX11相互作用并调控DDX11活性。作者揭示了lncRNA在姐妹染色单体粘连建立中通过调控DDX11酶活的直接调控作用。

Masai H, Matsumoto S, You Z, et al. 《Eukaryotic chromosome DNA replication: where, when, and how?》. Biochemistry, 2010, 79(1): 89.
忠实的DNA复制和合理的姐妹染色单体粘连确保了遗传物质在细胞分裂过程中正确分配给子代细胞。通过RNA-pull down与质谱技术发现在这个过程中有大量的细胞因子参与。
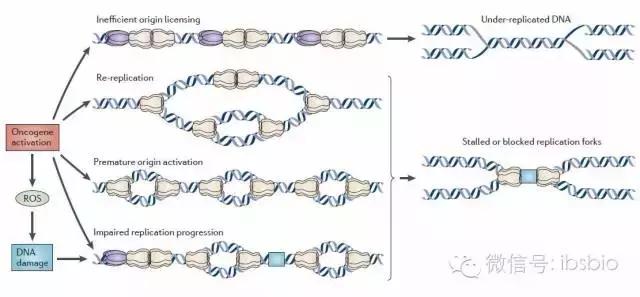
Gaillard H, García-Muse T, Aguilera A. 《Replication stress and cancer》. Nature Reviews Cancer, 2015, 15(5): 276-289.
基因组的稳定性直接关联到细胞是否发生癌变,而在这其中,DNA复制是最容易发生变化的过程,也是最容易致癌的过程。任何导致DNA损伤高水平发生的条件也都会引发复制应激(replication stress),这是基因组不稳定的来源之一,也是癌变前细胞和癌变细胞的一大标志。

Losada A. 《Cohesin in cancer: chromosome segregation and beyond》. Nature Reviews Cancer, 2014, 14(6): 389-393.
大量的癌症基因组测序项目,每天都在发现可能与肿瘤形成有关的新基因。黏连蛋白(cohesin)就是一个很好的例子,cohesin是一种围绕DNA的环状蛋白复合体,控制着细胞的分裂。就在几个月前,人们通过测序数以千计的肿瘤样本发现,STAG2是一些癌症中(例如膀胱癌和黑色素瘤)突变最为频繁的基因之一。STAG2基因的产物就是cohesin的一个组分。cohesin能够阻止姐妹染色单体过早分离,有助于细胞将遗传物质平分给子细胞和DNA的修复。“近几年来,一些研究发现这一复合体还有其他的功能,例如维持基因组的3D结构和基因表达,”Losada说。这意味着,cohesin在细胞不分裂的间期也有功能,间期是细胞周期中最长的一个阶段。这一新功能为肿瘤疾病的研究开辟了一块新领地,有助于人们理解cohesin突变的重要性,以及cohesin突变与癌症的关联。
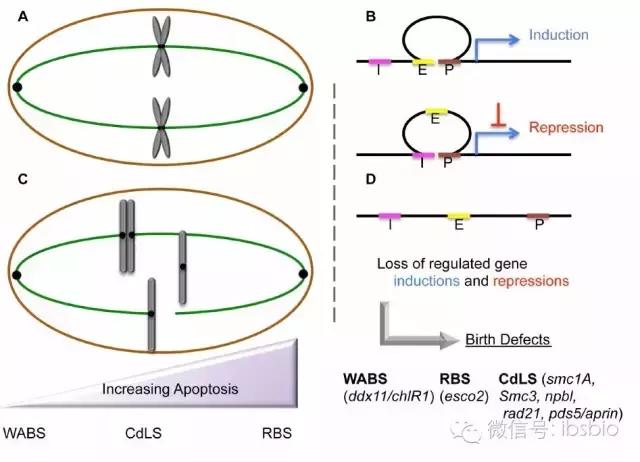
Skibbens R V, Colquhoun J M, Green M J, et al. 《Cohesinopathies of a feather flock together》. PLoS Genet, 2013, 9(12): e1004036.
罗伯茨综合征(Roberts Syndrome,RBS)和德朗热综合征(Cornelia de Lange,CdLS)是严重的发育疾病。cohesion参与的一个单一信号通路突变引起了RBS和CdLS。

Bharti S K, Khan I, Banerjee T, et al. 《Molecular functions and cellular roles of the ChlR1 (DDX11) helicase defective in the rare cohesinopathy Warsaw breakage syndrome》. Cellular and molecular life sciences, 2014, 71(14): 2625-2639.
DDX11因子是一个DNA依赖的ATP酶和螺旋酶,在DNA复制过程中一方面加工后随链,一方面为cohension染色单体状态的确立而维持复制叉的结构。
Capo‐Chichi J M, Bharti S K, Sommers J A, et al. 《Identification and biochemical characterization of a novel mutation in DDX11 causing Warsaw breakage syndrome》. Human mutation, 2013, 34(1): 103-107.
DDX11缺陷与Warsaw breakage syndrome综合症有关,该综合症特定就是细胞水平的姐妹染色单体粘连缺陷。
虽然大量已知蛋白参与DNA复制和粘连,但是lncRNA参与该进程的报道还没有,由此作者抓住这一创新点,发现了一个lncRNA通过调节DDX11酶活从而调控DNA复制和姐妹染色单体粘连。lncRNA的表达直接与肿瘤的增殖能力相关,lncRNA增强了肿瘤细胞恶性程度。由此增加了本研究的临床意义。
CONCR受p53负调控,被MYC激活

p53是细胞稳态的主要调控因子,它抑制失控细胞的增殖。p53 KO细胞系能够绕过DNA损伤引起的细胞周期停滞。为了发现lncRNA的参与,作者搜索p53损伤的细胞中lncRNA差异表达。作者通过RNA-seq技术测序了DNA损伤药物5-FU处理和未处理的p53-/-和p53 / 的HCT11细胞,通过挑选p53-/-和p53 / 差异转录本,特别是关注在DNA损伤或者DNA未损伤情况下在p53-/-中高表达的lncRNA转录本。作者发现了4143个mRNA在p53-/-增强表达,并且这些mRNA与细胞周期,减数分裂,DNA损伤,DNA复制有关;同样发现了81个lncRNA增强表达,由此我们假设这81个转录本参与细胞周期的进程。
在81个转录本中发现了一个以前被注释为DDX11-AS1的反义转录本。将该转录本命名为CONCR。CONCR与DDX11转录方向相反而且并没有重叠区。与野生型p53细胞相比,在p53缺陷型细胞中显著高表达。在A549细胞中,通过RNAi干扰降低p53表达以及通过DNA损伤处理和非处理后发现p53与CONCR表达呈现负相关。由此推断p53缺失引起了CONCR表达的增加。
p53可以直接或者间接调控转录。分析CONCR启动子区并没有发现p53结合位点,通过CHIP-Seq验证得到同样的结论,p53并非直接与CONCR启动子结合,由此预示在p53 / 细胞中CONCR低表达是间接的p53依赖性的抑制。虽然没有发现p53结合位点,到那时在在CONCR启动子区发现了转录因子MYC的结合基序,在多个细胞的CHIP-Seq数据中也发现了MYC结合。进一步通过RNA-seq数据挖掘发现在人的B细胞系中过表达MYC以后CONCR明显上调。
p53可以直接或者间接调控转录。分析CONCR启动子区并没有发现p53结合位点,通过CHIP-Seq验证得到同样的结论,p53并非直接与CONCR启动子结合,由此预示在p53 / 细胞中CONCR低表达是间接的p53依赖性的抑制。虽然没有发现p53结合位点,到那时在在CONCR启动子区发现了转录因子MYC的结合基序,在多个细胞的CHIP-Seq数据中也发现了MYC结合。进一步通过RNA-seq数据挖掘发现在人的B细胞系中过表达MYC以后CONCR明显上调。在A549中沉默MYC,发现CONCR的表达明显降低。p53和MY都调控细胞周期,为排除CONCR改变是细胞周期失调间接作用,通过沉默E2F1基因,E2F1是调控细胞周期从G1到S期转录因子,与预期相符:当沉默E2F1以后细胞周期受到影响而CONCR表达并没有受到影响。但是这些结果并不能完全证明是结果还是原因,这个对于lncRNA研究来说是个难题。
CONCR在不同的人类细胞中广泛表达,CONCR有三个转录本,其中2个外显子转录本ENST00000618041.1表达丰度最高。CONCR成熟转录本缺少完整编码框,具有较低编码潜力;qRT-PCR,FISH和RNAi实验验证CONCR大部分位于细胞核。
CONCR在多种类型的肿瘤中上调

CONCR与p53和MYC相关性预示CONCR在癌症中起着重要作用,通过挖掘RNA-seq数据库发现CONCR在12种肿瘤类型中有9种明显上调。p53突变型与野生型相比CONCR表达明显上调。由此,CONCR在肿瘤中表达水平增高是p53突变和功能损伤引起。作者通过小鼠移植瘤模型观察肿瘤的增殖,在CONCR降低和表达的HCT116细胞中,RNAi组影响了肿瘤形成,而对照组肿瘤生长明显。
CONCR周期性表达,是细胞分裂和存活所需要的

为了研究CONCR的细胞功能,通过RNAi降低细胞中CONCR表达水平,细胞的增殖能力明显降低,细胞凋亡增加,大部分细胞阻断在G0/G1期。由此表明CONCR在细胞分裂和存活中的作用。为进一步阐述CONCR的功能,通过基因芯片分析CONCR RNAi以后基因表达谱改变。发现500个基因受到明显的影响,包括编码和非编码基因。基因GO分析发现与凋亡,细胞周期有关基因明显富集,大量下调基因参与G1到S期转变,基因型和表型相当吻合。
为了观测CONCR降低对细胞周期进展的影响,作者调查了lncRNA横跨不同细胞周期的表达变化。对G1/S期通过TdR双阻断法(double-thymidine block) 进行同步化。同步化细胞通过PI染色过流式细胞仪。对不同时间点的RNA进行CONCR表达分析发现CONCR表达式周期性的,在G1中晚期达到峰值。已知的细胞周期基因CCNE1(G1峰值),CCNA2(G2峰值),CCNB1(M峰值)被用作对照组。RNA FISH得到相似的结果。沉默CONCR后通过TdR双阻断法同步化会损伤细胞从S期重启的能力,大部分细胞被延迟。
为了进一步观测延迟效应,细胞进行了BrdU标记。CONCR被沉默,复制DNA被BrdU标记,细胞通过流式细胞仪分析,发现在CONCR降低的细胞中BrdU掺入新合成DNA双利明显减少,预示CONCR参与了DNA复制过程。总之,在整个细胞周期过程中CONCR受到了紧凑的调控,它对于G1/S转换和DNA复制是需要的。
CONCR缺失表现姐妹染色单体粘连缺陷表型
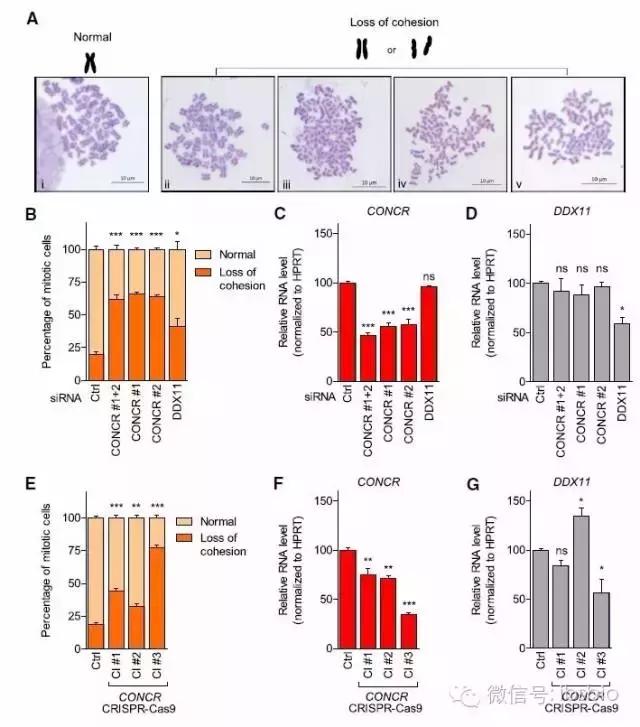
深入了解CONCR功能,作者针对495个正常和肿瘤组织标本的RNA-Seq数据进行相关性分析。分析表明与CONCR共表达的基因中,编码蛋白参与DNA复制和染色体的维持,其中包括DDX11和它的反应蛋白,如TIMELESS,ESPL1,以及微小染色体维持蛋白复合物组分。DDX11在姐妹染色单体粘连中功能已知,因此激发兴趣研究CONCR在此过程中的作用。
有意思的是CONCR缺失和CONCR干扰都引起了姐妹染色单体粘连损失的细胞比例增加。DDX11 RNAi干扰后姐妹染色单体粘连损失也同样观察到。CONCR和DDX11 KD的细胞观测到细胞的死亡,DDX11沉默的细胞中有30%凋亡细胞,由此支持以前报道的DDX11基因敲除对于小鼠是致死的;DDX11或者CONCR表达水平分别在各自沉默组中有50%的降低足以引起大量的粘连缺陷并导致致命。为了进一步证明作者的看到的结果,通过CRISPR-CAS9技术,在A549中通过在CONCR启动子区插入polA信号来终止CONCR启动子表达,获得2个克隆明显降低了CONCR表达。与预计表型一致,CRISPR-CAS9编辑细胞的粘结缺陷中期细胞数量明显一致增加,结果与RNAi一致。实验一致证明CONCR在姐妹染色单体粘连中是具有生物学功能的。
CONCR调控DDX11螺旋酶活性

从表型和功能上都表明CONCR和DDX11紧密关联,它们是反向转录的共同调控基因。目前lncRNA研究,毗邻lncRNA通过顺式作用调控编码基因机制已经有大量报道。然而CONCR的缺失引起粘结缺陷并没有影响DDX11 RNA水平。事实上,当沉默lncRNA或者增强lncRNA表达时候,DDX11 RNA表达水平并未改变。改结论与表观遗传数据也一致,在CONCR KD以后DDX11的组蛋白H3K9乙酰化水平并未改变。由此得出结论CONCR并不调控DDX11 RNA或者蛋白水平。
以上实验结论排除了lncRNA顺式调控DDX11,由此我们会进一步调查他们直接是否会直接相互作用,通过蛋白和lncRNA生理上直接的结合。通过RNA-Pull dwon分析CONCR的相互作用蛋白中有DDX11。RIP实验得到了进一步验证。
因为DDX11因子是一个DNA依赖的ATP酶和螺旋酶,在DNA复制过程中一方面加工后随链,一方面为cohension状态的确立而维持复制叉的结构。因此我们推断CONCR与DDX11关联影响DNA复制的功能。通过氯化铯密度梯度离心分离染色质级份,分离的级份大量的DNA复制因子富集,这些蛋白与染色质结合,这些染色质来自细胞核的可溶性的级份以及游离的DNA。发现DDX11在染色质级份富集,与CONCR共定位,CONCR KD能够诱导DDX11从染色质结合级份想游离可溶性级份转换。虽然通过CHIP-seq进一步证明DDX11广泛的与染色质结合。
为了进一步验证CONCR和DDX11在功能上的相关性,在CONCR缺失或者不缺失的细胞系中过表达DDX11,观测到CONCR缺失细胞中姐妹染色单体粘连损伤明显增加,然而,通过过表达DDX11可以营救表型。

既然在CONCR和DDX11之间有生理和功能上相互作用,但是在酶催化突变的细胞中并没发现这种相互作用,作者进一步假设CONCR可能影响DDX11的酶活性。实验证明在CONCR存在情况下明显增加DDX11催化ATP的活性。体外分析表明CONCR作为DDX11酶活调控因子,对于DNA复制和姐妹染色单体粘连中蛋白的恰当功能是需要的。
研究亮点

A.CONCR是在人体中发现的由MYC激活并在多种癌症中上调的非编码RNA
B.CONCR表达为周期性的,是细胞分裂和存活所需的
C.失活CONCR引起姐妹染色单体粘连缺陷
D.CONCR调控DDX11螺旋酶活性
CONCR在细胞分裂关键步骤起着重要作用,它影响基因组的稳定性,CONCR是肿瘤细胞的一个重要的标记物。
----------艾博思生物原创,转载注明出处!
,




