01定义
分析方法转移(analytical method transfer),是一个文件记录和实验确认的过程,目的是证明一个实验室(接收实验室)在采用另一实验室(转出实验室)建立并经过验证的非法定分析方法检测样品时,该实验室有能力成功地操作该方法,检测结果与转出实验室检测结果一致。分析方法转移是保证不同实验室之间获得一致、可靠和准确检测结果的一个重要环节,同时也是对实验室检测能力的一个重要评估。
02适用范围
药品、原料药、辅料、包材、起始物料、中间体和清洁残留物的检测方法均适用于分析方法转移。在研发过程中使用而在正式生产时不经常使用的方法,如溶出曲线测定等,也需要进行分析方法的转移。
分析方法转移的情况包括:
(1)从研发实验室(包括合同研究组织实验室)转到质控实验室;
(2)实验室搬迁由A场所转移到B场所;
(3)中间产品检测方法由QC实验室转到车间中控实验室;
(4)购买产品后从A公司转到B公司;
(5)企业位于不同地点的生产工厂之间的分析方法转移;
(6)委托检验。
03转移时间点
分析方法转移需要在接收实验室批准使用该方法前完成,一般在产品工艺验证之前或者场地变更样品生产之前完成。
04样品要求
分析方法转移用样品的选择需要综合考虑转移的项目和转移的不同阶段。中国药典分析方法转移技术指导原则指出,因为转移目的与生产工艺无关,是为了评价接收方是否具备使用该方法的能力,方法转移可选择一个批次样品。在转移过程中,考虑到结果评估和统计计算的需要,可以选择1-3批样品。
为了保证不同实验室检测结果的一致性,要确保样品具有一定的稳定性,排除运送和检测时间差造成的产品差异。最好选用处方、工艺确定后的样品。稳定性指示方法(如有关物质)的转移可以选用杂质加标的样品或者强制降解样品。对于已上市产品不同生产场地间分析方法转移,最好不要选用已经出库销售的产品,防止分析方法转移过程中出现不合格检测项,对药品上市销售造成影响。如果被测样品有多个规格,原则上方法转移须涵盖样品的几个规格(如最高及最低规格)。样品的批次和规格的选择应由方法转出和接受实验室协商决定。
05转移类型
分析方法转移有四种类型,需要基于接收方的经验和知识水平、样品的复杂程度和特殊性以及对过程的风险评估结果选择合适的转移类型。

1. 比对试验
比对试验是最常用的方法,必须是已经验证过的方法,需要接收方和转移方共同对预先确定数量的同一批次样品进行分析。也可以采用其他方法,如:在样品中加入某个杂质的回收率实验,接收方能够达到预先制定的可接受标准。
使用此方法时,需要方法建立实验室与方法接收实验室能够良好合作,一般是同一家公司的研发实验室与QC实验室,或CRO与制药企业,或同一企业的不同实验室之间。
2. 两个或多个实验室间共同验证
共同验证是所有常规分析方法转移中最简便的,也可适用于没有完成验证的方法。执行分析方法验证的实验室要具备运行该分析方法的资格。转移方可与接收方一起进行实验室间的共同验证工作,包括接收方可作为转移方分析方法验证团队的一部分,从而获得重现性评估数据。要确保两个实验室的分析方法一致,尽量使用相同/等同的检验设备(如分析仪器,色谱柱等)。接收方实验室的验证数据将包含在方法学验证报告中作为方法转移的证据。共同验证要按照预先批准的转移或验证方案进行,方案中需说明哪些指标由接收方完成、具体方法、所使用样品和预定的可接受标准。
此方法一般适用于同一家公司的研发实验室与QC实验室之间进行。
3. 再验证
再验证或部分验证是指接收实验室重复一部分或者全部验证试验,需要在初始方法验证之后完成。再验证方法学参数需要根据转移方法的特点和复杂程度来确定,如溶液稳定性、杂质检测的定量限和专属性等。
如果验证时间比较久远,资料丢失,或者转移方不配合时,一般采用再验证的转移方法。
4. 转移豁免
在某些特定的情况下,常规的分析方法转移可豁免。此时,接收方使用转移方的分析方法,不需要比对实验室间数据,但应根据豁免理由形成文件。转移豁免的情况如下:
(1)新的待测定样品的组成与已有样品的组成类似和/或活性组分的浓度与已有样品的浓度类似,并且接收方有使用该分析方法的经验,如无菌粉末分装制剂的含量检测方法与原料药的含量检测方法相同的情况。
(2)被转移的分析方法收载在药典中,并无改变,此时应采用分析方法确认。
(3)被转移的分析方法与已使用方法相同或相似。如含量测定和含量均匀度检查,采用相同的检验方法,可以只做含量测定方法转移,而不需再额外进行含量均匀度方法的转移。
(4)转移方负责方法开发、验证或日常分析的人员调转到接收方。
06分析方法转移方案内容
通常情况下,转出方负责转移方案的起草,双方讨论达成共识,在转移前得到批准。转移方案中需要包括以下内容:
- 文件号、签名批准;
- 转移目的和范围;
- 转移双方职责:转出方一般负责提供分析方法、对照品、验证报告、必要的文件、对接收方进行培训,在方法转移过程中给予接收方必要的帮助。接收方确保具有适当资质的人员、对人员进行培训、确保设施及仪器校验及确认在有效期内、确定实验室的体系符合相应要求;
- 样品信息:剂型、规格、批号、储存条件、运输条件,可以简单说明代表性样品选择的理由;
- 对照品信息:批号、含量、来源、储存条件、运输条件、有效期;
- 使用物料信息:名称、来源、级别;
- 检验仪器:生产厂家、型号、编号、技术参数、检定日期;
- 文件清单:相关sop、验证报告、对照品说明书或者标定报告等;
- 分析方法:分析方法应该包含充足的细节和明确的指示,使得训练有素的分析人员可以毫无困难的执行,如前处理、配样个数、重复次数、进样顺序等;
- 实验设计和结果评估标准:明确每个检验/验证指标的具体操作过程和人员、可接受标准、结果分析的方法、允许的偏差等。评估标准可以用统计学方法制定,其原则一般基于双方均值差异以及拟定的范围来计算,并应提供变异估计(如每个试验场所的相对标准偏差RSD%),特别是接收方的中间精密度RSD%和/或用于对比含量和含量均匀度试验均值的统计学方法。在杂质检查时,精密度一般较差(如痕量杂质检查),可使用简便的描述性方法。溶出度可通过使用f2因子或比较特定时间点的溶出数据进行评价。对于未评价的分析方法验证指标,应说明原因。分析方法转移接受标准可参见《中国药品检验标准操作规范》中的对比试验分析方法转移接受标准示例,如下图所示:
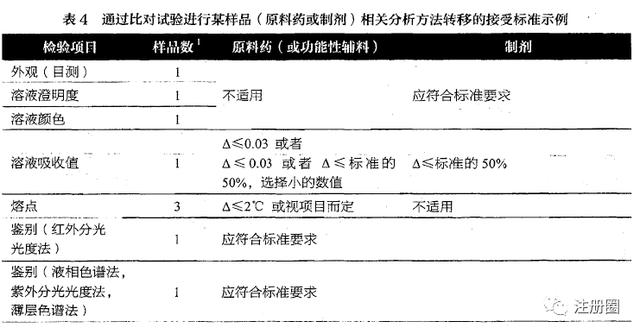

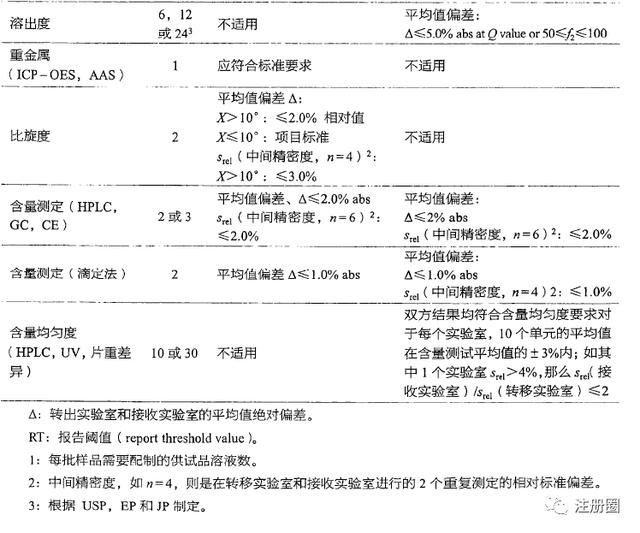
- 报告结果要求:明确结果修约、小数点位数要求,图谱和报告的格式要求,确保数据完整性和实验室间一致性;
- 偏差处理:说明如何管理可接受标准的偏差;
- 转移时限:对于不稳定产品的方法转移,双方实验室的测定时间差要明确约定;
- 参考文件:转移方案起草参考的文件、法规、技术指导原则;
- 附件:转移方案的附件。
07转移报告
当分析方法转移成功后,接收方应起草方法转移报告,汇总转移方和接收方检验结果,根据转移方案中的接受标准对整个方法转移做出评估及总结。如多个接受实验室参与方法转移,每个接受实验室的结果都应和转出实验室的结果进行比较。转移方和接收方都要审核方法转移报告,并由所有相关实验室的审核部门批准。
转移报告应该包括以下内容:
- 被测样品名称;转移的分析方法(名称、版本号);
- 方法转移方案、接收实验室人员培训记录;
- 双方责任(如方法转移总结报告的审核和批准);
- 转移中使用的仪器、器具和试剂;转出方和接收方的检验结果;
- 评估报告中的偏差及异常结果的调查;
- 根据接受标准评估数据;
- 后续工作安排(如适用);
- 总结和结论。
如果实验结果符合制订的可接受标准,则分析方法转移成功,接收方具备了实施该方法的资质。否则不能认为分析方法转移已完成,应确定问题的根源。此时应采取有效的补救措施使其符合可接受标准(再培训,对复杂检测方法的清晰阐述、更换设备等)。如果修改接收标准,须说明原因,由双方确认。对转移方案发生的任何变更,须获得批准后才能收集新数据。如果分析方法需要变更,转出实验室应在方法转移总结报告中提出分析方法变更的细节和评估变更后的方法是否需要再验证。
结语
以上是我根据相关法规指导原则和多个讲者的培训,结合自己的工作经验整理汇总的,如有不足之处,请多多指正。
此文为原创文章,对以上观点,有任何不妥之处,欢迎大家积极斧正,评论留言交流。
更多其他资讯与服务请关注:注册圈。
注册圈,让注册人不再孤单!齐聚各层制药人,加入交流圈一起分享行业知识吧~
,