高中化学同步讲座
陕西省首届省级高中化学骨干教师和教学能手,全国化学竞赛优秀辅导员,中学化学高级教师,曾任教于西安市第一中学、西安电子科技大学附中、西工大文化补习学校和西安黄冈文化补习学校

1.溶质的质量分数在实际使用时有很多不便之处
2.对于溶液,量取体积要比称量质量更易操作。能不能通过量取一定体积的溶液就知道其中含有多少摩尔溶质呢?
为此我们要引入一个新的表示溶液浓度的物理量。
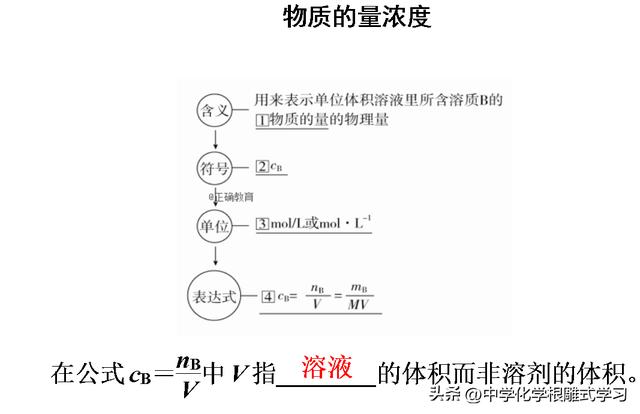
98 g H2SO4溶于1 L水中配成的溶液即是1 mol/L的H2SO4溶液,这句话正确吗?为什么?
不正确。将98 g H2SO4(即1 mol)溶于1 L水后所得溶液体积不是1 L,故H2SO4的物质的量浓度不是1 mol/L。
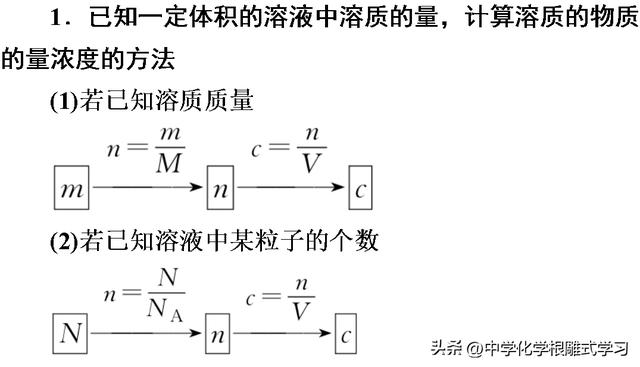
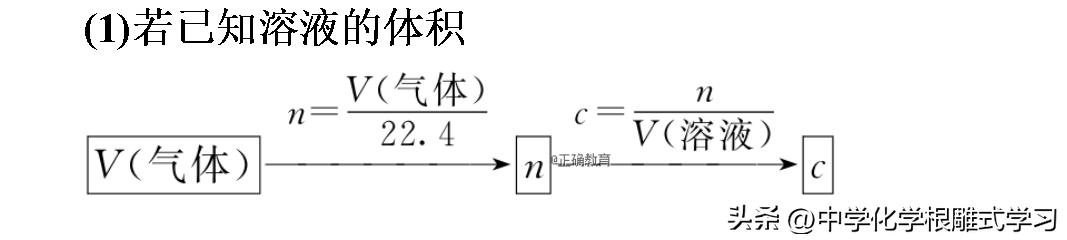
2.一定体积的气体(标准状况)溶于水后形成的溶液中溶质的物质的量浓度的计算方法



对物质的量浓度的理解:
对物质的量浓度的理解:
(1)体积是溶液的体积,不是溶剂的体积。
(2)溶质用物质的量表示,不是用质量表示。
(3)溶液的物质的量浓度是个定值,不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。










