
将番茄种子(S. lycopersicum Mill. Cv. Zuanhongmeina,对 ToCV 和 B. tabaci 无抗性)播种在带有营养基质的塑料育苗盘(53 × 27.5 × 4.5 cm)中,并种植在防虫笼中温室(26±1°C,RH70%±5%,光周期L//D = 16 h//8 h)在湖南植物保护研究所六楼,不接触任何农药和昆虫。将幼苗移植到直径为10 cm的盆中,直到它们长出2-3片真叶。本实验所用粉虱为粉虱MED,由中国农业科学院蔬菜花卉研究所张友军博士课题组介绍。我们研究中使用的所有烟粉虱均不含病毒。
ToCV感染性cDNA克隆由周涛教授(中国农业大学)提供。 ToCV 感染的番茄植株的制备按所述进行 (Zhao et al., 2016)。首先,将含有 RNA1 (pCa-ToCR1) 和 RNA2 (pCa-ToCR2) 的质粒分别置于两种含有 50 mg/mL 卡那霉素和 50 mg/mL 利福平的 YEP 液体培养基中。 28℃培养过夜后,得到含有ToCV-RNA1和ToCV-RNA2的细菌。收集菌液并离心后,制备的悬浮液(包括10 mM MES、10 mM MgCl2和200 mM乙酰丁香酮)用于重悬沉淀的细菌,并进一步稀释至OD600 = 1.0。 pCa-ToCR1 和 pCa-ToCR2 的农杆菌悬浮液以 1:1 的体积比混合。然后,将 0.5 mL ToCV 感染性 cDNA 农杆菌克隆注射到三真叶期番茄植株中。进行了视觉(叶片萎黄)和分子(RT-PCR)检查以确认病毒感染(Shi et al., 2018)。由于接种效率低(约 10%),为了获得足够的 ToCV 感染的番茄植株,进行了大量重复。
番茄植物被分成四组。第一组为对照组,正常生长40天。在第二组中,每株番茄植株(40 天大)由 300 只烟粉虱成虫(无病毒)觅食 24 小时。第三组番茄植株接种 ToCV 40 天。在第四组中,每株番茄植株感染 ToCV 40 天,并由 300 只烟粉虱成虫(无病毒)觅食 24 小时。烟粉虱成虫采食植株24 h后,在抽吸设备中通过气流将粉虱全部清除,这样叶组织不会被接触和损坏。同时,对伪造的番茄叶片进行采样,并对第一组和第三组的植株进行采样。四组样品分别命名为H、HQ、V和VQ。每个处理有 6 株番茄植株,具有 3 个生物学重复。总共有 12 个番茄叶样品用于后续的实验和分析。 ToCV 特异性 RT-qPCR 引物的详细序列信息在补充表 12 中给出。
Quantification of Plant Endogenous Hormone and Analysis of Antioxidant Enzyme Activities植物内源激素定量及抗氧化酶活性分析0 天龄的番茄植株被无病毒的烟粉虱侵染并且没有饲喂烟粉虱,用于定量植物内源激素,用量为 1 g/株。在0、12、24、36和72 h的饲养时间后,去除夹笼和里面的粉虱,并收集相应的叶子。
全株接受相同处理,每个处理3次重复。
番茄叶用 10 毫升异丙醇/盐酸研磨,并在 4°C 下摇动 30 分钟(You 等人,2016 年)。然后,加入20mL二氯甲烷。将混合物在 4°C 下振摇 30 分钟,然后在 13,000 rpm、4°C 下离心 5 分钟。分离有机部分,然后在氮气下在黑暗中干燥。将固体残留物重新悬浮在 400 μL 甲醇/0.1% 甲酸中。样品在 HPLC-MS/MS 分析前用 0.22 μm 滤膜过滤。使用 poroshell 120 SB-C18(安捷伦,美国)色谱柱(150 mm × 2.1 mm × 2.7 μm)进行 HPLC 分析。流动相 A 溶剂由甲醇 0.1% 甲酸组成,流动相 B 溶剂由超纯水 0.1% 甲酸组成。进样量为 2 μL。 MS条件如下:喷雾电压为4500V;气幕、雾化器和辅助气体的压力分别为 15、65 和 70 psi;雾化温度为400℃。
抗氧化酶活性的检测分别采用过氧化氢酶活性检测试剂盒(Solarbio,北京,中国)、过氧化物酶活性检测试剂盒(Solarbio,北京,中国)和 SOD 活性检测试剂盒(Solarbio,北京,中国)根据制造商的说明进行检测。
结果:RT-qPCR 用于检测和量化番茄植株在 10 至 50 天不同时间点的 ToCV 积累。 如图 1A 所示,病毒滴度从 10 天到 45 天持续增长,从 30 天到 40 天迅速增加,在 45 天达到峰值。 45天后,病毒滴度保持在相对稳定的水平。 值得注意的是,我们发现病毒的积累在 40 天时增长最快。 这可能意味着植物和病毒之间的相互作用在那个时间点是最强烈和最复杂的。 因此,为了获得更多番茄植株与 ToCV 相互作用的分子机制,将每个处理 40 天的样本用于 RNA-Seq 和 qRT-PCR 分析。
分析了烟粉虱取食的番茄植株内源激素和抗氧化酶活性的变化。 与对照组相比,治疗组的 JA 滴度降低,SA 滴度增加(图 1B、C)。 并且差异在 24 小时时最大。 然后,我们检测了该时间点番茄植株的抗氧化酶活性。 与对照相比,过氧化氢酶 (CAT)、过氧化物酶 (POD) 和超氧化物歧化酶 (SOD) 的活性均增加(图 1D-F)。 为了探索番茄植株与烟粉虱相互作用的分子机制,将来自烟粉虱 24 小时饲养的番茄植株样品用于 RNA-Seq。
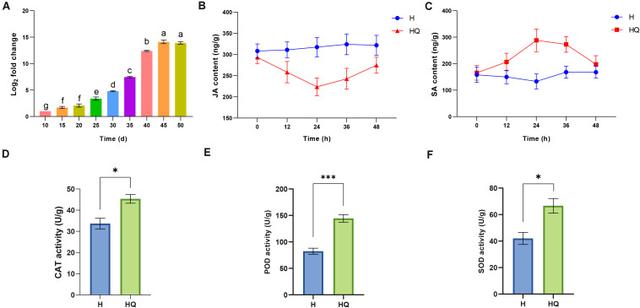
图 1 番茄黄化病毒 (ToCV) 含量、植物激素和抗氧化酶活性的测定。 (A) 不同时间点番茄植株中番茄萎黄病病毒的积累。 (B,C) 对照组和治疗组的 JA 和 SA 含量。 (D-F) 对照组和治疗组中 CAT、PDO 和 SOD 的含量。 值是平均值 ± SE。 对于每次,不同字母和星号的均值差异显着(P < 0.05)。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。
RNA Extraction, Library Preparation, and Sequencing根据制造商的说明(Invitrogen, Carlsbad, CA, United States),使用 TRIzol® Up 从 12 个番茄叶样品中提取总 RNA。使用 DNase I RNase-free (TaKara, Beijing, China) 去除基因组 DNA。在 1% 琼脂糖凝胶上监测 RNA 降解和污染。使用 ND-2000 (Thermo Fisher Scientific, Beijing, China) 测量 RNA 浓度。最后,使用 2100 生物分析仪(Agilent Technologies, Santa Clara, CA, United States)评估 RNA 完整性。 RNA-seq 转录组文库是按照来自 Illumina(美国加利福尼亚州圣地亚哥)的 TruSeqTM RNA 样品制备试剂盒使用 1 μg 总 RNA 制备的。不久,根据 polyA 选择方法通过 oligo(dT) 珠分离 mRNA,然后通过片段化缓冲液进行片段化。使用 SuperScript 双链 cDNA 合成试剂盒(Invitrogen,Carlsbad,CA,美国)和随机六聚体引物(Illumina)合成双链 cDNA。然后,根据Illumina的文库构建方案对合成的cDNA进行末端修复、磷酸化和“A”碱基添加。在 2% 低范围超琼脂糖上选择 300 bp cDNA 目标片段的文库大小,然后使用 Phusion DNA 聚合酶 (NEB) 进行 PCR 扩增 15 个 PCR 循环。经TBS380定量后,双端RNA-seq测序文库用Illumina HiSeq X 10/NovaSeq 6000测序仪(2×150 bp读长)测序。
Library Preparation for Small RNA Sequencing来自 12 个番茄叶样品的每个样品的总量为 3 μg 总 RNA 作为小 RNA 文库的输入材料。使用 NEBNext® Multiplex Small RNA Library Prep Set for Illumina®(NEB,美国)按照制造商的建议生成测序文库,并将索引代码添加到每个样本的属性序列中。 NEB 3' SR 接头直接特异性地连接到 miRNA、siRNA 和 piRNA 的 3' 末端。 3' 连接反应后,SR RT 引物与过量的 3' SR 接头杂交,3' 连接反应后仍保持游离状态,将单链 DNA 接头转化为双链 DNA 分子。这一步对于防止接头二聚体形成很重要,此外,dsDNA 不是 T4 RNA 连接酶 1 介导的连接底物,因此在随后的连接步骤中不会连接到 5' SR 接头。 5'端接头连接到miRNAs、siRNAs和piRNAs的5'端。然后,使用 M-MuLV 逆转录酶 (RNase H–) 合成第一链 cDNA。使用 LongAmp Taq 2x Master Mix、用于 Illumina 的 SR 引物和索引 (X) 引物进行 PCR 扩增。 PCR 产物在 8% 聚丙烯酰胺凝胶上纯化(100 V,80 分钟)。回收对应于 140–160 bp(小非编码 RNA 的长度,加上 3' 和 5' 接头)的 DNA 片段并溶解在 8 μL 洗脱缓冲液中。使用 DNA 高灵敏度芯片在 Agilent Bioanalyzer 2100 系统上评估文库质量。簇生成后,文库制备物在 Illumina Hiseq 2500/2000 平台上进行测序,并生成 75 bp 单端读数。
Read Mapping原始读数由 SeqPrep 和 Sickle 使用默认参数进行修剪和质量控制。 然后使用 HISAT2 (Kim et al., 2015) 软件以定向模式将干净读数分别与 S. lycopersicum 参考基因组序列 (SL3.0) 对齐。 每个样本的映射读取由 StringTie 以基于参考的方法组装(Pertea 等,2015).
结果:番茄植物转录组数据概述
为了揭示烟粉虱和 ToCV 处理下番茄植株的分子调控,我们进行了高通量测序。完成了 12 个样本的转录组分析,总共获得了 86.56 Gb 的干净数据(补充表 1)。每个样本的干净数据达到 6.29 Gb 或更多。 Q20 和 Q30 的基数百分比分别超过 98.76% 和 95.83%。本次分析共检测到29,010个表达基因,包括26,512个已知基因和2,498个新基因,以及总共45,887个表达转录本,其中25,484个已知转录本和20,403个新转录本。与对照组相比,在烟粉虱和ToCV的作用下,番茄植株转录本丰度发生显着变化(图2A和补充表2),样本间相关性分析表明,生物重复之间存在高度相关性,表明测序结果可靠(图 2B)。同时,计算不同处理组和对照组之间差异基因的表达(图2C)。维恩图显示了每组比较之间常见和独特的 DEG 数量(图 2D)。

图2 不同处理下番茄植株的全基因表达谱及主成分分析。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。 (A) 不同处理下番茄植株全局基因表达的密度图。 (B) 不同处理下番茄植株样品的相似程度。 (C) 上调和下调差异表达基因 (DEG)。 (D) DEG 的维恩图。
Differential Expression Analysis and Functional Enrichment为了识别两个不同样本之间的 DEG,根据每百万读数的转录本 (TPM) 方法计算每个转录本的表达水平。 RSEM (Li and Dewey, 2011) 用于量化基因丰度。 本质上,差异表达分析是使用 DESeq2 (Love et al., 2014)/DEGseq (Wang et al., 2010) 和 EdgeR (Robinson et al., 2010) 进行的,Q 值≤ 0.05。 DEGs 与 | log2FC| > 1 和 Q 值≤ 0.05 (DESeq2) 被认为是重要的 DEG。 显着差异表达的 miRNAs 被提取 | log2FC| > 1 和 FDR < 0.05 通过 DEseq2。 此外,进行了包括 GO 和 KEGG 在内的功能富集分析,以确定与全转录组背景相比,在 Bonferroni 校正的 P 值≤ 0.05 时,哪些 DEG 在 GO 术语和代谢途径中显着富集。 GO 功能富集和 KEGG 通路分析由 Goatools 和 KOBAS 进行(Xie 等,2011)。
结果:不同处理下差异表达基因的鉴定
基因本体 (GO) 图显示了 10 个最丰富的 GO 术语和每个术语的前十个基因。
在 H_vs_HQ 中,最重要的 GO 术语是光收集、光系统 I 中的光收集、光合作用、对辐射的反应、木葡聚糖代谢过程、蛋白质-生色团连接、对光刺激的反应、对非生物刺激的反应、前体代谢物的产生和能量和氧化还原过程(图 3A)。
在H_vs_V中,最重要的GO术语是碳水化合物代谢过程、多糖代谢过程、氧化还原过程、脂质代谢过程、半纤维素代谢过程、细胞碳水化合物代谢过程、多糖分解代谢过程、细胞壁大分子代谢过程、防御反应和木葡聚糖代谢过程(图 3B)。
在 H_vs_VQ 中,10 个最重要的 GO 术语是碳水化合物代谢过程、脂质代谢过程、氧化还原过程、多糖代谢过程、半纤维素代谢过程、多糖分解代谢过程,以及激素水平的调节、激素代谢过程、碳水化合物分解代谢过程、激素生物合成过程和防御反应(图 3C)。
为了更好地了解番茄植株常见抗逆基因的生物学功能,进行了京都基因和基因组百科全书(KEGG)的富集。
在H_vs_HQ中,上调的DEGs主要富集在光合作用途径-天线蛋白(图4A)中,其富集程度远大于其他途径。
我们发现该途径包括许多编码叶绿素 a-b 结合蛋白的 DEG,并且所有这些基因都被上调(补充表 2)。先前的研究已经证明了叶绿素 a-b 结合蛋白在光合作用中的作用(Klimmek 等,2006)。这表明烟粉虱可以诱导番茄植株的光合作用增强。
下调的 DEG 主要富集在磷酸戊糖途径和类黄酮生物合成途径中(图 4A)。然而,在ToCV参与的两组数据中,上调的DEGs主要富集在植物-病原体相互作用通路和MAPK信号通路-植物中(图4B、C)。
下调的 DEG 主要富含乙醛酸和二羧酸盐代谢以及光合生物中的碳固定(图 4B、C)。该数据表明ToCV诱导番茄植物防御途径相关基因的高表达。

图 3 前 10 个基因本体 (GO) 术语的和弦图。 (A) H_vs_HQ。 (B) H_vs_V。 (C) H_vs_VQ。 和弦显示了差异表达基因 (DEG)(左半圆)的 log2 倍变化(log2FC)与其富集的 GO 项(右半圆)之间的详细关系。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。

图 5 ToCV 和烟粉虱分别对番茄的影响。 (A,B) 差异表达的 mRNA 的维恩图。 (C) HQ_vs_VQ 和 H_vs_V 中常见差异基因的 KEGG 富集分析。 (D) V_vs_VQ 和 H_vs_HQ 中常见差异基因的 KEGG 富集分析。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。
Integrated Analysis of miRNA and mRNA Expression ProfilesmiRNA-mRNA对是通过miRNAs的靶基因预测结果和DEGs的生物学功能分析来确定的。 然后,通过STRING数据库获得蛋白质相互作用网络关系后,在Python下使用networkX展示miRNA和mRNA表达谱的网络。
Determination of Chlorophyll and Nitrogen ContentOK-Y104叶绿素仪(欧科奇,中国)用于测量不同处理和对照组番茄叶片。 每株番茄植株上、中、下叶各测3次,防止测量误差
结果:与植物防御反应相关的 DEG 分析
与健康植株相比,番茄植株防御反应相关基因在不同处理下均被激活。其中,植物病原互作、MAPK信号通路等典型抗病通路基因高度差异表达。例如,WRKY和CML基因的表达可以激活植物的防御反应,9个WRKY(2个上调和7个下调)、17个WRKY(12个上调和5个下调)和28个的差异表达。分别在 HQ、V 和 VQ 中检测到 WRKY(20 个上调和 8 个下调)基因(补充表 3)。在 HQ、V 和 VQ 中检测到 7 个 CML(5 个上调和 2 个下调)、6 个 CML(3 个上调和 3 个下调)和 12 个 CML(9 个上调和 3 个下调)基因,分别(补充表3)。这表明番茄植物的防御途径被激活以对抗烟粉虱和 ToCV。
值得注意的是,检测到 ID 为 solyc05g055745.1(在 HQ、V 和 VQ 中下调)和 solyc08g062490.3(在 HQ 中下调,在 V 和 VQ 中上调)的基因在所有比较中均受到差异调节(补充表3)。在ToCV感染的番茄植株组中,H_vs_V和H_vs_VQ之间有16个DEG重叠。其中,ID 为 solyc08g062490.3 和 solyc06g048870.2 的基因上调超过 10 倍,表明它们可能在番茄植物对 ToCV 抗性的途径中起关键作用(补充表 3)。此外,我们注意到许多在 HQ 和 V 处理中未被激活的 WRKY 转录本记录在 VQ 中。其中,ID 为 solyc05g015850.3 和 solyc08g008273.1 的基因分别显示出上调和下调基因之间差异的最高倍数变化(补充表 3)。这些基因可能仅在存在以受病毒感染的植物为食的粉虱存在时才被激活。这样的转录本可以提供更多与病毒-载体相互作用相关的新信息。
结果 与光合作用相关的 DEG 分析
共鉴定出 56 个与光合作用相关的 DEG。 通过对DEGs表达模式的聚类分析,结果表明病毒处理后番茄植株光合作用相关基因显着下调(图6A)。 这表明病毒感染可以强烈抑制番茄植株的光合途径。 同时,光合作用 - 天线蛋白是我们数据中最丰富的途径。 其中,所有 DEG 在 H_vs_HQ 中均上调,而六个基因分别在 H_vs_VQ 和 H_vs_V 中显着下调(补充表 4)。 测定了不同处理下番茄叶片的叶绿素和氮含量(图6B、C),结果表明,与健康叶片相比,各处理组两者的含量均有所降低。

图 6 不同处理对番茄植株光合作用的影响。 (A) 不同处理下番茄植株中差异表达的光合作用基因。 (B) 不同处理下番茄植株的叶绿素含量。 (C) 不同处理下番茄植株叶片的氮含量。 对于每个样本,不同字母的均值差异显着(P < 0.05)。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。
结果:DEG 的全局代谢途径
iPath3.01用于可视化分析代谢途径,查看整个生物系统的代谢途径信息(Darzi et al., 2018)。 如图 7 所示,大多数 DEG 被注释为碳水化合物代谢、能量代谢、氨基酸代谢和脂质代谢。 其中,糖类代谢中各种糖类的代谢和合成途径均显着富集,说明烟粉虱和ToCV处理显着影响番茄植株的能量代谢。

图 7 健康番茄植株 (H) 与不同处理下 (V、VQ 和 HQ) 番茄植株之间 DEG 代谢途径的概述。 红线代表由 DEG 注释的通路。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。
结果:全球miRNA表达模式
总共对 12 个样本进行了测序,获得了总共 141.72 M 的原始读数。采用统计方法计算所有测序reads每个循环的碱基分布和质量波动,可以从宏观上直观地反映样品的测序质量和建库质量。对每个样品的原始测序数据进行测序相关质量评估。每个样本的原始读数达到 10.27 M 或更高,Q30 碱基百分比为 89.98% 或更高。然后,将每个样本的干净读数与番茄参考基因组序列(SL3.0)进行比对,比对的读数数量从 6556042 到 9737059(补充表 5)。表达分布图从整体上反映了每个样本中miRNA的表达模式。 Sly-miR159、sly-miR9471b-3p 和 sly-miR162 是每个样品中表达最多的 miRNA(图 8A 和补充表 13)。
不同处理组之间差异表达的 miRNA 的鉴定是在 p 值 < 0.05 和 | 的基础上进行的。 log2(倍数变化)| > 1. 通过分析基于其表达的火山图,确定了包含 242 个 miRNA 的四个差异表达簇。 在 H_vs_HQ 中,有 9 个上调和 14 个下调的 miRNA(图 8B)。 在 H_vs_V 中,62 个 miRNA 的表达增加,88 个 miRNA 的表达降低(图 8B),而在 H_vs_VQ 中,有 92 个上调和 101 个下调的 miRNA(图 8B)。 维恩图显示了每组比较之间常见和独特的差异表达 miRNA 的数量(图 8C)。 该数据表明,在烟粉虱和 ToCV 的不同处理下,番茄植物具有不同的 miRNA 调控特征,并且当烟粉虱取食时 miRNA 变化很小。

图 8 不同处理下差异表达的 miRNA 的表达谱。 (A) 每个样本中最高表达的 miRNA。 (B) 上调和下调差异表达的 miRNA。 (C) 差异表达 miRNA 的维恩图。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。
结果:miRNA 潜在靶标 mRNA 的预测和功能鉴定
使用在线软件 psRobot 预测这些 miRNA 的靶标。根据靶基因预测,242个miRNA有1078个靶基因。然后,进行 GO 和 KEGG 功能富集以探索这 1078 个候选靶基因的分布和潜在的生物学功能(补充表 6)。
对于GO分析,上调miRNA对应的靶基因富集于对病毒防御反应的调节和免疫效应过程的调节,而下调的靶基因富集于ADP结合和UDP-N-乙酰氨基葡萄糖生物合成。 H_vs_HQ 中的过程(补充表 7)。在 H_vs_V 中,与上调 miRNA 对应的靶基因在寡肽转运和肽转运中富集,而与下调 miRNA 对应的目标基因在 ADP 结合和染色质结合中富集(补充表 7)。然而,对应于上调 miRNA 的靶基因在 H_vs_VQ 中的木质素分解代谢过程和苯丙烷类分解代谢过程中富集(补充表 7),而对应于下调 miRNA 的目标基因在染色质结合和 UDP-葡萄糖醛酸脱羧酶活性中富集(补充表 7)。
对于 KEGG 分析,病毒感染下番茄植物中上调 miRNA 的靶点在各种类型的 N-聚糖生物合成、ABC 转运蛋白和基础转录因子等途径中富集(补充表 8)。下调的miRNA的靶点在物质代谢过程的途径中富集。类似地,下调的 miRNA 在 H_vs_VQ 的葡萄糖代谢途径中富集(补充表 8)。上调miRNA的靶标富含赖氨酸降解、花生四烯酸代谢以及泛酸和辅酶A生物合成等(补充表8)。然而,在 H_vs_HQ 中,上调 miRNA 的靶点在 DNA 复制和坏死性凋亡中富集(补充表 8)。下调的 miRNA 富含嘌呤代谢、RNA 聚合酶和嘧啶代谢等(补充表 8)。
结果:Small RNA-Seq 和 mRNA-Seq 的联合分析
我们对烟粉虱和 ToCV 共同处理的番茄植株中 miRNA 和 mRNA 的差异表达进行了进一步分析。在 miRNA 靶标和常见 DEG 的维恩图谱的基础上,总共鉴定了 60 个下调和 19 个上调的 mRNA(图 9A)。根据丰富的 KEGG 途径和功能丰富的 GO 术语对这些共同目标进行了联合分析。烟粉虱和 ToCV 处理过程中高表达的靶基因富集了与植物形态发育和氨基酸代谢过程相关的典型 GO 术语和途径,如发育过程、简单的叶片形态发生、叶维管组织模式形成、脂肪酸降解、α-亚麻酸代谢以及氨基糖和核苷酸糖代谢(补充表 9、10)。相比之下,低表达的靶基因富含典型的与代谢、信号转导和氨基酸代谢相关的GO术语和通路,如木质素代谢和分解代谢过程、苯丙素代谢和分解代谢过程、磷脂酰肌醇信号系统、MAPK信号通路-酵母和脂肪酸伸长率(补充表 9、10)。构建了常见的上调和下调 miRNA 与靶 mRNA 的相互作用网络(补充表 11)。选择了参与抗病性的 miRNA-mRNA 对并显示在图 9B 中。其中,基因 solyc02g070393.1、solyc02g084890.2、solyc08g013970.2 和 solyc08g007250.2 与多个靶基因相互作用,表明它们可能在介导植物抗病途径中发挥重要作用。

图 9 差异表达基因和差异表达 miRNA 的联合分析。 (A) 预测的 miRNA 靶标 mRNA 和不同处理下番茄植株中具有相同表达趋势的差异表达 mRNA 的维恩分析。 左图显示常见的高表达 mRNA,右图显示常见的低表达 mRNA。 (B) 常见上调和下调 miRNA 与靶标 mRNA 的相互作用网络。 H,健康的番茄植株。 HQ,番茄植株由健康的烟粉虱喂养 24 小时。 V,用ToCV接种番茄植株。 VQ,由健康烟粉虱喂养 24 小时的具有 ToCV 的番茄植株。
qRT-PCR Validation为了验证 RNA-Seq 的结果,随机选择 DEG 进行 qRT-PCR 验证。 如上所述进行总RNA提取和基因组DNA去除。 使用 HiScript® 1st Strand cDNA Synthesis kit (Vazyme, China) 从 1 μg RNA 合成 mRNA 的第一链 cDNA。 使用miRNA 1st strand cDNA synthesis kit (by stem-loop) (Vazyme, China)根据制造商的说明合成 miRNA 的第一链 cDNA。 qRT-PCR 使用 LightCycler® 96 Real-Time PCR System(Roche,Basel,Switzerland)进行,目标基因的相对表达水平使用 2-ΔΔCt 方法计算。 番茄Actin和 UBI 被选为内参(补充表 12)。
通过 qRT-PCR 验证测序数据
为了验证 RNA-Seq 数据,选择了 9 个 mRNA 和 8 个 miRNA 用于 qRT-PCR。 引物序列中的引物用于 qRT-PCR(补充表 12)。 通过 qRT-PCR 获得的每个选定基因的表达数据与 RNA-Seq 结果一致,表明转录组和 qRT-PCR 数据集之间的趋势相似(图 10A、B)

图 10 qRT-PCR 验证了转录组测序的质量。 (A) 随机 mRNA 的相对表达水平和小 RNA 测序结果。 (B) 随机 miRNA 的相对表达水平和小 RNA 测序结果。
Data AnalysisIBM SPSS Statistics 21(SPSS Inc., Chicago, IL, United States)用于统计分析。 进行单向方差分析以比较不同时间点番茄植株中 ToCV 的积累、不同处理下番茄植株叶片的叶绿素含量和氮含量。
,




