近日,威康桑格研究所的Iñigo Martincorena和Joanna Fowler团队时隔3年,又在《科学》杂志上发表了一篇让世人震惊的研究。
他们从9名捐献者的健康食管组织中获得了出人意料的发现。在这9名志愿者健康的食管组织中,他们发现了大量的癌症相关基因变异,而且这些细胞携带的基因突变的数量,明显随着年龄增长而增多。
例如,20岁时平均每个细胞携带300个突变左右,到了七八十岁,则有超过2000个突变,而吸烟的人的突变数量远远则高于同龄人(简直突变花了,见下图)。这项研究发表在Science上[1]。科学家还做了个初步的统计,发现人到中年之后,竟然有一半以上的食管细胞有癌症相关突变。

左,38岁左右,不吸烟;中,45岁左右,重度吸烟;右,75岁左右,不吸烟
每个圆代表一个突变,圆的大小代表这个突变的频率。
不难看出,45岁左右吸烟人的食管已经突变的跟75岁的老人有的一拼了
难怪癌症会年轻化。
我们都知道癌症是一种基因突变导致的慢性病,绝大多数癌症的发生都需要足够长的时间,积累出足够多的基因突变。所以,老年人的癌症发病率远远高于年轻人。
进入现代工业社会之后,由于环境、生活、饮食的变化,加速了细胞的突变积累速度,所以很多癌症开始年轻化。
不过,对于正常的组织究竟如何积累基因变异,最终进化成肿瘤组织,科学家还不是很清楚。

2015年,Iñigo Martincorena等人就在眼睑的皮肤中就做过类似的研究[2],当时他们发现每个细胞中,平均每百万个碱基对里,就有2~6个突变。大约有1/4的皮肤细胞携带了致癌突变,而每平方厘米的皮肤里,有数百个进化中的克隆相互竞争。
眼睑的皮肤经常暴露在阳光下,经常受到紫外线的照射,不能代表全身的突变水平。那么在没有阳光照射的地方,体细胞中会携带多少突变呢?研究人员把目光转向了食道的上皮组织。
研究人员对来自9位捐献者的844个正常食道小样进行了深度测序。这些捐献者年龄从20岁到75岁不等,都没有胃食管反流等食道慢性疾病病史,其中4人有吸烟史。每个样品大约2平方毫米,这些样品和样品周围的组织,在显微镜下都看不出异常。

激光共聚焦显微镜下的样品周围组织,箭头指示被取走的样品
在这总共大约17平方厘米的组织样品中,研究人员总共发现了8919个突变。把位置相邻的样品中的相同突变合并后,还剩下6935突变被认为是独立发生的。
通过突变的等位基因频率,研究人员估算了不同个体中,平均每个细胞携带的突变数量。在20岁的捐献者的食道中,平均每个细胞携带了数百个突变,而老年捐献者中,平均每个食道上皮细胞携带的突变数超过了2000个。而两个重度吸烟者都有比同龄人更高的突变频率。

不同年龄的样品中的基因突变数量
第4个和第7个人重度吸烟
不过相比皮肤,中年人的食道中,平均每个细胞携带的突变数量要少了10倍,不过其中跟肿瘤相关的突变却比皮肤还要多。总突变少了,肿瘤相关的突变却更多了,莫非这些肿瘤相关的突变给了食道上皮细胞有更强的竞争能力,让它们能长成更大的克隆?为了验证这一猜想,研究人员使用非同义突变和同义突变的比例评价了这些突变的选择作用。
在食道组织中,研究人员发现了14个有明显阳性选择作用的基因突变,其中有跟细胞分化、增殖、凋亡有关的Notch家族[3],有影响DNA损伤修复的TP53[4],有跟细胞氧化应激有关的CUL3等[5],还有跟表观遗传有关的KMT2D[6]。
而且这14个阳性选择基因中,有11个的被认为和食管鳞癌的发生有关[7]。特别是Notch1,平均每平方厘米的食道上皮中,就有大约120个不同的Notch1突变。以往认为正常的Notch1可以阻碍鳞癌的发生[8],这次的研究中也发现Notch1的截止突变(会严重弱化或破坏蛋白功能)确实有利于细胞增殖抢占空间。
Notch1突变了细胞就开始疯长,那接下来就该癌变了吧。

Notch1结构
事情没那么简单。按理来说,如果一个基因的突变会致癌,那肿瘤组织里这个基因的突变就该比正常组织里多。像TP53,90%以上的食道鳞癌细胞都携带它的突变,而在9个捐献者的正常食道上皮中,携带TP53突变的细胞平均只有10%,在年龄最大的捐献者中也不过20~35%。
但到了Notch1这,意外却发生了。虽然Notch1突变阳性选择作用很强,但食道鳞癌里的Notch1突变反倒比正常组织里少!
10%左右的食道鳞癌中存在Notch1突变,这个比例确实不低了,也因此被认为是食道癌的一个驱动基因。不过这次试验6个40岁以上(食道癌高发年龄)的捐献者中,有5个的Notch1突变频率在30~80%之间,比肿瘤里的还要多。
这个现象是研究人员没有料到的,也与当前的认知相悖。这样看来Notch1通路与食管癌之间的关系没那么简单。这个发现也提醒我们,是不是在其他的癌种中也存在类似的现象。只能说,我们对癌症的认知还非常有限。

不同年龄的志愿者中,TP53和Notch1的突变频率。
灰色范围是食管鳞癌中的突变频率。
不过食道中这么多的突变是哪来的呢?接下来,研究人员又分析了突变的模式,从中可以对导致突变的原因略窥一二。比如皮肤中就经常有CC→TT的突变,就是紫外线辐射产生的[9]。
在这些正常的食道上皮中,最常见的突变类型是C→T的突变,而且主要发生在经常被甲基化的CpG中的C上。这种突变是胞嘧啶的自发脱氨基造成的,是衰老的一个反映,还真是岁月不饶人。
在食道癌细胞中同样有大量C→T的突变,但与正常组织中发生的位置不同,主要发生在TCA、TCT这样的序列上,是胞嘧啶脱氨酶APOBEC造成的[10]。APOBEC本来是人体抵抗逆转录病毒的,但在肿瘤中,APOBEC的表达异常增多,让基因组DNA也发生了突变,这也是肿瘤异质性的一个主要来源[11]。而在这9个捐献者的正常食道上皮中,没有发现APOBEC造成的突变,或许APOBEC要到临近肿瘤发生时才起作用。
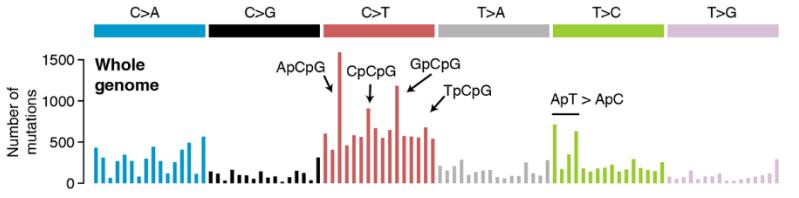
不同类型突变的频率
这些正常的食道上皮中还有不少C→A的突变,这种突变可以由吸烟引起,也可以由其它很多因素造成。不过虽然这9位捐献者中有4位吸烟,在其中2位重度吸烟者中也观察到了更高的突变频率,但却没有发现明显是由烟草产生的突变,可能是因为烟草的诱变特征是在肺中统计得出的,跟食道的情况有一定差别。
无论是正常组织中比肿瘤还多的Notch1突变,还是吸烟者中符合烟草诱导特征的突变的缺失,都反映着我们对正常组织中,体细胞的突变和进化知之甚少。而对正常组织中体细胞的突变和选择的理解,也将有助于我们深入了解癌症的起源和衰老的过程。
“作为癌症研究人员,我们不能低估研究健康组织的重要性。”英国癌症研究中心的首席科学家Karen Vousden教授评论,“这项研究表明,一些与癌症有关的基因变化在正常细胞中惊人地大量存在。要完全理解这些新发现的含义,我们还有很长的路要走,但我们希望这样的研究有一天能帮助我们开发有针对性的诊断测试。”
编辑神叨叨
1985年人类基因组计划提出时,人们天真的以为只要测出基因组DNA的序列,就能完全理解生命的过程。可是到了2018年,人类基因组草图的绘制工作已经完成了18年,对于基因功能的认识依然只是冰山一角。
想全面系统地了解有关肿瘤的知识吗?不管你是医生、科研工作者,还是刚进入这个领域的医学生,下面这本关于癌症的巨著——《癌生物学》都是最佳的选择,它可能为你打开一扇绚烂的科学之窗。
参考文献:
1. Martincorena I, Fowler J C, Wabik A, et al. Somatic mutant clones colonize the human esophagus with age[J]. Science, 2018: eaau3879.
2. Iñigo Martincorena, Amit Roshan, Moritz Gerstung, et al. High burden and pervasive positive selection of somatic mutations in normal human skin[J]. Science, 2015, 348(6237):880-886.
3. 10.1016/j.ceb.2018.06.010
4. Williams A B, Schumacher B. p53 in the DNA-Damage-Repair Process[J]. Cold Spring Harbor Perspectives in Medicine, 2016, 6(5).
5. Kobayashi A, Kang M I, Okawa H, et al. Oxidative stress sensor Keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2.[J]. Molecular & Cellular Biology, 2004, 24(16):7130-9.
6. Hopkin A S, Gordon W, Klein R H, et al. GRHL3/GET1 and Trithorax Group Members Collaborate to Activate the Epidermal Progenitor Differentiation Program[J]. Plos Genetics, 2012, 8(7):e1002829-e1002829.
7. Zhang L, Zhou Y, Cheng C, et al. Genomic Analyses Reveal Mutational Signatures and Frequently Altered Genes in Esophageal Squamous Cell Carcinoma[J]. American Journal of Human Genetics, 2015, 96(4):597-611.
8. Nowell C S, Radtke F. Notch as a tumour suppressor[J]. Nature Reviews Cancer, 2017, 17(3):145-159.
9. Nik-Zainal S, Alexandrov L B, Wedge D C, et al. Mutational processes molding the genomes of 21 breast cancers[J]. Cell, 2012, 149(5): 979-993.
10. Jarvis M C, Ebrahimi D, Temiz N A, et al. Mutation Signatures Including APOBEC in Cancer Cell Lines[J]. JNCI cancer spectrum, 2018, 2(1): pky002.
11. Swanton C, McGranahan N, Starrett G J, et al. APOBEC enzymes: mutagenic fuel for cancer evolution and heterogeneity[J]. Cancer discovery, 2015.

奇点:50万极客医生热爱的医疗科技媒体

本文作者 | 孔劭凡 & BioTalker
“路漫漫其修远兮,我将上下而求索”
,




