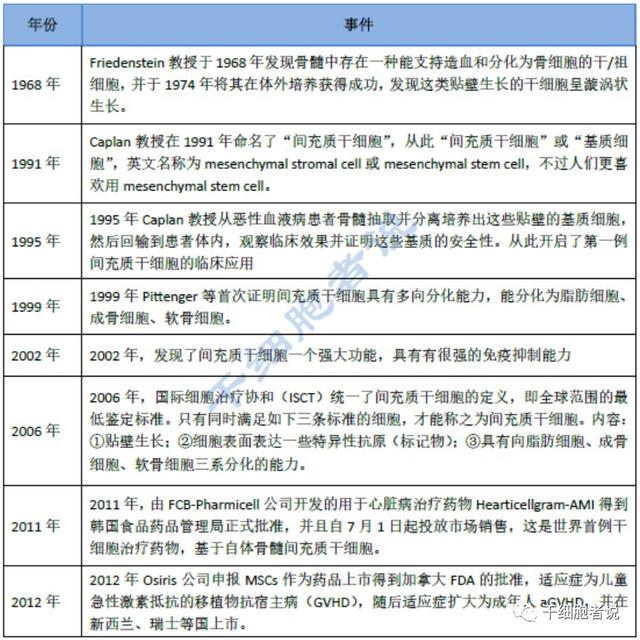
编者按
我国直肠癌发病年龄中位数在45岁左右,青年人发病率有升高的趋势。直肠癌危险度高,如何能更好优化直肠癌的临床治疗是临床实践中面临的难题。北京大学肿瘤医院武爱文教授的团队在直肠病区综合治疗方面积累了丰富经验。本期《医悦汇》特邀武爱文教授担任组稿专家组织团队医生综述解读直肠癌等待观察疗法中的误区、争议和展望等临床综合治疗经验和研究进展,以供临床同行参考!
武爱文教授力荐:《浅谈直肠癌等待观察疗法中的误区、争议和展望》
本文作者:王林 北京大学肿瘤医院
执行主编及作者简介


正文如下
一、 现状和国内共识
等待观察策略(Watch & Waitstrategy,WW)是直肠癌新辅助放化疗(NCRT)后发生临床完全缓解(cCR)的一种治疗选择。如成功实施,则能最大限度保留患者直肠器官和反射弧,避免手术创伤和并发症风险,以及后续的功能损害(如前切除综合征)。发生cCR患者的整体预后,与NCRT后病理完全缓解(pathologicalCR/pCR)无差别。局部再生率(20%-25%)和观察期转移率(8%)都颇为稳定,这些特性使WW策略有很好的临床实用性,确保患者的肿瘤学安全性,并利于知情同意和风险预测。[1,2]
患者通过WW疗法的获益是不言而喻的:具备一定直肠癌手术量的医生都会遇到低位“保肛”后因为功能问题重新造口的患者,所谓“极限保肛”从手术技术上讲并不复杂,只不过不同外科医生对局部复发及术后患者的生活质量的预期有差异,且根治术后仍有患者出现远处转移,即便ypCR的患者亦是如此。因此,从外科角度质疑WW疗法影响患者“根治率”毫无根据。cCR诊断需要结合疗后T2/DWIMRI、内镜表现、指诊和血清学CEA等综合判断,常用的诊断标准有MSKCC 标准和巴西Sao Paulo 标准,其本质是近似的多学科联合诊断。[3,4]
最常被我国临床医生忽略的是自然病程的意义:时间是最重要的判断因素,即使是near-cCR 的病例,如果随访3年以上无任何进展,即可大概率印证其为“真pCR”。对cCR的随访频率在各中心存在差异,但基本原则都是“前紧后松”,因为发生局部再生或转移的高峰期为cCR后2-3年,在这个期间后通常每年复查一次即可。目前为了实践WW策略,需要产生足够多的cCR病例。在全程新辅助治疗(TNT)时代,对很多早期、低危直肠癌实施TNT可达到相当高的cCR率为普及WW疗法带来诸多希望。[5,6]
在前期国内专家们的共同努力下,笔者牵头撰写了《直肠癌新辅助治疗后等待观察策略专家共识(2020版)》和《直肠癌新辅助治疗后等待观察策略患者权益保护专家共识》,旨在反映WW疗法在我国医疗场景下应用的可行性、需要注意的诊疗细节,并强调了患者对WW疗法的知情权。[7,8]对于涉及直肠/肛门损毁的术前知情,我们应该提供WW疗法以及其他替代治疗方案,并通过客观的数据告知让患者参与制订治疗方案。[9]
二、常见误区要避免
1、别再混淆局部再生(LocalRegrowth)和局部复发(Local Recurrence)
不少外科专家在交流中甚至在一些“综述”中会提到WW疗法中复发率高的问题。我们需要澄清“局部再生”和“局部复发”的区别:对WW疗法有一定经验的团队会发现,绝大部分的局部再生是腔内型的,即从cT0再次回到cT1/T2,这类肿瘤的膜解剖结构是完整的,补救性TME手术成功率很高,在笔者中心补救手术中也有相当比例患者接受了补救性局部切除,依旧达到了器官保留的效果。[10,11]
2、 cCR 后内镜活检价值有限,图像特征更重要
这个观点源于NCRT后肿瘤细胞分布规律的一些研究,肿瘤浸润的顺序是黏膜→黏膜下→肌层→系膜→周围脏器结构,然后NCRT 后肿瘤消退的顺序并不是反向回退,而是和肿瘤浸润的顺序近似。从放射肿瘤学来看,黏膜血运较好,该层肿瘤缓解率更高;因此发生cCR/near-cCR 后黏膜面活检往往是阴性的,不如特征性的内镜cCR 表现更有提示意义。如果出现局部再生,则往往是腔内型病变,此时再活检更有针对性。[12,13]
3、cCR后以活检为目的的局部切除:没想象中安全
(1)如果肿瘤位置肯定无法保肛且cCR 瘢痕很小则尝试局切还能接受;如果瘢痕稍大、黏膜呈纠集收缩状,则切开肠壁后创面会相当大,缝合不易;实际上国际报道的数据,NCRT后局切,创面裂开在70%以上;笔者进行过数例“金字塔形切除”,抛开系膜出血等风险不提,切除后创面可深达精囊腺或骶骨表面等结构,需要具备和TaTME类似的分离技巧,游离近端的肠壁后才能成功缝合,如放置创面引流早期流量可高达50~60ml;总体感觉NCRT后局切并不如普遍想象中的安全、微创,其风险和远期疗效需要慎重评价。[14]
(2)如果是交界性保肛的患者:最好不要尝试局部切除,破坏TME间隙后如再次追加根治手术则困难重重,并发症率较高。GRECCAR-2研究的数据中补救TME 的并发症数据对冲掉了局切的微创优势。[15]
(3)局切后病理合并高危因素后追加TME手术:对于进展期癌ypT2的N阳性率在15%~20%,但是这是在传统NCRT背景下的数据;在TNT时代,如果初始为低风险肿瘤,如cT3a-b,则降期后局切为ypT2且切缘干净,追加TME的必要性尚不明确,追加TME、密切随访孰优孰劣,有待探索;其他高危因素如分化程度差、癌栓等,实际上在临床实践中所遇不多,很难有大样本的数据;对于保肛意愿强烈的患者,应充分沟通后共同决策。
4、WW策略搞RCT ?不一定可行!
尽管RCT证据级别较高,但如果随机过程放在发生cCR之后,则患者的意愿会严重影响随机的效果,绝大部分患者会倾向于等待观察甚至拒绝随机化。在多个专家述评中,已经批判地评论过:RCT研究并不适合WW疗法。[16,17]
对于WW疗法目前的数据多来自于多中心登记研究、真实世界研究。笔者认为前瞻性研究也设计为单臂前瞻性为佳,可行性较好。
三、争议焦点和展望
1、 优势人群:从“偶得性等待观察”到“主动性等待观察”
既往报道的临床完全缓解病例,大多来自于“局部进展期癌”NCRT后出现cCR的情况,然而cCR率不到5%。造成cCR和pCR率脱节的主要原因在于基线分期偏晚,肿瘤负荷较大;即使是达到pCR的肿瘤,由于存在较大的治疗后瘢痕,也很难被判定为cCR,从而直接进入手术的常规流程。
笔者较早提出了从“偶得性等待观察”向“主动性等待观察”转变的思路,即从“高负荷高风险局部进展期癌→NCRT→降期→准备手术→偶尔出现cCR→偶尔WW”,向“低负荷低风险直肠癌→TNT→相当高的cCR 率→较高的WW率”这种模式转变。
【表-1】外科医生应当面对以下事实:对于直接手术优势的病例(cT2/T3a/T3b 肿瘤),其预期NCRT/TNT 后的cCR率高达35%~80%,本质上手术和放化疗是两种竞争性的局部治疗。[18-20]

【表-1】偶得性 vs. 主动性等待观察:异同
2、观察期转移风险
WW策略的主要风险并不是局部风险,如前所述,观察期局部再生行补救手术成功率很高(85%-90%)。而观察期远隔转移是威胁患者生命的主要风险,但转移对患者的影响并没有更为详尽的报导。笔者对转移风险有几点思考:
1) 既往观察期的转移率,来自于“局部进展期癌”发生cCR后的数据;如对传统外科优势的低风险直肠癌(cT2/T3a/T3b)实施TNT治疗,则理论上这组病例发生cCR后转移率应明显低于8%;
2) 笔者所在中心前期数据显示,局部发生cCR 的病例总体生物学行为好,发生转移后大部分患者仍有机会接受根治为目的转移灶损毁。此外还可观察到原发灶持续cCR状态,发生远隔转移后再次获得治愈的病例;
3) 患者基线EMVI状态、CEA水平、侧方淋巴结性质判断、RAS/BRAF状态等与转移相关因素,在未来可参与治疗决策考量,提高WW策略的安全性;
3、NCRT 治疗方案及组合
常用且强效的NCRT案组合,目前主要是生物等效剂量较高的长疗程外照射 巩固化疗 延长等待。巩固化疗的方案和周期目前尚无定论,是否采用含铂方案也不明确。使用巩固化疗的目的除了巩固降期,还有一个考虑是延长等待期内的全身控制;如单纯显著延长放疗后等待时间,则这段时间毫无全身控制,将使此类研究难以通过伦理审查。笔者汇总以下几点供读者思考:
1)如使用含铂方案,则OXA应避免放在放化疗同步期内(会显著增加放疗毒性),而是更多利用放疗后休息间期。[21,22]
2)放疗后等待间期未来很可能延长至16-24周,该期间如毫无治疗则伦理难以通过。[10]
3)巩固化疗最常见并影响治疗的毒性是血小板减少。
4)巩固化疗期间更密切的评效是必要的,一旦达到cCR 诊断即可停止新辅助治疗,而不必拘泥于固定周期数,早或晚发生的cCR,预后都是类似的。[20]
5)比治疗强度更重要的是基线分期选择,分期早 疗效强度大,是达到cCR的关键。
6)发生Near-cCR,延长等待或追加近距离放疗,可能是未来扩大WW 适应症的途径。
7)免疫治疗对部分直肠癌亚组可能有很好的疗效,但此领域仍需探索,此外对低危直肠癌在现有NCRT达到cCR率已经不错的情况下,增加免疫治疗所引起的毒性风险,需要谨慎地探索。
4、 治疗结局判定
WW策略作为一种新的治疗思路,对治疗终点的影响是巨大的。目前普遍用3年无病生存率替代预测总生存率,但发生cCR、near-cCR后WW的患者,甚至是非cCR 患者拒绝手术,这些情况都不能简单地用传统指标进行评价。[23]
根据最近国际动态,列出了在WW策略和器官保留时代的终点选择,以及和传统方法相比的异同。

【表-2】未来研究中功能保留或非手术治疗相关的事件对DFS 赋值的影响
5、北京大学肿瘤医院前瞻性研究简介:
PKUCH-R01研究【NCT02860234】于2020年3月在《中华胃肠外科杂志》发表了中期报告。本研究聚焦了低风险直肠癌:cT2/T3a/T3b,分化Grade1-3,MRF-,EMVI-,并给予Cape-IMRT50.6Gy/22f 4周期巩固CapeOX;研究示意图见【图-1】;[24]

【图-1】PKUCH-R01 研究治疗流程图
初步结果显示cCR率>40%,near-cCR率>20%,器官保留率>50%,观察期转移率<3%;目前本研究有效病例65例已入组完毕,相较同期受关注RCT研究如Braziliantrial【NCT02052921】,TESARtrial【NCT02371304】,STARTRECtrial【NCT02945566】等,入组更迅速,本研究的特点如下:
1) 单臂前瞻性研究,不存在cCR 后随机依从性差的问题,可行性好;
2) 单中心研究,入组质控较好;
3) MRI 结合临床病理因素进行分层,筛选了放化疗相对敏感的病例;
4) 结合了低危肿瘤 TNT 模式,达到了较高的cCR/near-cCR 率;
未来北京抗癌协会大肠癌专委会在PKUCH-R01研究基础上,将组织4-5家中心开展BJ-R01研究,在多中心验证这种模式的有效性。
四、总结
综上所述,直肠癌等待观察疗法方兴未艾,为中低危直肠癌患者提供了新的治疗选择和保留器官功能的希望。中低危直肠癌在治疗模式上,和乳腺癌的发展历程颇为相似,治疗前风险分层、根据治疗反应决定走向、强调功能保留甚至免除手术的个体化治疗,会逐渐成为主流选择;[25]
在此过程中,外科医生作为MDT团队中导向性最强的角色,需要逐渐转变自身定位,从一线手术技术的执行者向治疗整体策略的决策者转变。
参考文献
1. van der Valk, M.J.M., et al., Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study. The Lancet, 2018. 391(10139): 2537-2545.
2. Dattani, M., et al., Oncological and survival outcomes in watch and wait patients with a clinical complete response after neoadjuvant chemoradiotherapy for rectal cancer: a systematic review and pooled analysis. Ann Surg, 2018;268(6):955-96
3. Smith, J.J., et al., Organ preservation in rectal adenocarcinoma: a phase II randomized controlled trial evaluating 3-year disease-free survival in patients with locally advanced rectal cancer treated with chemoradiation plus induction or consolidation chemotherapy, and total mesorectal excision or nonoperative management. BMC Cancer, 2015;15:767
4. Habr-Gama, A. and R.O. Perez, The surgical significance of residual mucosal abnormalities in rectal cancer following neoadjuvant chemoradiotherapy (Br J Surg 2012; 99: 993-1001). Br J Surg, 2012. 99(11): 601; author reply 1601-2.
5. Smith, J.J., et al., Assessment of a Watch-and-Wait strategy for rectal cancer in patients with a complete response after neoadjuvant therapy. JAMA Oncol, 2019: e185896.
6. Sao Juliao, G.P., et al., Conditional survival in patients with rectal cancer and complete clinical response managed by watch and wait after chemoradiation: recurrence risk over time. Ann Surg, 2019;272(1):138-144
7. 中国直肠癌新辅助治疗后等待观察数据库研究协作组, et al., 直肠癌新辅助治疗后等待观察策略专家共识(2020 版). 中华胃肠外科杂志, 2020;23(01):1-9.
8. 中国直肠癌新辅助治疗后等待观察数据库研究协作组(CWWD), et al., 直肠癌新辅助治疗后等待观察策略患者权益保护专家共识. 中华胃肠外科杂志, 2020. 23(03):220-224.
9. Gani, C., et al., Organ preservation in rectal cancer: the patients' perspective. Front Oncol, 2019. 9:318.
10. Renehan, A.G., et al., Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project): a propensity-score matched cohort analysis. Lancet Oncol, 2016. 17(2):174-83.
11. Renehan, A.G., L. Malcomson, and R. Emsley, Watch-and-wait approach for rectal cancer: concepts of a subject-specific method. Lancet Gastroenterol Hepatol, 2017. 2(9):627.
12. Ogura, A., et al., Endoscopic evaluation of clinical response after preoperative chemoradiotherapy for lower rectal cancer: the significance of endoscopic complete response. Int J Colorectal Dis, 2015. 30(3):367-73.
13. Perez, R.O., et al., Role of biopsies in patients with residual rectal cancer following neoadjuvant chemoradiation after downsizing: can they rule out persisting cancer? Colorectal Dis, 2012. 14(6):714-20.
14. Perez, R.O., et al., Transanal endoscopic microsurgery for residual rectal cancer after neoadjuvant chemoradiation therapy is associated with significant immediate pain and hospital readmission rates. Dis Colon Rectum, 2011. 54(5):545-51.
15. Rullier, E., et al., Organ preservation for rectal cancer (GRECCAR 2): a prospective, randomised, open-label, multicentre, phase 3 trial. Lancet, 2017. 390(10093):469-479.
16. Chang, G.J., Simulating watch and wait for rectal cancer. Dis Colon Rectum, 2015. 58(2):155-6.
17. Smith, R.K., et al., Surveillance after neoadjuvant therapy in advanced rectal cancer with complete clinical response can have comparable outcomes to total mesorectal excision. Int J Colorectal Dis, 2015. 30(6):769-74.
18. Glynne-Jones, R., Watch and wait in rectal cancer: is it time to subclassify cT3? Lancet Gastroenterol Hepatol, 2018. 3(12):814-815.
19. Wilkins, S., et al., Complete pathological response after neoadjuvant long-course chemoradiotherapy for rectal cancer and its relationship to the degree of T3 Mesorectal Invasion. Dis Colon Rectum, 2016. 59(5):361-8.
20. Habr-Gama, A., et al., Organ preservation in cT2N0 rectal cancer after neoadjuvant chemoradiation therapy: the impact of radiation therapy dose-escalation and consolidation chemotherapy. Ann Surg, 2019. 269(1):102-107.
21. Gerard, J.P., et al., Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol, 2010. 28(10):1638-44.
22. Rodel, C., et al., Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol, 2012. 13(7):679-87.
23. Fokas, E., et al., Outcome measures in multimodal rectal cancer trials. Lancet Oncol, 2020. 21(5):e252-e264.
24. 王林, et al., 低风险直肠癌患者全程新辅助治疗后主动性 等待观察及器官保留策略:一项前瞻性、 单中心、单臂研究(PKUCH⁃R01)的初步报告. 中华胃肠外科杂志, 2020.23(3):258-265.
25. van la Parra RF, Kuerer HM. Selective elimination of breast cancer surgery in exceptional responders: historical perspective and current trials. Breast Cancer Res, 2016;18(1):28
版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:医悦汇”。