
第一作者:Dale Ashley Osborne
通讯作者:Michelle J.S. Spencer
通讯单位:澳大利亚皇家墨尔本理工大学
【研究背景】
尽管锂离子电池已经取得了长足的进步,但其仍面临着与电解液稳定性相关的许多关键问题的挑战,其中之一就是电解液中的锂盐。基于磺酰亚胺阴离子(TFSI-、FTFSI-和 FSI-)的锂盐及其相应的离子液体,在锂离子电池领域显示出很好的应用前景。然而,磺酰亚胺阴离子种类繁多,其在锂离子电池电解液中的设计、合成和性能评估相当复杂。鉴于此,澳大利亚皇家墨尔本理工大学Michelle J.S. Spencer等人利用计算方法,系统地研究了不同磺酰亚胺阴离子类官能团结构对电解液性能的影响,确定了哪些取代基能够改善电解液的氧化和还原稳定性。结果表明,无论取代基对磺酰亚胺阴离子结构如何影响,只要有Li反离子的存在,阴离子核心内的电子再分布就会最小。然而,不同的官能团组合会影响锂离子的结合能和氧化电位。具体来说,高电负性官能团能够削弱锂离子之间的相互作用,并增加阴离子的氧化稳定性。
【详细内容】
通过图1中的等式,计算锂的氧化和还原电位。

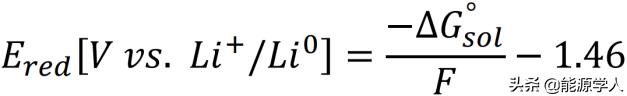
在上述两个等式中ΔGsolo为溶液中中性物质和氧化/还原物质之间的吉布斯自由能差,F为法拉第常数。 为了与实验电压测量值进行比较,以Li/Li 为参考,对计算出的电位进行了相应校正,-1.46 V为校正因子。

图 1. 用于计算锂盐的(a)氧化和(b)还原电位的热力学循环。
在电池中,锂离子从一个电极穿过隔膜到达另一个电极,这些离子将在多个位置与电解液中的组分发生相互作用,锂离子在电解液中是动态的,而不仅仅是在最低的基态。因此,了解锂离子与每个位点如何相互作用至关重要。研究人员首先对LiTFSI和LiFSI离子,以及LiTFSI 和 LiFSI 的混合体(即 LiFTFSI)进行了详细的计算,探索不对称性对阴离子特性的影响。这些阴离子及其各自的锂盐的优化结构如图2所示。

图 2. 各种阴离子及其相应锂盐的优化结构。
为了检查对称阴离子对电解液性能的影响,即 R'=R'',研究人员计算了九种修改结构的性质,其相应配置显示在图 3中。从图3中可以看出,Li离子与这些对称阴离子的结合可分为 3 种不同的构型:双齿型,其中 Li 与每个砜基团的O原子配位;三齿型,其中Li与每个砜基团的一个O原子和一个R基团的一个原子配位;四齿型,其中Li与每个砜基团的一个O原子和每个R基团的一个原子配位。
随着锂配位数增加,最短的锂阴离子距离 d(Li-A) 略有延长,双齿结构的键长为 1.79-1.80 Å,三齿结构的键长为 1.79-1.84 Å,四齿结构为1.87 Å。四齿型结构的距离比块状氧化锂 (PDF 00-012-025434) 中的Li-O 键 (2.00 Å)短 0.13 Å,其中该块状氧化锂中的Li与4个相邻的O原子配位。四齿型结构的Li-A键长与双(草酸根)硼酸锂 (LiBOB) (1.93 Å) 中看到的离子 Li-O 键相当。对于用柔性官能团化的磺酰亚胺阴离子结构(即在官能团具有 2 个碳链的情况下),如 ESI-(S2)、BETI-(S3)、CmSI-(S8) 和 MOSI-(S9),其存在大量配位点。这种多余的自由度允许阴离子采用柔性结构构型,从而适应锂离子的存在,例如在 BETI-(S3) 的三种最稳定构型中,Li 都与阴离子两侧的两个 O 原子配位(如图3所示)。 而这些结构在-CF2CF3基团的方向上有所不同,即当 F原子位于 Li 原子附近时,能量差异非常小,约为 4 kJ mol-1。
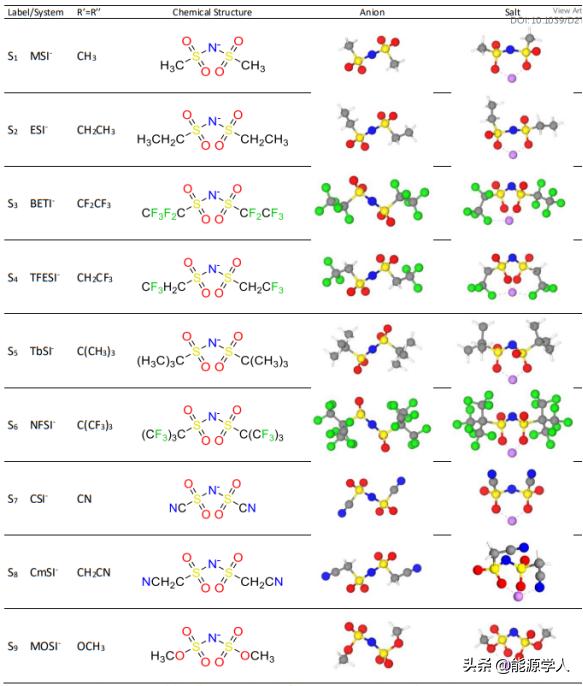
图 3. 优化的对称阴离子结构和其相应的锂盐,蓝色球:N,黄色球:硫;红色球:O;灰色球:C;绿色球:F;紫色球:Li; 白色球:H。
在确定了阴离子的对称性对其与 Li 配位的影响之后,研究人员继续研究了9 种不对称阴离子的性质及其(即 R'≠R'')对Li 配位的影响。图4给出了9 种不对称阴离子的最稳定的配位几何结构。与对称阴离子相比,不对称阴离子具有更多的稳定构型,这是由于每个 R'/R'' 组周围具有的独特结构配置。
不对称阴离子与Li离子配位具有多种结构特征。首先,与Li离子形成的盐具有二齿(HMSI-(A1)、FMSI-(A2)、HESI-(A3)、MESI-(A4)、MTbSI-(A6)、FCSI-(A8) 和 TFCSI-(A9) ) 或三齿 (FPFESI-(A5) 和 TFNFSI-(A7)) 构型。三齿配位型结构发生在庞大的 F 基官能团中,其中除了两个 O 原子外,Li 还与 F 原子相互作用。所有不对称阴离子与Li离子配位后形成的锂盐都表现出更高的稳定性。当与 Li 键合时,FMSI-(A2)、FCSI-(A8) 和 TFCSI-(A9) 更喜欢顺式构型,而其余结构更喜欢反式构型。对于所有不对称结构,Li 倾向于与来自每个砜基团的一个 O 原子螯合。 然而,对于 TFNFSI-(A7),由于其柔韧性性质,这种构型仅在与C(CF3)3基团中的F原子发生键合。当R'和R''属于同一类官能团时,这些构型出现在每个阴离子的两侧,并且在两个位置具有相似的结合能。
总体而言,对称阴离子与锂离子采用双齿、三齿和四齿构型,而不对称结构仅表现出双齿和三齿构型。仅含 C 和 H 官能团的结构采用双齿构型,类似于 TFSI、FSI 和 FTFSI。 三齿和四齿构型只出现在具有高自由度的官能团如 CF2CF3 和 CH2CF3存在情况下。

图 4. 优化的非对称阴离子结构和其相应的锂盐,蓝色球:N,黄色球:硫;红色球:O;灰色球:C;绿色球:F;紫色球:Li; 白色球:H。
图5显示了阴离子(纯色)和相应的锂盐(阴影图案)最稳定的反式和顺式结构体之间的总能量差异。对于参考结构,未锂化的阴离子的顺式和反式构象与盐形式之间的能量差非常小(小于 5.6 kJ.mol-1),表明阴离子保留了其灵活性。将参考结构与候选结构进行比较,绝大多数候选结构在顺式和反式之间具有较大的能量差异,而锂化对该能量差异的影响很小。例外情况是,TFESI-(S4)、CmSI-(S8)、MOSI-(S9) 和 FMSI-(A2),这很可能是由于对称结构具有更大的协调性,从而稳定了系统。对于 FMSI-(A2),当 Li 存在时,顺式构象是优选的。由于对称盐 LiBETI (S3) 和 LiCSI (S7) 以及不对称盐 LiFMSI (A2)、LiFPFESI (A5)、LiTFNFSI (A7)、LiFCSI (A8) 和 LiTFCSI (A9) 具有相似的顺反式能量差,因此这些预计盐具有类似的旋转能垒和柔韧性。柔性被认为有利于在锂金属上形成均匀的 SEI 层。

图 5. 每种锂盐的反式和顺式构象异构体之间的总能量差异。 参考结构以红色显示,对称阴离子以蓝色显示,不对称阴离子以绿色显示。
如图6所示,Scheer 图给出了所有磺酰亚胺阴离子与锂离子的结合能。其中参考结构用虚线框突出,表示结合能的分布相对较窄,特别是与较大的氟化物如 LiBETI (S3) 和 LiNFSI (S6) 相比时。通过引入含氢官能团,Li与阴离子的结合能增加,首先是含 F/H 官能团的结合能在-624 kJ mol-1和-525 kJ mol-1之间,然后,对于含H的官能团,其结合能介于-671 kJ mol-1 和 -556 kJ mol-1之间。 LiMTbSI (A6) 包含一个额外的稳定构型,因此其结合能最低,为 -374 kJ.mol-1。 这种不太稳定的构型可归因于大体积的叔丁基,其中Li与3个 H 原子配位。此外,对于相对较大的官能团,Li 需要额外的能量才能过渡到更稳定的位点。
与 F 原子相比,更多数量的 H 原子会导致更广泛的结合能。 因此,改变阴离子的大小,特别是 F 原子的数量可用于增加或减少锂离子结合能范围,这对实际电解质是有益的。 结合能的进一步降低可以通过用CN基团官能化来实现。 例如,CSI-(S7) 由R'和R''的-CN 基团组成,其结合能范围介于-543 kJ mol-1和-468 kJ mol-1之间。这表明官能团的选择可用于直接调节锂离子结合能。

图 6. Scheer图概述了每个阴离子的结合能分布情况。
图7给出了与 Li 配位后每个阴离子不同部分的电荷重新分布情况。对于大多数系统,电荷的再分布与官能团无关,其中锂从阴离子中获得0.044e 到0.063e的电荷。但LiTFESI-(S4)和 CmSI-(S8)是一个例外,其中阴离子向Li提供更多电荷(分别为0.086e 和 0.072e)。 这可能是Li具有较高配位数引起。

图 7. 与锂离子键合后,每个阴离子内的电荷转移。
图8给出了结合能、偶极矩和电负性与锂盐氧化稳定性之间的函数关系。总体而言,结合能、偶极矩和电负性都与预测的氧化电位基本一致。氧化稳定性随着锂阴离子结合能的降低而增加。此外,使用高电负性基团(如 CN)对阴离子进行官能化提高了电解液的氧化稳定性,其值高达6.64 eV。
对于计算的偶极矩(图8b),负电性更强的阴离子,例如 F 和 CN,也会导致更大的偶极矩,而H往往会导致更小的偶极子。此外,用电负性更大的基团进行官能化,会导致电解液氧化电位增加(图8c)。例如,由于 LiESI (S2) 的取代基部分取代了 LiTFESI (S4) 中的 F 原子,并在 LiBETI (S3) 中完全饱和,因此氧化电位整体增加 1.03V。氧化电位不受锂离子距离(图8d)或分子量(图8e)的影响。
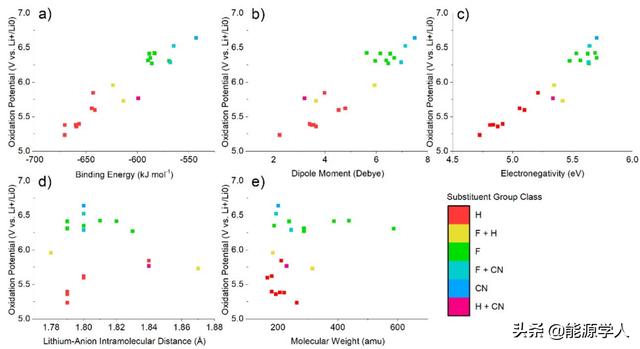
图 8. Li盐氧化电位与(a)Li-阴离子结合能,(b)偶极矩,(c)电负性,(d)Li-阴离子分子内距离和(e)分子量之间的关系。
【结论与展望】
总之,该工作使用密度泛函理论计算,系统地研究了磺酰亚胺基锂盐的结构和稳定性功能之间的关系。通过改变磺酰亚胺阴离子上的官能团,可以调整电子和电化学性质。总体而言,不对称阴离子与锂离子之间具有更多的相互作用位点。 此外,使用具有更大电负性的官能团,能够削弱锂离子与阴离子的相互作用,同时提高了氧化稳定性。
【文献信息】
Dale Ashley Osborne et al, Towards Higher Electrochemical Electrolyte Stability: Lithium Salt Design Through in silico Screening. J. Mater. Chem. A, 2022, Accepted Manuscript. https://doi.org/10.1039/D2TA01259F
,




