1 水和水的溶液
1.1 地球上的水
1.1.1 水的分布
1.地球上水的总贮量约有1.386×1018米3,其中约96.53%为海洋咸水,0.94%是陆地咸水,地球上的淡水(陆地淡水和大气水)仅占总水量的2.53%。
2.陆地淡水包括冰川水、地下淡水、湖泊淡水、土壤水、河水等。地球上的大部分以液态形式储存于海洋、河流、湖泊、水库、沼泽和土壤中;部分以固态形式成为极地的冰原、冰川、积雪和冻土中水分;小部分以水汽存在于大气中。
3.人类常利用的是江河湖泊水和浅层地下水。
1.1.2 海陆的分布
我们生活的地球,从太空看是个蔚蓝色的美丽星球,它看上去更像“水球”。根据人们的计算,地球表面71%是海洋,29%是陆地。概括地说,地球上七分是海洋,三分是陆地。
世界海陆分布很不均匀,陆地主要集中在北半球,海洋大多分布在南半球。
1.1.3 水循环环节及类型
1.水循环的环节

2.水循环的类型:海陆间循环、海上循环、陆地循环
3.水循环的意义
①维持全球水的动态平衡
②维持全球的热量平衡
③联系海陆间的重要纽带
④塑造地表形态
1.1.4 我国水资源的分布特点
1.我国是一个缺水较为严重的国家,水资源总量居世界第六位,人均水资源仅为世界平均水平的1/4。
2.总体特点是东多西少,南多北少,春夏多,秋冬少,总体呈现时空分布不均。
原因是受海陆热力性质差异的影响,东部受海洋性影响明显,降水多于受大陆性影响的西部,南部多数是热带亚热带季风气候,降水多于北部温带季风或大陆性气候。此外,东部和南部的河流多,集水面广。

1.1.5 我国严重缺水的地区
我国严重缺水的地区为:华北地区和西北地区。
华北地区的耕地占全国耕地的38%以上,且人口稠密,工业发达,需水量大,而水资源约占全国的6%,用水十分紧张,水土资源配合不协调。
1.2 水的组成
1.2.1 电解水实验
电解水实验如图所示:

1.实验用品有:水槽、试管、直流电、石墨电极(正极不能用铜等金属或与氧气反应的电极)、12V的直流电源.2.实验过程及现象:按照上面的实物图所示,连接好装置.为增强水的导电性,可在水中加入少量稀硫酸或氢氧化钠溶液(一般不加氢氧化钠溶液,容易起泡沫).闭合电路后,会看到试管内的电极上出现气泡,过一段时间,与电源正(氧气),负极(氢气)相连的试管产生的气体体积比约为1:2.(氧气的密度为1.429g/mL,氢气的为0.089g/mL;通过计算可得氧气与氢气的质量比为8:1,氢,氧两种分子和原子个数比都是2:1).可简单概括为:“正氧负氢1:2,质量比为8:1”.
3.该实验结论或推论有:
(1)水由氢、氧两种元素组成.
(2)水(分子)中,氢、氧两种元素的原子个数比为2:1,两气体的分子个数比为2:1、体积比为2:1.
(3)水通电生成氢气、氧气,正极产生的是氧气,负极产生的是氢气.该反应的化学方程式为通电2H2O=通电2H2↑ O2↑.
(4)化学反应前后,原子种类、个数不变,元素种类不变.
(5)在化学变化中,分子可分,而原子不可分.
(6)化学反应的实质是在化学变化中分子分解成原子,原子重新组合成新的分子(或聚集后直接构成物质)
(7)分子是保持物质化学性质的最小粒子.
(8)原子是化学变化中的最小粒子.
(9)氧气是由氧元素组成;氢气是由氢元素组成.
(10)水是由水分子构成的;一个水分子是由二个氢原子和一个氧原子构成;一个氢气分子是由二个氢原子构成;一个氧气分子是由二个氧原子构成.
(11)水是纯净物中的化合物中的氧化物,氧气和氢气是纯净物中的单质.
(12)该实验中发生的化学反应属于分解反应.
4.电解水时的误差分析,即氧气、氢气的体积比小于1:2,其原因主要有如下三个:
(1)氧气、氢气在水中的溶解度不同造成的.由于氧气的溶解度比氢气的稍大些,导致氧气、氢气的体积比小于1:2.
(2)电极的氧化造成的.当使用金属电极进行实验时,由于氧气的化学性质比较活泼,所以有可能有一部分氧气在电极处与电极发生了反应,使氧气损耗了一部分;导致氧气、氢气的体积比小于1:2.
1.2.2 水的组成
水的组成是水由氢、氧两种元素组成,两元素的质量比为1:8.
1.3 水的浮力
1.3.1 浮力定义与产生原因
定义:一切浸入液体(或气体)中的物体都受到液体(或气体)对它竖直向上“托”的力,成为浮力.
浮力的施力物体是液体(或气体),受力物体是进入液体(或气体)中的物体.
浮力的方向:竖直向上.
浮力的产生原因:
以浸在液体中的物体为例,由于液体内部向各个方向都有压强,同一深度处的压强相等且随深度增加压强会变大.
因此,物体的侧面受到的压力相互抵消,但其上、下表面受到的压力大小不同,下表面受到的向上的压力F2要大于上表面受到的向下的压力F1,两个压力的差值即表现为竖直向上的浮力,
可表示为浮F浮=F2−F1.
1.3.2 压力差法
物体的侧面受到的压力相互抵消,但其上、下表面受到的压力大小不同,下表面受到的向上的压力F2要大于上表面受到的向下的压力F1,两个压力的差值即表现为竖直向上的浮力.
公式浮F浮=F2−F1
1.3.3 称重法
把物体挂在弹簧测力计上,测出物体受到的重力G,再把物体浸入液体中,记下此时弹簧测力计的示数拉F拉,那么,物体受到的浮力浮拉F浮=G−F拉.
1.3.4 决定浮力大小的因素
物体在液体中所受浮力的大小,跟它浸在液体中的体积有关,跟液体的密度有关.
物体浸在液体中的体积越大,液体的密度越大,浮力就越大.
1.3.5 阿基米德原理
内容:浸在液体中的物体受到向上的浮力,浮力的大小等于它排开的液体所受的重力.公式:浮排液排F浮=G排=ρ液gV排.
1.3.6 对阿基米德原理的理解
1.排G排是物体排开液体的重力而不是物体自身的重力.2.液ρ液是指液体的密度,而不是物体的密度.排开液体体积相同的各种不同材料的物块,无论空心还是实心,浸没在同种液体中时,所受浮力大小都相等.3.排V排是排开液体的体积,不一定是物体的体积.当物体浸没在液体中时,排物V排=V物,物体体积不变,排开液体体积也不变,浮力大小与深度无关;当物体只有一部分进入液体中时,排物V排<V物,当物体逐渐浸入液体中时,排开液体体积增大,浮力也增大.
1.3.7 阿基米德原理法
根据公式浮排液排F浮=G排=ρ液gV排求浮力的大小,适用于液体和气体.
1.3.8 物体沉浮的五种类型

1.3.9 平衡法
纠错
只适用于漂浮和悬浮状态,当物体处于漂浮或悬浮状态时,浮物F浮=G物
1.3.10 浮力的应用
密度计:测量时,它漂浮在被测液体中.液体的密度越大,为获得同样的浮力,它排开液体的体积越小,密度计的位置也就越高.根据液面在密度计上的位置可以直接读出液体的密度.
轮船:用密度大于水的材料制成能够浮在水面的物体.原理是把密度大于水的材料做成空心的,使它能够排开更多的水,根据这个道理,人们用钢铁制造了轮船.
轮船的大小通常用排水量来表示.
排水量表示:轮船装满货物时排开水的质量.
例如:一艘轮船的排水量是1×104t,表示此船满载时,货物质量和船身质量之和为1×104t.
潜水艇:潜水艇两侧有水舱,向水舱中充水时,潜水艇逐渐加重,就逐渐潜入水中.当水舱充水至潜水艇重等于同体积的水重时,潜水艇可以悬浮在水中.当用压缩空气将水舱里的水排出一部分时,潜水艇变轻,从而上浮.
气球和飞艇:利用充气或放气来控制体积变化可实现升降.氢气球、热气球、飞艇能上浮到空中,这是因为氢气、热空气以及飞艇中的氧气的密度比空气的小,它们的重力小于所排开的空气的重力,因而能够升空.
1.3.11 大气压强的应用
1.抽水机:抽水机也叫水泵,常见的抽水机有活塞式抽水机和离心式抽水机,它们都是利用大气压来工作的.
2.用吸管喝饮料、塑料挂衣钩,钢笔吸墨水等都是大气压的应用.
1.4 物质在水中的分散状况
1.4.1 溶液的概念、组成及其特点
溶液的概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物.由此可见,溶液是由一种或几种物质(即溶质)和另一种物质(即溶剂)两部分组成.
溶液的组成:溶液不一定是由两种物质组成的,应该说是至少由两种物质组成;因为其中的溶剂虽然是一种,而溶质可以是多种的.
溶液的特点:是均一性和稳定性.其中,均一性是指溶液中各部分的性质和成分均相同(如一瓶溶液中,上下左右等各部分的密度都是一样的);稳定性是指在条件不变(即温度、压强等不改变,溶剂不蒸发等)的情况下,溶液中的溶质永远不会析出(即溶质与溶剂永不分离).
1.4.2 常见的溶剂
常见的溶剂主要有水、汽油、酒精等.其中,最常用的溶剂是水.例如,水能溶解氯化钠、硫酸铜等许多种物质,汽油能溶解油脂,酒精能溶解碘,等等.
1.4.3 溶液、溶质和溶剂的相互关系与判断
溶液、溶质和溶剂的相互关系:溶液是由溶质和溶剂组成,溶液质量是溶质质量与溶剂质量之和.类推之得:溶质质量是溶液质量与溶剂质量之差,而溶剂质量是溶液质量与溶质质量之差.但是,溶液的体积等于溶液的质量除以溶液的密度,却不等于溶质的体积与溶剂的体积之和. 对于溶液的判断,主要看其是否是均一、稳定的混合物. 对于溶液组成(即溶质、溶剂)的判断,可以参考下面的口诀:“气固溶液液为剂,液液相溶多为剂.水多水少总为剂,不指溶剂水为剂”.其含义为:“气体、固体溶于液体中,液体是溶剂,气体、固体为溶质;液体和液体相溶时,量多的为溶剂,量少的为溶质;有水时,不管量多量少,一般把水看作溶剂;没有指明溶剂时,常把水记作溶剂.”
1.4.4 悬浊液、乳浊液的概念及其与溶液的区别
悬浊液是指固体小颗粒悬浮于液体里形成的混合物,也叫悬浮液;乳浊液是指小液滴分散到液体里形成的混合物,也叫乳状液;它们与溶液的区别有两个:1.悬浊液中的小颗粒和乳浊液中的小液滴都是由许多分子的集合而成的分子集合体,而溶液中的溶质则是以单个分子(或离子)的形式分散着的.2.悬浊液和乳浊液都是不稳定、不均一的,静置一会儿后,都会分为上下两层(固体小颗粒会逐渐下沉,而小液滴会逐渐上浮);但是对于溶液来说,却正好相反,只要在条件不变(即温度、压强等不改变,溶剂不蒸发等)的情况下,溶液就不会出现分层现象,而是均一、稳定的.
另外,溶液、乳浊液、悬浊液的详细的区别和联系如下表所示:

1.4.5 固体药品的取用
固体药品的取用,一般分为以下两种情况:
1.块状药品或金属颗粒的取用,取用时可以用药匙,或者用镊子夹取.操作要领是:“一横、二放、三慢竖”.具体的操作是:先把容器横放,把块状药品或金属颗粒放入容器口,再把容器慢慢的竖立起来,使药品滑落到试管底部,以免打破容器.
2.粉末状药品的取用,取用时可以用药匙(或者纸槽).操作要领是:“一斜、二送、三直立”.具体的操作是:先将试管倾斜,把盛药品的药匙(或者纸槽)小心地送入试管底部,再使试管直立起来.
固体药品的取用原则有如下三条:
1.“三不”原则,即“不闻、不摸、不尝”;具体说就是:不要去闻药品的气味,不能用手触摸药品,不能尝试药品的味道.
2.节约原则,即严格按照实验规定的用量取用药品;没有说明用量时,一般按最少量取用,固体只需盖满试管底部即可.
3.“三不一要”原则,即剩余药品的处理方法.具体是就是:既不能放回原瓶,也不能随意丢弃,更不能拿出实验室,要放入指定的容器内.
1.4.6 液体药品的取用
液体药品的取用,一般分为以下两种情况:1.粗略的取用,此时可用倾倒法.倾倒液体时,需要注意的是:①瓶塞要倒放在桌面上,以防止残留在瓶塞上的污物污染原瓶里的药液.②标签向着手心,以防止残留在瓶口的药液流下来污染或腐蚀标签.③手拿容器的中上部,并使其稍微倾斜.④使瓶口紧挨着容器口,边倒边看,让液体沿器壁缓缓地流入容器底部.2.准确的量取,此时需要用量筒和胶头滴管(用于吸取和滴加少量液体)配合量取.也就是,一开始可将量筒倾斜,用倾倒的方法把所量液体倒入,边倒边看液面与刻度线,当液面接近所需刻度线时,应将量筒放平,换用胶头滴管向里滴加,边滴边看,直到量筒内液体的凹液面的最低处与所需刻度线保持水平为止.需要注意的是:①选择的量筒与所量液体的体积越接近越好.②倾倒液体时,要把瓶塞倒放在桌面上;标签向着手心.③倾倒至快接近刻度时,一定要换用胶头滴管来滴加(胶头滴管取用试剂后要放在滴管架上,若平放或倒置,液体试剂进入胶头而使胶头受腐蚀或将胶头里的杂质带进试管).
④读数时应将量筒放在水平的桌面上,视线要与量筒内液体的凹液面的最低处保持水平;如果俯视读数,读数比真实值偏大,仰视则相反.
液体药品的取用原则有如下四条:
1.“三不”原则,即“不闻、不摸、不尝”.具体说就是:不要去闻药品的气味,不能用手触摸药品,不能尝试药品的味道.2.节约原则,即严格按照实验规定的用量取用药品;没有说明用量时,一般按最少量(1ml∼2ml)取用液体.3.“三不一要”原则,即剩余药品的处理方法.具体是就是:既不能倒回原瓶,也不能随意丢弃,更不能拿出实验室,要倒入指定的容器内.4.安全原则,实验中要特别注意保护眼睛,万一眼睛里溅进了药液(尤其是有腐蚀性或有毒的药液),要立即用水清洗(切不可用手揉眼睛).洗的时候要眨眼睛,必要时请医生治疗.提倡使用防护镜.
1.5 物质的溶解
1.5.1 物质的溶解性及影响溶解性的因素
物质的溶解性是物质本身固有的一种属性,并且是物质的一个重要物理性质.它是指一种物质溶解在另一种物质里的能力.它有两种表示方法,一种是定性表示法,另一种是定量表示法.定性表示法就是用易溶、可溶、微溶、难溶(或不溶)等粗略概念表示;定量表示法就是用一定温度下(气体还强调压强为101kPa),一定量的溶剂(一般是水)里溶解固体溶质的质量(或气体的体积)来准确地表示.它们的内部联系是通常把室温(即20∘C)时的溶解度大于或等于10g的,叫易溶物质,大于或等于1g但小于10g的,叫可溶物质,大于或等于0.01g但小于1g的,叫微溶物质,小于0.01g的,叫难溶(或不溶)物质.影响溶解性的因素包括内部因素和外部因素.其中,内部因素是溶质、溶剂本身的性质.例如,食盐容易溶解在水里,却很难溶解在汽油里;油脂很难溶解在水里,却很容易溶解在汽油里.外部因素是温度、压强(是对气体来说的).例如,除了气体和氢氧化钙等特殊的固体溶质的溶解性与温度成反比以外,一般物质的溶解性与温度成正比;还有气体的溶解性也与压强成正比.
1.5.2 溶解时的吸热或放热现象
溶解时的吸热或放热现象是指物质在溶解时,所发生的两个过程的吸热和放热的多少不同,而引起的溶液的温度变化的现象.具体来说,是这样的.物质溶解的过程包含有以下两个过程:一个过程是物质的分子(或离子)向水中扩散,该过程吸收热量;另一个过程是物质的分子(或离子)和水分子作用,生成水合分子(或水合离子),该过程放出热量.
并且,不同的溶质,在这两个过程中吸收和放出的热量也不同;这就导致在物质的溶解过程中,伴随着温度的变化,同时表现为吸热或放热现象.其具体变化情况如图所示:

共有如下三种:1.当溶解时放出的热量>吸收的热量时,溶液温度会升高(如氢氧化钠、浓硫酸等;另外,氧化钙放在水中发生反应放热,也会使温度升高),表现为放热现象.2.当溶解时放出的热量=吸收的热量时,溶液温度不变(如氯化钠等),表现为既不吸热,也不放热的现象.3.溶解时放出的热量<吸收的热时,溶液温度会降低(如硝酸铵等),表现为吸热现象.
1.5.3 饱和溶液和不饱和溶液
饱和溶液是指在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液.它们区别就是在一定温度下,一定量的溶剂里能否继续溶解某种溶质.其特点除具有溶液的基本特性(即均一性、稳定性)外,还具有针对性(即它们只有针对某种溶质来说,才有意义;否则,就说不准是饱和溶液还是不饱和溶液了);例如,一定温度下,一定量的溶剂里的硝酸钾饱和溶液是针对硝酸钾来说,它是饱和溶液,而针对氯化钠等其它可溶性的物质来说,它可能是不饱和溶液.也就是说,在一定温度下,一定量的溶剂里的硝酸钾饱和溶液中,加入硝酸钾是不能再溶解的;但是,加入氯化钠等其它可溶性的物质是能够继续溶解的.
1.5.4 饱和溶液和不饱和溶液相互转变的方法
饱和溶液和不饱和溶液相互转变的方法如图所示:

但是,还需要注意的以下4点:1.当采用上述相互转变方法中的改变温度的方法,来实现饱和溶液和不饱和溶液的相互转变时,是针对溶解度随着温度的升高而增大的固体(如硝酸钾、氯化铵等)来说的.如果针对溶解度随着温度的升高而减小的固体(如氢氧化钙等)来说,上述相互转变方法中的升、降温度正好相反(即将上述相互转变方法中的升温改为降温,降温改为升温),才能实现相应的饱和溶液和不饱和溶液的相互转变.2.当需要增加溶剂的量,来实现饱和溶液转变为不饱和溶液时,一定要按照需要的量来加,切不可过多(为了保护水资源和节约用水).3.当需要蒸发溶剂的量,来实现不饱和溶液转变为饱和溶液时,一定要注意只是蒸发掉多余的溶剂,并且要求是恒温蒸发之.4.当需要加入溶质的量,来实现不饱和溶液转变为饱和溶液变时,一定要注意加入的溶质应该和原来的不饱和溶液中的溶质保持一致,切不可加入其它的和原来的不饱和溶液中的溶质不一样的溶质.
1.5.5 浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系
溶液的浓和稀、溶液的饱和和不饱和是从两个不同角度来认识溶液的性质.要想弄清浓溶液和稀溶液跟饱和溶液和不饱和溶液的关系,首先要明确它们各自含义或概念等.
其中,溶液的浓稀是指一定质量的溶液中含溶质的多少,多的则浓,少的则稀;而溶液的饱和和不饱和是指一定温度下,一定量溶剂里能否再溶解某种溶质,能溶的为其不饱和溶液,不能溶的为其饱和溶液.
例如,20∘C时,100g水中溶解31.6g硝酸钾,所得溶液既是饱和溶液,又是较浓溶液;若将30g硝酸钾在此温度下溶解在100g水中,所得溶液是不饱和溶液但仍为较浓溶液.再如,在20∘C时,100g水中最多能溶解0.00024g BaSO4,此时所得溶液显然很稀,但它却是饱和溶液;若取0.0002g BaSO4在此温度下溶于100g水中,所得溶液既是不饱和溶液,也是稀溶液.
另外,对溶解度随温度的升高而增大的固体物质来说,其高温时的不饱和溶液有可能比其低温时的饱和溶液的浓度要高;而对特殊溶质氢氧化钙等溶解度随温度的升高而减小的固体物质来说,其低温的不饱和溶液有可能比其高温时的饱和溶液的浓度要高.
由此可见,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液.当然,若同一温度下,同一种溶质溶解在同一种溶剂中,其饱和溶液一定比其不饱和溶液的浓度要高.
1.5.6 影响溶解快慢的因素
影响溶解快慢的因素有很多种,但主要因素包括:物质的形状或颗粒大小(面积的大小)、溶剂的温度、是否搅拌等.当物质的形状或颗粒越小,溶解的越快;溶剂的温度越高,物质溶解的越快;还有,搅拌时也能加速物质在水中的溶解.当然,多种方法综合使用,效果会更加明显.
1.5.7 固体溶解度的概念
固体溶解度的概念是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量.一般用字母S表示,其单位是克(符号为g).在未注明溶剂的情况下,通常溶解度指的是物质在水里的溶解度.例如:在20∘C时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),我们就说在20∘C时,氯化钠在水里的溶解度是36g.固体的溶解度受温度的影响比较大.对于溶解度的意义的表达一般有两种方式:一种是在某温度时,100g水里最多能溶解多少克某物质;另一种是在某温度时,100g水里溶解多少克某物质,溶液达到饱和状态.
1.5.8 固体溶解度的影响因素
固体溶解度的影响因素主要是指温度.并且,大部分固体随温度升高溶解度增大,如硝酸钾;少部分固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰.
1.5.9 气体溶解度的影响因素
气体溶解度的影响因素主要是指温度和压强.具体的变化规律是:气体的溶解度随温度的升高而减小(随温度的降低而增大),随压强的增大而增大(随压强的减小而减小).可以简记为4个字,即“温反压正”;其含义是气体的溶解度与温度成反比关系,与压强成正比关系.
1.5.10 一定溶质质量分数的溶液的配制
一定溶质质量分数的溶液的配制:所用仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒;操作步骤是:计算→称量→溶解→装瓶→贴签→入柜.其注意事项有以下六条:1.计算时,溶质的质量=溶液质量×溶质的质量分数,溶液质量=溶液体积×溶液密度,溶剂的质量=溶液质量−溶质的质量;由于溶剂一般是水,且密度为1g/cm3,所以溶剂的体积和质量在数值是相等的.2.称量,称量包括称取溶质的质量和量取溶剂的体积;首先,用托盘天平(配用药匙)称量所需的溶质,倒入烧杯中;然后,用量筒(配用胶头滴管)量取所需的水,倒入盛有溶质的烧杯中.3.用玻璃棒不断搅拌,使溶质加速溶解.4.把配好的溶液装入细口瓶中,盖好瓶塞.5.标签上要注明溶液的名称和其中溶质的质量分数.6.放入试剂柜时,要注意标签向外.
1.5.11 溶质的质量分数
溶质的质量分数是溶液组成的一种表示方法,是指溶质质量与溶液质量之比.其含义是指100份质量的某溶液中含多少份质量的该溶质.溶质的质量分数的一般计算公式是:
溶质的质量分数溶质的质量溶液的质量溶质的质量分数=溶质的质量溶液的质量×100%;
溶质的质量分数溶质的质量溶质的质量溶剂的质量溶质的质量分数=溶质的质量溶质的质量 溶剂的质量×100%;
溶质的质量分数溶质的质量溶液的密度溶液的体积溶质的质量分数=溶质的质量溶液的密度×溶液的体积×100%;
特殊计算公式(使用于饱和溶液)是:溶质的质量分数溶解度溶解度溶质的质量分数=溶解度溶解度 100g×100%.
值得注意的是:
①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量.
②溶质的质量分数是比值,没有单位;一般用百分数表示.
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一.
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内.
⑤当计算饱和溶液中溶质的质量分数(即该温度下该溶质质量分数的最大值)时,才可以使用特殊计算公式来计算.
1.5.12 用水稀释改变浓度的方法
用水稀释改变浓度的方法就是指为了某种需要,向浓溶液中加入适量的水(如果是稀释浓硫酸时,应该将浓硫酸沿器壁慢慢地注入水中,并用玻璃棒不断搅拌),将其稀释的所要求的浓度的方法.要想顺利达到这个目的,必须做到以下几点: 首先,要进行准确地计算;由于溶液稀释前后,溶质的质量是不变的;若设浓溶液质量为m g,溶质的质量分数为a%,加水稀释成溶质的质量分数为b%的稀溶液n g,则等式m g×a%=n g×b%成立,加入水的质量为n g−m g. 然后,要进行准确地称量(或量筒量取所加水的体积即可,注意读数时一定要平视量筒内凹液面的最低处. 最后,将所量取的水慢慢地倒入盛浓溶液的烧杯中(不能洒落到烧杯外面),并用玻璃棒不断搅拌.切不可在量筒内进行稀释的实验操作.
1.6 物质的分离
1.6.1 结晶的原理、方法及其应用
结晶是分离可溶性固体和水(或者两种可溶性且溶解度变化差别大的固体)的一种混合物分离的方法;它是根据固体物质从溶液里析出晶体的原理,通过蒸发或者降温的方法将其中的固体物质分离出来;因此,结晶方法分为蒸发结晶和降温结晶两种.
蒸发结晶是指蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出;它使用于分离可溶性固体和水的混合物.
降温结晶是指先加热溶液,蒸发溶剂成饱和溶液,再降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出;它使用于分离两种可溶性且溶解度随温度变化差别大(即一种是溶解度随温度变化大,另一种是溶解度受温度变化影响小)的固体混合物.此时,需要注意固体物质的溶解度随温度变化的规律.其具体内容有如下三条:
1.大多数物质的溶解度随温度的升高而增大,如硝酸钾等.2.少数物质的溶解度受温度的影响不大,如氯化钠等.
3.极少数的物质的溶解度随温度的升高而减小,如氢氧化钙等.
1.6.2 过滤的原理、方法及其应用
过滤是把不溶于液体的固体物质跟液体分离开来的一种混合物分离的方法;它根据滤纸能够透过液体和溶于液体的物质的特殊功能,将混合物分离开来;常用来分离不溶于液体的固体物质跟液体等等.所需器材有铁架台、漏斗、滤纸、烧杯、玻璃棒等.要想过滤,首先要制过滤器,具体如图所示:

将一张滤纸对折两次后,展成圆锥形,用水润湿倒贴在漏斗内壁水即可.
过滤的具体操作要领及注意事项:
一贴,即滤纸紧贴漏斗内壁,中间不要留有气泡.二低,即漏斗内滤纸边缘低于漏斗口边缘,漏斗内液面低于滤纸边缘.
三靠,即倾倒液体时,盛浑浊液的烧杯嘴紧靠玻璃棒;玻璃棒末端轻靠漏斗内三层滤纸处;漏斗下端紧靠承接滤液的烧杯内壁.

1.6.3 蒸发与蒸馏操作
蒸发
如图所示,它是为了得到溶于水中的可溶性固体而进行的基本使用操作.所需仪器有铁架台、蒸发皿、酒精灯、烧杯、玻璃棒、石棉网等.蒸发的操作注意事项有以下五条:

1.蒸发皿中液体的量不得超过其容积的23.2.蒸发过程中必须用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅.3.当加热至较多固体出现时,应停止加热利用余热蒸干.4.不能把热的蒸发皿直接放在实验台上,应垫上石棉网.5.夹持蒸发皿要用坩埚钳.
蒸馏
如图所示,它是根据物质的沸点不同,通过加热的方法,使低沸点物质先蒸发,再冷凝而得以分离的一种操作.所需仪器有蒸馏瓶(蒸馏烧瓶)、铁架台、酒精灯、冷凝管、温度计、橡皮塞、锥形瓶、尾接管、石棉网等.其操作注意事项也有以下五条:
1.加热时要垫石棉网(也可以用其它热浴加热),使之均匀受热.2.加热时,液体量不超过容积的23,不少于容积的13.3.配置附件(如温度计等)时,应选用合适的橡胶塞,特别注意检查气密性是否良好.4.蒸馏时最好事先在瓶底加入少量沸石,以防暴沸.5.蒸馏完毕必须先关闭活塞后再停止加热,防止倒吸.
1.6.4 氯化钠与粗盐提纯
氯化钠俗称食盐,其物理性质是一种白色晶体,易溶于水,并且溶解度随温度变化不大,有咸味,密度为2.165g/cm3,熔点801∘C,沸点1461∘C.其化学性质是pH值呈中性,其水溶液能与硝酸银溶液反应生成白色不溶于稀硝酸的沉淀(即氯化银;同时,这也是氯离子的检验方法);电解熔融的氯化钠能够分解得到金属钠和氯气.氯化钠的用途主要是常用来做调味品、防腐剂、融雪剂(降低雪的熔点);农业上,常用一定质量分数的氯化钠溶液来选种;医疗上,还用氯化钠来制生理盐水(0.9% 氯化钠溶液);工业上,还常用来制取氯气、烧碱等.粗盐提纯主要是指将粗盐中含有泥沙等不溶性杂质,用过滤的方法除去,然后蒸发水分得到较纯净的精盐的过程.具体的操作步骤、方法如下:1.溶解:用托盘天平称取5.0g粗盐,用量筒量取10mL水倒入烧杯里.用药匙将该粗盐逐渐加入盛有10mL水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止.观察所得食盐水是否浑浊.然后,在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤:如图,过滤该食盐水.待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色.如滤液仍浑浊,应该再过滤一次.如果经两次过滤滤液仍浑浊,则应检查装置并分析原因(例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等).找出原因后,要重新操作.

3.蒸发:把所得澄清滤液倒入蒸发皿.如图,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液(使液体均匀受热,防止局部过热,造成液滴飞溅).待蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.

4.计算产率:用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器中.将提纯前后食盐与粗盐作比较,并计算精盐的产率.
1.6.5 水的净化
水的净化是指将自然界中含有许多可溶性和不溶性杂质,常呈浑浊状态的水,可通过各种途径净化处理的过程.具体如下表所示:

1.7 水资源的利用、开发和保护
1.7.1 我国应对水资源短缺
1.应对水资源短缺的措施:充分利用当地的水资源;节约用水;避免浪费和污染水资。
应对我国水资源时间分布不均:兴建水库
应对我国水资源空间分布不均:跨流域调水
2.我国严重缺水的地区为:华北地区和西北地区。
为缓解北方地区严重缺水的状况,我国实施了南水北调、引黄入晋、引滦入津等跨流域调水工程。
1.7.2 水资源的污染与防治
水资源的污染是指大量污染物质排入水体,超过水体的自净能力(即受污染的水体在物理、化学和生物作用下逐渐自然净化,水质复原的过程)使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况.水资源的污染来源主要有工业污染、农业污染和生活污染三个部分.具体的污染来源及危害,如图所示:
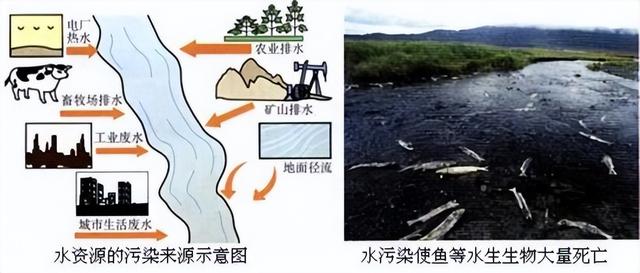
其中,工业污染主要是指工业上未经处理的废水、废物;农业污染主要是指农业上的农药、化肥的不合理施用;生活污染就是指生活污水的任意排放及使用了含磷的洗衣粉或洗涤剂等.
水资源污染的防治:水资源污染后,不仅影响工农业、渔业生产,破坏水生生态系统,还会直接危害人体健康.因此必须采取各种措施,预防和治理水污染,保护和改善水质.例如,工业上,加强对水质的监测,通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准;农业上,提倡使用农家肥,合理施用化肥和农药;生活上,少用、甚至不用含磷的洗衣粉或洗涤剂等,生活污水也应该逐步实现集中处理和排放.
1.7.3 水资源的利用与保护
人类对水的需求主要表现在生活用水、工业用水和农业用水等方面。
随着人口的增长,城市化、工业化以及灌溉对水的需求日益增加,21世纪将出现许多用水紧缺问题。在可供淡水有限的情况下,应积极采取措施保护宝贵的资源.一般采取以下几种措施。
1.提高水的利用效率,开辟第二水源
这是目前解决水资源紧张的重要途径,主要方法有:
(1)降低工业用水量,提高水的重复利用率
(2)实行科学灌溉,减少农业用水浪费
(3)回收利用城市污水、开辟第二水源
2.调节水源流量,增加可靠供水
前述水资源紧张的第一个原因是自然条件的影响,如气候、地理位置,淡水分布不均匀等问题.人们试图通过调节水源流量、开发新水源的方式加以解决
(1)建造水库
(2)跨流域调水
(3)地下蓄水
(4)海水淡化
(5)拖移冰山
(6)恢复河、湖水质
(7)合理利用地下水。地下水是极重要的水资源之一,其储量仅次于极地冰川,比河水、湖水和大气水分的总和还多。但由于其补给速度慢,过量开采将引起许多问题.在开发利用地下水资源时,应采取以下保护措施:
①加强地下水源勘察工作,掌握水文地质资料,全面规划,合理布局,统一考虑地表水和地下水的综合利用,避免过量开采和滥用水源;
②采取人工补给的方法,但必须注意防止地下水的污染;
③立监测网,随时了解地下水的动态和水质变化情况,以便及时采取防治措施。
3.加强水资源管理
为加强水资源管理,制定合理利用水资源和防止污染的法规;改革用水经济政策。如提高水价、堵塞渗漏、加强保护等。提高民众的节水意识,减少用水浪费严重和效率低的状况。
4.增加下水道建设,发展城市污水处理厂
欧美等国从长期的水系治理中认识到普及城市下水道,大规模兴建城市污水处理厂,普遍采用二级以上的污水处理技术,是水系保护的重要措施。
2 天气与气候
2.1 大气层
2.1.1 大气与大气分层
1.大气主要集中在地表以上1000千米左右的高度内。
2.大气温度垂直分布的特点:
|
高度 |
温度分成特点 |
|
从地面到12千米处 |
温度随高度升高而下降 |
|
12千米到55千米 |
温度随高度升高而升高 |
|
55千米到85千米 |
温度随高度升高而下降 |
|
85千米以上 |
温度随高度升高而升高 |
3.大气的分层:对流层、平流层、中间层、暖层和外层五层。
2.1.2 对流层
对流层集中了地球月四分之三的大气质量和几乎全部的水汽、固体杂志。
对流层的特点:
气温下面高、上面低,容易发生空气对流。
在近地面,气温高的地方空气呈上升运动,气温低的地方空气呈下沉运动。
天气现象复杂多变,云、雨、雪、雷电等主要的天气现象都发生在这一层。
2.2 气温
2.2.1 天气与气候
1.天气是一个地区短时间里的大气状况,它是时刻变化的。
天气与我们的生产生活、农业、交通、军事都息息相关。
2.气候是一个地区一段时间内天气的平均状况,一般变化不大。
天气是形成气候的基础。
2.2.2 气温及气温变化
气象学上把表示空气冷热程度的物理量称之为空气温度,简称气温.国际上标准气温度量单位是摄氏度(∘C)。
在气象观测中,温度计通常放在一个漆成白色的百叶箱里。
气温日变化:
一天之中,陆地最高气温出现在午后2时左右;最低气温出现在日出前后。 一天之中,最高气温与最低气温的差叫作气温日较差。
气温年变化:
一年之中,北半球气温,大陆上7月最高,1月最低;海洋上8月最高,2月最低。南半球正好相反。 一年中最高月平均气温与最低月平均气温的差叫做气温年较差。
2.2.3 平均气温
1.平均气温
指某一段时间内,各次观测的气温值的算术平均值。根据计算时间长短不同,可有某日平均气温、某月平均气温和某年平均气温等。
2.平均气温计算方法
①某日平均气温:是指一天24小时的平均气温。气象学上通常用一天2时、8时、14时、20时四个时刻的平均气温作为一天的平均气温(即四个气温相加除以4)。
②某月平均气温:某一月的多日平均气温的平均值。
③某年平均气温:将某年的多日平均气温(或多月平均气温)的平均值。
2.2.4 气温变化曲线
气温变化曲线是用来直观统计地区气温变化规律的图象,是用来表示气温高低变化的线条。
根据气温变化曲线的走势特点,人们可以很方便的得出气温的最高值和最低值,以及确定气温变化的剧烈程度。还可以总结出一个地区确定时段的变化特点,为人们的日常生活和生产活动提供相应的参考。在经常使用的场合中,主要用到气温日变化曲线,气温月变化曲线,气温年变化曲线等。
2.3 大气的压强
2.3.1 大气压强产生的原因及定义
产生原因:空气像液体一样受到重力作用,且具有流动性,因此,大气内部向各个方向都有压强.
定义:大气对浸在它里面的物体的压强叫大气压强,简称大气压.
2.3.2 大气压强的测量
测量工具
测量大气压的仪器叫气压计.常用的有水银气压计和金属盒气压计等.
水银气压计测量准确,但不易携带,常用于气象站和实验室.金属盒气压计又叫无液气压计,可以改造成高度计,携带方便.
托里拆利实验
1.大气压强的值可以用托里拆利实验准确测量.
2.托里拆利实验中,管内、外水银面的高度差与管的粗细及管是否倾斜无关,只与当时的大气压值有关.所以把托里拆利管倾斜、向上提向下压、变粗或变细,管内、外水银面的高度差将不变,测量的大气压值也不变.

这个实验测得的水银柱高度约为760mm.通常把这样大小的大气压叫做标准大气压,用p0表示.
p0=ρgh=1.36×104kg/m3×9.8n/kg×0.76m=1.013×105Pa
2.3.3 影响大气压强的因素
1.大气压强是由于大气层受到重力作用而产生的,离地面越高的地方,大气层越薄,大气压强越小.在海拔三千米以内,大约每升高10m,大气压强就减小100Pa,利用这个近似的规律可以测量某地的海拔高度.
2.大气压强还会随着湿度,温度,季节等因素的变化而变化.
2.3.4 流体压强定义及流速
流体:物理学把具有流动性的液体和气体统称为流体.
液体压强和流速的关系:在气体和液体中,流速越大的位置,压强越小.
2.3.5 气体压强与流速的关系
气体压强和流速的关系
1.在物体表面的空气的流速越大,物体受到的压强越小;物体表面的空气流速越小,物体表面所受的压强越大.
2.对同一物体来说,物体相对的两个表面受到的压强不同时,它们受到的压力也不同,物体就会向压强较小的一方移动.
2.4.1 风
风是从高气压区流向低气压区。
风的两个基本要素:风向和风速
1.风向:风的来向,天气预报常用8种风向。
2.风速:单位时间内空气流动的距离,风速常用风级表示。
3.气象观察中是用风向标和风速仪来观测风向和风速的。
2.4.2 风的表示
风向:风的来向,天气预报常用8种风向。
风级:风的强弱等级,共分为18级,级数越大,风力越强。
天气图上风的表达:

2.4.3 降水、降水量的测定
1.从大气中降落的雨、雪、冰雹等,统称为降水。
2.降水量是衡量一个地区降水多少的数据。测定降水量的基本仪器是雨量器。它的外部是一个不漏水的铁筒,里面有承水器、漏斗和储水瓶,另外还配有与储水瓶口径成比例的量杯。有雨时,雨水过漏斗流入储水瓶。量雨时,将储水瓶取出,把水倒入量杯内。从量杯上读出的刻度数(毫米)就是降水量。
冬季降雪时,要把漏斗和储水瓶取走,直接用承雪口和储水筒容纳降水。测定降水量时,把储水筒取出带到室内,待筒内的雪融化后,倒在量杯里,再读取降水量数字。还有另外一些测定降水量的仪器,原理和上述的一样,增加了自记装置和传递信息的装置,可以直接读数。
2.4.4 降水的条件
1.产生降水的主要过程有:
①天气系统的发展,暖而湿的空气与冷空气交汇,促使暖湿空气被冷空气强迫抬升,或由暖湿空气沿锋面斜坡爬升。
②夏日的地方性热力对流,使暖湿空气随强对流上升形成小型积云雨和雷阵雨。
③地形的起伏,使其迎风坡产生强迫抬升,但这是一个比较次要的因素。多数情况下,它和前两种过程结合影响降水量的地理分布。
2.形成降水的条件有三个:
一是要有充足的水汽;
二是要使气块能够抬升并冷却凝结;
三是要有较多的凝结核。
降水是地面从大气中获得的水汽凝结物。它包括两部分,一是大气中水汽直接在地面或地物表面及低空的凝结物;另一部分是由空中降落到地面上的水汽凝结物。降水的类型根据降水形成原因,可分为锋面雨、对流雨、地形雨、台风雨。
2.5 天气预报
2.5.1 天气图
1.天气图上的曲线叫做等压线,它是气压相等的地方的连线。
2.根据等压线的分布特点可以分析出常见的天气系统,如高压、冷锋等。
3.锋是影响天气的重要天气系统,冷暖空气的交界面叫锋面。
向暖空气一侧移动的锋叫冷锋,常带来降雨、大风和降温天气;
向冷空气一侧移动的锋叫暖锋,常带来降雨天气,气温升高。
2.5.2 常用天气符号
常用天气符号

2.5.3 卫星云图和天气预报
由气象卫星自上而下观测到的地球上的云层覆盖和地表面特征的图象。各种不同尺度天气系统的云区和各种不同的地表特征,在这种图象上都有其特定的色调、范围大小和分布形式。利用卫星云图可以识别不同的天气系统,确定它们的位置,估计其强度和发展趋势,为天气分析和天气预报提供依据。在海洋、沙漠、高原等大片缺少气象观测台站的地区,卫星云图所提供的资料,弥补了常规探测资料的不足,这对提高预报准确率起了重要作用。

天气预报是气象工作者使用现代科学技术对未来某一地点地球大气层的状态进行预测,发布将要出现的天气状况,主要包括气温、阴天或晴天、降水的可能性、降水的强度、风力的大小、空气的能见度等。
从史前人类就已经开始对天气进行预测来相应地安排其工作与生活(比如农业生产、军事行动等等)。现在的天气预报主要是使用收集大量的数据(气温、湿度、风向和风速、气压等等),然后使用目前对大气过程的认识(气象学)来确定未来空气变化。由于大气过程的混乱以及现在科学并没有最终透彻地了解大气过程,因此天气预报总是有一定误差的。
2.5.4 空气质量及其评价方式
1.空气质量是依据空气中污染物浓度的高低来判断的,空气质量的好坏反映了空气污染程度。来自固定和流动污染源的人为污染物排放大小是影响空气质量的最主要因素之一,其中包括车辆、船舶、飞机的尾气、工业企业生产排放、居民生活和取暖、垃圾焚烧等。城市的发展密度、地形地貌和气象等也是影响空气质量的重要因素。
2.空气污染指数(AIRPOLLUTIONINDEX,简称API)是一种反映和评价空气质量的方法,就是将常规监测的几种空气污染物的浓度简化成为单一的概念性数值形式、并分级表征空气质量状况与空气污染的程度,其结果简明直观,使用方便,适用于表示城市的短期空气质量状况和变化趋势.空气污染指数是根据环境空气质量标准和各项污染物对人体健康和生态环境的影响来确定污染指数的分级及相应的污染物浓度限值。
3.根据空气质量指数API的不同,可将空气质量分级如下:0∼50为优;51∼100为良,101∼200为轻度污染,201∼300为中度污染,>300为重度污染。
2.6 气候和影响气候的因素
2.6.1 影响气候的主要因素
影响气候的主要因素:纬度位置、海陆分布和地形是影响气候的主要因素。
1.纬度位置是影响气候的基本因素.纬度不同的地方,太阳照射的角度就不一样,有的地方直射,有的地方斜射,有的地方整天或几个月受不到阳光的照射。因此,各地方的太阳高度角不同,接受太阳光热的多少就不一样,气温的高低也相差悬殊.一般是纬度越低,气温越高;纬度越高,气温越低.各地区所处的纬度位置不同,是造成世界各地气温不同的主要原因。
2.大气环流是形成各种气候类型和天气变化的主要因素。大气环流对气候的影响十分显著,赤道低气压带上升气流强烈,水汽易于凝结,降水丰富;副热带高气压带下沉气流盛行,水汽不易凝结,雨水稀少;在信风带气流从纬度较高的地区流向低纬度地区,水汽不易凝结,一般少雨.但在大陆东岸,信风从海上吹来,降水机会较多;在大陆西岸,信风从内陆吹来,降水就少。在西风带控制的地区,大陆西岸风从海上吹来,水汽充沛,降水丰富,越向内陆水汽越少,降水减少;大陆东岸,西风从内陆吹来,降水较少。一般说来,上升气流和从低纬度流向高纬度的气流,气温由高变低,水汽容易凝结,降水机会较多;下沉气流和从高纬度流向低纬度的气流,气温由低变高,水汽不易凝结,降水机会就少。因此,在不同气压带和风带控制下,气候特征,尤其是降水的变化有显著的差异。加之风带和气压带随季节的移动,从而形成各种不同的气候类型。
3.地形的起伏能破坏气候分布的地带性。地形是一个非地带性因素,不同的地形对气候有不同的影响。在同一纬度地带,地势越高,气温越低,降水在一定高度的范围内,是随高度的升高而增加。因此,在热带地区的高山,从山麓到山顶,先后出现从赤道到极地的气候变化。另外,高大的山脉可以阻挡气流的运行,山脉的迎风坡和背风坡的气温与降水有明显的差异。
2.6.2 等温线判读
气温的水平分布常用等温线图来表示。在等温线图中,同一条等温线上各点的气温相等。
同一幅等温线图上,相邻两条等温线之间的数值差为零或相差一个等温距。
疏密程度:一般情况,等温线密集,温差较大;等温线稀疏,温差较小。
等温线呈封闭形状,中心气温低,表示这里是低温中心;反过来,就是高温中心。
2.6.3 我国气温特点
1.冬季南北温差大
大部分地区1月平均气温由南向北逐渐降低,1月0∘C等温线大致沿秦岭—淮河一线分布。
2.夏季普遍高温
大部分地区7月平均气温20∘C以上,只有青藏高原等少数地区,气温相对较低。
2.6.4 世界气温的分布规律
世界气温分布规律有三条:
①从纬度位置看:从低纬度向两极气温逐渐降低;
②从海陆位置看:同纬度的海洋和陆地气温并不一样,夏季陆地气温高,冬季海洋气温高;
③从海拔高度看:地势越高气温越低,海拔每升高100米气温下降0.6∘C。
2.6.5 季风
季风是在大范围区域,冬、夏季盛行,风向相反或近于相反的风。
冬季,亚欧大陆气温低,太平洋气温高,盛行偏北风(寒冷干燥)。
夏季;亚欧大陆气温高,太平洋气温低,盛行偏南风(温暖湿润)。
2.6.6 气候与人类活动的关系
人类活动是全球气候系统中的重要成员之一,也是气候变化的一个重要影响因素。
由于气侯变化而引起的海平面升降、农业和粮食的供给、环境污染、生态系统变化、淡水资源以及人类健康等方面的影响问题最受关注。
人类活动引起的温室效应增强,是目前最为重要的全球环境问题之一。
气候对人类的影响。
1.对人类与自然的影响
由于生态系统和人类社会已经适应今天以及最近过去的气候,因此,如果这些变化太快使得生态系统和人类社会不能适应的话,人们将很难应付这些变化。对于许多发展中国家,这可能会对基本的人类生活标准(居住、食物、饮水、健康)产生非常有害的影响。对于所有的国家,极端天气气候事件发生频率的增加将会增大天气灾害的风险.气候变化对我国经济社会的影响有正面的,也有负面的影响,其中一些变化实际上是不可逆转的,因此我们更要关注的是负面影响.据统计,1950年到2000年,特别是1990年以后气象灾害造成的经济损失急剧增加。原因有两个,一方面极端天气事件的增多,另一方面我国总体经济体量增加,因此经济损失绝对值大幅升高。
2.对农业的影响
预计到2030年,我国三大作物,即稻米、玉米、小麦,除了浇灌冬小麦以外,均以减产为主。气候变化对水资源的影响也很大,全球变暖使水循环的过程速度加快,降水的空间不均匀性增加。气候变化对重大工程也有影响,如长江上游降水量的增加,导致地质灾害的频率会增加,对三峡水库的安全运营会造成一定的影响。另外气候变化也会影响青藏铁路和公路,大大增加铁路和公路运行维护的投资。
3.环境的影响
同全球一样,我国的气候与环境已经发生了巨大的变化。气候变暖远远超出一般意义上的气候问题和环境问题,对我国经济社会发展已经带来十分严峻的威胁,这种威胁仍将持续并不断加剧。科技界应当特别关注气候变化问题,积极采取适应和减缓措施,不断提升气候系统、生态、环境保护的层次和水平,这是全面落实科学发展观,建立社会主义和谐社会的重要内容,是政府、公众和科学家的共同愿望。
2.6.7 “热岛”效应
人类活动使城市形成了一种气温较高、湿度较低、雾霾增多的特殊天气,称为城市“热岛“现象。
2.7 我国的气候特征与主要气象灾害
2.7.1 气候复杂多样和主要气候类型
1.中国的气候复杂多样,主要气候类型:

2.我国是世界上气候类型最多的国家之一。我国东半部有大范围的季风气候,自南而北有热带季风气候、亚热带季风气候、温带季风气候。西北地区大多为温带大陆性气候。青藏高原区是独特的高原气候。
2.7.2 降水量柱状图及其应用
降水量柱状图是直观刻画一个地方气候降水分配状况的统计图。它一般是先充分拥有气候统计资料。
例如一个地方各月的降水量数据。再根据其数据利用坐标图进行绘制。其步骤是先绘制好横坐标刻画出月份,再绘制出纵坐标,代表降水量。再利用统计数据分月绘制出柱状图。
从直观地降水量柱状图上可以看出降水集中月份,降水较少季节,各月降水量分配是否均匀,还可结合气温分配特点和降水分配特点,表达出是哪个半球的地方降水量。其形态在不同地区,结合气温分布,有不同的形态。
2.7.3 等降水量线图
一般是指在地图上,将同一时间里降水量相同的各点连接起来的线,由等降水量线组成的地图,就是等降水量线图。它可分日等降水量线,月等降水量线,年等降水量线。在中国年等降水量地图上,可以明显看到三条鲜明的等降水量线,代表了中国特别的地理意义。
1.可判断地区降水分布差异
其意义是看,等降水量线密集处,说明降水的地区分布差别大。反之,等降水量线稀疏处,说明降水的地区分布差别小。
2.可判断海陆影响
等降水量线大致与海岸线平行,且自沿海向内陆递减,说明降水量受海陆因素影响明显。
3.可判断地形作用
等降水量线大致与山脉走向平行,说明降水量受地形(山脉)影响大。山脉迎风坡,降水量大;山脉背风坡,降水量小。
4.可判断内陆地形
等降水量线呈封闭曲线,且降水少,再结合地理位置看,说明地形地势起作用,或者深居内陆位置。
2.7.4 世界降水分布的差异
世界降水分布差异的原因:
1.受纬度位置因素的影响,赤道地区降水多,两极地区降水少;
2.受海陆位置因素的影响,大陆内部降水少,沿海地区降水多;
3.受地形因素的影响,迎风坡降水多,背风坡降水少。
世界的雨极和干极:世界的雨极是乞拉朋齐,位于亚洲的印度。世界的干极是阿塔卡马沙漠,位于南美洲。
2.7.5 我国东西降水的差异
1.我国降水的空间分布很不均匀,年降水量分布的总趋势是从东南沿海向西北内陆递减。
2.根据气候的干湿状况,我过分为湿润、半湿润、半干旱、干旱四类地区。

2.7.6 我国西部的干旱气候
我国西北内陆干旱、半干旱地区降水量少,降水变化大。冬寒夏热,气温的日较差和年较差大,但日照充沛。
这种气候特点是西部干旱地区的一项重要资源。吐鲁番的瓜果特别甜,就和该地日照时间特别长且昼夜温差大有关。
2.7.7 寒潮、台风和洪水
我国地域辽阔,自然环境复杂多样,自然灾害种类多,分布广,属于典型的季风气候区,因此灾害性天气种类繁多,不同地区又有很大差异。
主要的自然灾害有:
寒潮:是大范围的强烈冷空气活动,会带来剧烈的降温、霜冻、大风和扬沙天气。
台风:是一种破坏力很大的灾害性天气。台风中心叫做台风眼,台风眼外侧100千米左右的地区是狂风暴雨区。主要分布在我国东南沿海地区。
洪涝灾害:持续性的暴雨、台风是引发洪水的主要自然因素,人类活动也会引发洪涝灾害。
3 生命活动的调节
3.1 植物生命活动的调节
3.1.1 植物常见的感应性
植物常见的感应性:植物感受刺激并作岀反应的特性。1.植物感应性的表现形式有:(1)向性运动:植物受到单一方向刺激而引起的定向运动,运动方向与剌激的方向有关。
如:植物的向光性;根的向地性;茎的背地性;向水性;向肥性;牵牛花、葡萄等的卷须接触到竿棍就会缠绕;向日葵朝向太阳。(2)感性运动:植物受到不定向的刺激而引起局部运动,运动方向与剌激方向无关。如:含羞草受到触碰叶子合拢;捕蝇草、猪笼草的捕食运动;凤凰木、酢浆草因光照温度改变:叶片白天张开,夜晚或雨天闭合下垂;郁金香、番红花温度升高时开放,降低时闭合。
3.1.2 植物激素
1.植物激素:对植物生命活动产生显着调节作用的微量有机物。
|
激素名称 |
主要作用 |
|
生长素 |
加快细胞生长速率 |
|
赤霉素 |
促进细胞伸长;促进种子萌发和果实发育 |
|
细胞分裂素 |
促进细胞分裂 |
|
脱落酸 |
抑制细胞分裂,促进叶和果实的衰老和脱落 |
|
乙烯 |
促进果实成熟 |
2.植物的向光性和生长素。
(1)产生部位:胚芽尖端(2)产生原因:单侧光照射下,生长素分布不均匀 。
背光面生长素分布多 ,胚芽生长快 ; 向阳面生长素分布少 ,胚芽生长慢 。

(3)缺点:生长素浓度较大时,会抑制植物的生长,甚至使植物死亡,应用于防治杂草。
3.1.3 植物的向光性探究
1.达尔文的向光性探究实验
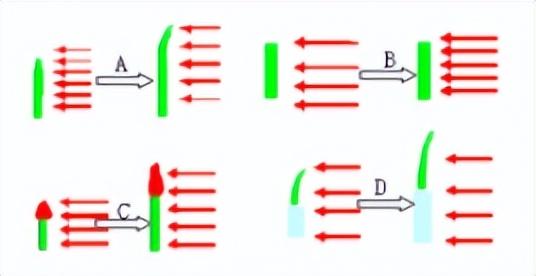
(1)图表明胚芽受到单侧光照射时,会向光源弯曲生长。(2)图表明如果切去胚芽尖端部分,发现胚芽不生长也不弯曲。(3)图中将胚芽的尖端用一个不透光的锡箔小帽罩起來,发现胚芽竖直生长。(4)如果胚芽的基部用锡箔包起来,发现胚芽向光源弯曲生长。猜想:在单测光的照射下,胚芽的尖端可能会产生某些物质,且这种物质会对植物生长产生影响。2.温特的实验:

(1)第一组实验中a琼脂接触过胚芽的尖端,发现这个胚芽会向放琼脂的对侧生长。(2)第二组实验中b琼脂没有接触过胚芽的尖端,发现这个胚芽不生长也不弯曲。表明:胚芽的尖端确实产生了某种物质,能够控制植物的生长。(3).植物向光性:观察现象,胚芽弯向光源生长。
3.2 人体的激素调节
3.2.1 人体的主要内分泌腺
人体的主要内分泌腺
人体内的内分泌腺有多种,主要有垂体、甲状腺、胸腺、肾上腺、胰岛、性腺等,它们共同组成了人体的内分泌系统。内分泌腺没有导管,他们的分泌物——激素,直接进入腺体内的毛细血管,并随着血液循环输送到全身各处。

1.垂体垂体悬垂于脑的底部,分泌生长激素和促激素(如促甲状腺激素、促性腺激素)等,可以增加细胞的体积和数量。促进人体的生长以及调节其他内分泌腺的活动,因而被称为“内分泌腺之首”。2.甲状腺甲状腺是成年人体内最大的一种内分泌腺。位于颈前部,喉和气管的两侧。甲状腺分泌甲状腺激素。甲状腺激素主要调节新陈代谢、生长、发育等生命活动。3.胸腺胸腺位于胸骨下,能分泌促淋巴细胞生成作用的物质,在人体抵御疾病方面具有重要作用。4.胰岛胰岛是胰腺的内分泌部。人体胰腺中约有25万~200万个胰岛,占整个胰腺重量的1%~2%。胰岛能分泌胰岛素,有降低血糖浓度的作用。特别提醒:胰腺的外分泌部能分泌消化液--胰液,属于外分泌腺;内分泌部--胰岛能分泌胰岛素,属内分泌腺。所以,胰腺既属于外分泌腺,也属于内分泌腺。5.肾上腺肾上腺位于肾脏的上端,左右各一个。肾上腺能分泌肾上腺素,该激素会促使心跳加快、血压升高。6.性腺性腺在男性体内为睾丸,在女性体内为卵巢。(1)睾丸能分泌雄性激素。雄性激素有促进精子生成、促进男性生殖器官发育并维持其正常活动,激发和维持男性第二性征等作用。(2)卵巢能分泌雌性激素和孕激素。雌性激素能促进女性生殖器官、乳腺导管发育,激发并维持女性第二性征;孕激素能促进子宫内膜增厚和乳腺发育。
3.2.2 生长激素的作用及其内分泌腺分泌异常时的症状
生长激素的作用及其内分泌腺分泌异常时的症状
1.分泌功能:调节人体生长发育
2.分泌部位:垂体
3.异常症:
(1)幼年时分泌不足——侏儒症
(2)幼年时分泌过多——巨人症
(3)成年时分泌过多——肢端肥大症
3.2.3 甲状腺激素的作用及其内分泌腺分泌异常时的症状
甲状腺激素的作用及其内分泌腺分泌异常时的症状
1.分泌功能:促进新陈代谢,促进生长发育,提高神经系统的兴奋性
2.分泌部位:甲状腺
3.异常症:
(1)分泌过多→甲状腺功能亢进(甲亢)
(2)成年时分泌不足→黏液性水肿
(3)饮食缺碘→甲状腺激素分泌不足→地方性甲状腺肿(大脖子病)
(4)分泌不足:引发呆小症
3.2.4 肾上腺素的作用及其内分泌腺分泌异常时的症状
肾上腺素的作用及其内分泌腺分泌异常时的症状
1.分泌功能:是一种应急激素,当人经历某些刺激(例如兴奋,恐惧,紧张等)时分泌出这种激素,能让人呼吸加快(提供大量氧气),心跳与血液流动加速,瞳孔放大,为身体活动提供更多能量,使反应更加快速;使糖、脂肪分解速度加快,提高血糖浓度。
2.分泌部位:肾上腺
3.异常症:肾上腺素水平升高可导致血压升高,心律失常(期前收缩,心率增快。可导致肠蠕动及张力减弱,可引起便秘。也可引起易激惹,易发怒,不能控制好情绪等精神上的问题。
3.2.5 胰岛素的作用及其内分泌腺分泌异常时的症状
胰岛素的作用及其内分泌腺分泌异常时的症状1.分泌功能:调节糖代谢,促进糖原的合成。加速血糖分解,降低血糖浓度。2.分泌部位:胰腺内的胰岛
3.异常症:分泌不足→糖尿病。人体内胰岛素分泌不足时,血糖合成糖元和血糖分解的作用就会减弱,结果会导致血糖浓度升高而超过正常值,一部分血糖就会随尿排出体外,形成糖尿病。
4.胰岛素与血糖含量血糖:血液中的葡萄糖,正常含量为:90亳克/100毫升。(1)血糖的升降,决定于胰岛素分泌的增加或减少。血糖含量升高,胰岛素分泌增加,使血糖含量降低;血糖含量降低,胰岛素分泌减少,使血糖含量升高。(2)胰岛素分泌异常的病症。胰岛素分泌不足:糖尿病。血糖含量高于正常值。治疗方法:定时注射胰岛素。(不能口服胰岛素。会被消化)胰岛素分泌过多:低血糖症。血糖含量低于正常值。治疗方法:多吃糖类物质,补充血糖,药物调节胰岛素分泌。

3.2.6 性激素的作用及其内分泌腺分泌异常时的症状
性激素的作用及其内分泌腺分泌异常时的症状
1.分泌功能:分别促进雌雄生殖器官的发育和生殖细胞的生成,激发和维持各自的第二性征。
(1)雄性激素有促进精子生成、促进男性生殖器官发育并维持其正常活动,激发和维持男性第二性征等作用。
(2)雌性激素能促进女性生殖器官、乳腺导管发育,激发并维持女性第二性征,激发和维持雌性正常性周期。
2.分泌部位:性腺
3.异常症:雄、雌性激素分泌不足,表现为性器官萎缩,第二性征减退,性周期不正常。
3.2.7 体液调节
1.体液调节是指体内的一些细胞能生成并分泌某些特殊的化学物质(如激素、代谢产物等),经体液(血液、组织液等)运输,达到全身的组织细胞或某些特殊的组织细胞,通过作用于细胞上相应的受体,对这些细胞的活动进行调节。主要形式是激素调节。
2.传递方式:通过体液运输,主要是指细胞外液。
3.3 神经调节
3.3.1 人体神经系统的组成和功能
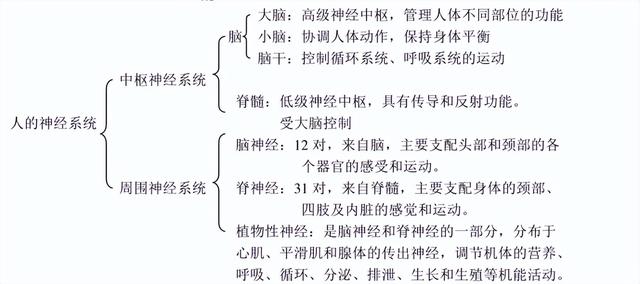
人体神经系统的组成和功能1.神经系统的组成:人体神经系统是由脑、脊髓和它们所发出的神经组成的。其中,脑和脊髓是神经系统的中枢部分,组成中枢神经系统;脑神经和脊神经是神经系统的周围部分,组成周围神经系统。神经系统的组成可概括为:
2.神经元:神经元又叫神经细胞,是神经系统结构和功能的基本单位。
3.脊髓:脊髓位于脊柱的椎管内,上端与脑相连,下端与第一腰椎下缘平齐。脊髓是脑与躯体、内脏之间的联系通道。
(1)脊髓的结构:从脊髓的横切面可以看出,脊髓包括灰质和白质两部分。灰质在中央,呈蝶形;白质在灰质的周围。白质内的神经纤维在脊髓各部分之间以及脊髓和脑之间,起着联系作用。(2)脊髓的功能:反射功能:人的脊髓灰质里有许多低级中枢,可以完成一些基本的反射活动,如膝跳反射、排便反射等。但是,脊髓里的神经中枢是受大脑控制的。传导功能:脊髓能对外界或体内的刺激产生有规律的反应,还能将这些刺激的反应传导到大脑。反之,脑的活动也要通过脊髓才能传递到身体各部位。因此脊髓是脑与躯干、内脏之间联系的通道。
4.脑:脑位于颅腔内,包括大脑,小脑和脑干三部分。
(1)大脑:大脑由左、右两个大脑半球组成。大脑皮层是覆盖大脑半球表面的一层灰质,大脑皮层表面具有许多深浅不同的裂或沟以及沟裂之间隆起的回,因而大大增加了大脑皮层的总面积和神经元的数量。大脑皮层是调节人体生理活动的最高级中枢,其中比较重要的中枢有:躯体运动中枢(管理身体对侧骨骼肌的运动)、躯体感觉中枢(与身体对侧皮肤,肌肉等处接受刺激而使人产生感觉有关)、语言中枢(说话、书写、阅读和理解语言有关,为人类特有)、视觉中枢(与产生视觉有关)。(2)小脑:小脑位于脑干背侧、大脑的后下方。小脑的主要功能是使运动协调、准确,维持身体的平衡。人喝酒喝醉了,走路摇晃,站立不稳,这是由于小脑被酒精麻痹而引起的。(2)脑干:脑干灰质中,有一些调节人体基本生命活动的中枢,如心血管运动中枢、呼吸中枢等。如果这一部分中枢受到损伤,会立即引起心跳、呼吸停止而危及生命。
5.周围神经系统:(1)脑神经:与脑相连接的神经叫脑神经。人的脑神经共有12对,它们与脑干中相关的脑神经核相连,穿过颅骨的孔、裂。分布于头部的感觉器官、皮肤、肌肉等处以及内脏器官。(2)脊神经:脊神经是由脊髓发出的,人的脊神经有31对。
3.3.2 神经元的结构和功能
神经元的结构和功能1.神经元:神经元又叫神经细胞,是神经系统结构和功能的基本单位。2.神经元的结构:神经元的基本结构包括细胞体和突起两部分。神经元的突起一般包括一条长而分支少的轴突和数条短而呈树状分支的树突。长的突起外表大都套有一层鞘,组成神经纤维,神经纤维末端的细小分支叫作神经末梢。神经纤维集结成束,外面包有膜,构成一条神经。

3.神经元的分布:神经元的细胞体主要分布在脑和脊髓里。在脑和脊髓里,细胞体密集的部位色泽灰暗,叫灰质。在灰质里,功能相同的神经元细胞体汇集在一起,调节人体的某一项相应的生理功能,这部分结构就叫作神经中枢。神经元的神经纤维主要集中在周围神经系统里。在周围神经系统里,许多神经纤维集结成束,外面包着由结缔组织形成的膜,就成为一条神经。在脑和脊髓里,也有神经纤维分布,它们汇集的部位色泽亮白,叫白质。白质内的神经纤维,有的能向上传导兴奋。有的能向下传导兴奋。4.神经元的功能:神经元受到刺激后能产生兴奋,并且能把兴奋传导到其他神经元。
特别提醒:
(1)神经元的功能是受到刺激后能产生兴奋,并能够将兴奋传导到其他的神经元,这种可传导的兴奋叫神经冲动。兴奋是以神经冲动的形式传导的。
(2神经冲动在神经元中的传导方向是:树突→细胞体→轴突。
3.3.3 脊髓和脑的结构及其功能
脊髓和脑的结构及其功能
1.脊髓:脊髓位于脊柱的椎管内,上端与脑相连,下端与第一腰椎下缘平齐,脊髓是脑与躯体、内脏之间的联系通道。
(1)脊髓的结构:从脊髓的横切面可以看出,脊髓包括灰质和白质两部分。灰质在中央,呈蝶形;白质在灰质的周围,白质内的神经纤维在脊髓各部分之间以及脊髓和脑之间,起着联系作用。
(2)脊髓的功能:
①反射功能:人的脊髓灰质里有许多低级中枢,可以完成一些基本的反射活动,如膝跳反射、排便反射等;但是,脊髓里的神经中枢是受大脑控制的。
②传导功能:脊髓能对外界或体内的刺激产生有规律的反应,还能将这些刺激的反应传导到大脑。反之,脑的活动也要通过脊髓才能传递到身体各部位。因此脊髓是脑与躯干、内脏之间联系的通道。
2.脑:脑位于颅腔内,包括大脑,小脑和脑干三部分。
(1)大脑:大脑由左、右两个大脑半球组成。大脑皮层是覆盖大脑半球表面的一层灰质,大脑皮层表面具有许多深浅不同的裂或沟以及沟裂之间隆起的回,因而大大增加了大脑皮层的总面积和神经元的数量。


大脑皮层是调节人体生理活动的最高级中枢,其中比较重要的中枢有:躯体运动中枢(管理身体对侧骨骼肌的运动)、躯体感觉中枢(与身体对侧皮肤,肌肉等处接受刺激而使人产生感觉有关)、语言中枢(说话、书写、阅读和理解语言有关,为人类特有)、视觉中枢(与产生视觉有关)。

(2)小脑:小脑位于脑干背侧、大脑的后下方,小脑的主要功能是使运动协调、准确,维持身体的平衡。人喝酒喝醉了,走路摇晃,站立不稳,这是由于小脑被酒精麻痹而引起的。(3)脑干:脑干灰质中,有一些调节人体基本生命活动的中枢,如心血管运动中枢、呼吸中枢等;如果这一部分中枢受到损伤,会立即引起心跳、呼吸停止而危及生命。
3.3.4 人体神经调节的基本方式--反射
1.反射指人体通过神经系统,对外界或内部的各种刺激所发生的有规律的反应。神经的基本调节方式是反射。2.反射的类型:根据反射形成的过程可将其分为两类:简单反射(非条件反射)和复杂反射(条件反射)。(1)简单反射简单反射是指生来就有的先天性反射。如缩手反射、眨眼反射、排尿反射和膝跳反射等。它是一种比较低级的神经活动,由大脑皮层以下的神经中枢(如脊髓、脑干)参与即可完成。(2)复杂反射(条件反射)复杂反射是人出生以后在生活过程中逐渐形成的后天性反射。例如,同学们听到上课铃声会迅速走进教室;行人听到身后的汽车喇叭声,就会迅速躲避等。复杂反射(条件反射)是在非条件反射的基础上,经过一定的过程,在大脑皮层的参与下形成的。因此,复杂反射(条件反射)是一种高级的神经活动,而且是高级神经活动的基本方式。
3.3.5 反射弧的结构和功能
反射弧的结构和功能1.反射弧:(1)反射弧是指完成反射的神经结构,反射的结构基础是反射弧。(2)反射弧的组成:反射弧包括感受器、传入神经、神经中抠、传出神经、效应器五部分。如图:

①感受器:由传入神经末梢组成,能接受刺激产生兴奋。②传入神经:又叫感觉神经,把外围的神经冲动传到神经中枢里。③神经中枢:接受传入神经传来的信号后,产生神经冲动并传给传出神经。④传出神经:又叫运动神经,把神经中枢产生的神经冲动传给效应器。⑤效应器:由传出神经末梢和它控制的肌肉或腺体组成,接受传出神经传来的神经冲动,引起肌肉或腺体活动。(3)反射弧中神经冲动传导的路线:
感受器→传入神经→神经中枢→传出神经→效应器。

3.3.6 非条件(简单)反射和条件(复杂)反射
根据反射形成的过程可将其分为两类:简单反射(非条件反射)和复杂反射(条件反射)1.简单反射(非条件反射)简单反射是指生来就有的先天性反射。如缩手反射、眨眼反射、排尿反射和膝跳反射等。它是一种比较低级的神经活动,由大脑皮层以下的神经中枢(如脊髓、脑干)参与即可完成。2.复杂反射(条件反射)复杂反射是人出生以后在生活过程中逐渐形成的后天性反射。例如,同学们听到上课铃声会迅速走进教室;行人听到身后的汽车喇叭声,就会迅速躲避等。复杂反射(条件反射)是在非条件反射的基础上,经过一定的过程,在大脑皮层的参与下形成的。因此,复杂反射(条件反射)是一种高级的神经活动,而且是高级神经活动的基本方式。
3.3.7 人类神经活动的特征
1.由具体刺激(如食物的形状和气味,外界的声、光等)引起的条件反射,是人和动物都具有的反射活动。如:嗅到食物的气味分泌唾液。
2.由抽象刺激(文字、图画、语言等)引起的条件反射,它是人类特有的,与人类的语言中枢密切有关。如:听到人说青杏就会分泌唾液,“谈虎色变”等。
3.3.8 神经系统的卫生保健
神经系统的保健措施:1.体育锻炼,对神经系统影响:通过调节会使自身得到锻炼,使神经系统功能进一步完善;改善脑的营养,使脑功能增强。
2.积极的休息是用一种活动替换另一种活动。这样可以使大脑皮层各部分得到交替活动和休息。3.睡眠几乎对整个大脑皮层和某些皮层以下中枢有保护性抑制作用,它使脑的功能得到最大限度的恢复。4.善于用脑,注意劳逸结合、动静交替,还要变换脑力活动的内容,勤于用脑,注意遇事多想多问、先想后问,可以使神经系统充分发挥作用,使人的思维更敏捷,记忆更深刻。5.烟中的烟碱等毒物,对神经系统有损害。长期吸烟,还能使人的记忆力和注意力降低。6.神经系统的正常运转是我们生活和学习的基础,我们应当好好地珍惜它、呵护它。(1)要善于用脑:学习时要精力高度集中,讲究方法,有劳有逸,提高学习效率。(2)要勤于用脑:大脑皮层的信息贮存量是巨大的,学习要积极主动,勤于思考,遇事要多想多问,不要懒于动脑。青少年要树立正确的人生观,使自己成为勤于学习、积极进取、有所作为的人,体现出自己人生的价值,要多为他人、集体和国家着想,待人处事心胸宽广,这样使大脑的幸福和抑制保持平衡,有助于神经系统的健康和调节功能的增强。
3.3.9 激素调节与神经调节共同作用
激素调节与神经调节的关系1.激素调节和神经调节:人体的生命活动主要受神经系统的调节,但也受激素调节的影响。在神经系统的调节控制下,激素通过血液循环也参与调节人体的生命活动。例如,当你突然发现眼前有蛇时,你会感到心脏怦怦乱跳;当你的情绪激动时,你的大脑皮层会特别兴奋,并通过支配肾上腺的神经促使肾上腺分泌较多的肾上腺素等。这些激素能促使心跳加快、血压升高,并且使皮肤因血管扩张而显得面红耳赤。此外,新陈代谢的产物,如二氧化碳,对人体的生理功能也有调节作用。当血液里的二氧化碳的含量增多时,会刺激神经系统的呼吸中枢,使呼吸运动加快,如打哈欠。2.特别提醒:人体生命活动的调节方式主要有神经调节和体液调节两大类,体液调节主要是激素调节,其中神经调节具有主导作用(主要方式),神经调节具有反应快、持续时间短的特点,而激素调节具有反应慢、持续时间长的特点,两者的作用是相互联系、相互影响的。
3.4 动物的行为
3.4.1 动物行为的类型和特点
动物行为的类型和特点
1.动物的行为:
动物在其生活过程中。所进行的一系列有利于它们存活和繁殖后代的活动,称为动物的行为,如取食行为、防御行为、繁殖行为、迁徙行为、攻击行为等。
2.先天性行为和学习行为:
根据动物行为获得的途径可分为先天性行为和后天性行为(后天性行为又称为学习行为)。
(1)先天性行为是动物生来就有的,由动物体内的遗传物质所决定的行为,如蜘蛛结网等。
(2)学习行为是在体内的遗传因素的基础上,通过环境因素的作用,由生活经验和学习而获得的行为,如小狗做算术题等。
3.根据动物行为功能的分类:
|
类型 |
概念 |
作用 |
示例 |
|
觅食行为 |
指动物获取营养的各种活动,包括寻找、获取、加工、摄入和储食等 |
影响动物的生活分布 |
松鼠储存果实 |
|
繁殖行为 |
动物产生和培养下一代的行为,包括占区、求偶、交配、筑巢、孵卵及抚幼等 |
繁衍后代,并最大限度地保持后代存活 |
家燕筑巢 |
|
攻击行为 |
指间种个体之间由于争夺食物、配偶、巢区或领域而发生的相互攻击行为,双方身体很少受到伤害 |
有利于动物物种优势种群的形成和与其他种群的共存、斗争 |
公鸡相斗 |
|
防御行为 |
是动物由于外来敌害而保护自身或群体中其他个体不受伤害所表现出来的行为 |
有利于个体保存和种族延续,以及种间斗争 |
壁虎断尾 |
|
节律行为 |
指随着自然环境的周期性变化而形成动物行为周期性变化的行为,又称生物钟 |
对于动物获得食物、寻求适宜繁殖场所、避开不良生活环境具有重要作用 |
鸟类的迁徙 |
|
社会行为 |
指同种动物集群活动,相互合作,共同维持群体生活的行为,具有组织性、分工性等特征 |
有利于种群的优化和更好地适应环境、获取食物、对付敌害等 |
蜜蜂中有蜂王、雄峰、工蜂 |
|
通讯行为 |
指动物个体之间利用气味、声音、姿态等形式交流信息的行为 |
有利于动物寻偶、觅食、攻击、防卫等 |
黑长尾猴用不同的叫声表达不同的信息 |
3.4.2 动物的先天性行为和学习行为的区别
动物的先天性行为和学习行为的区别:
根据动物行为获得的途径可分为先天性行为和后天性行为(后天性行为又称为学习行为)。
1.先天性行为是动物生来就有的,由动物体内的遗传物质所决定的行为,如蜘蛛结网等。
2.学习行为是在体内的遗传因素的基础上,通过环境因素的作用,由生活经验和学习而获得的行为,如小狗做算术题等。
3.先天性行为和学习行为的比较:

3.5 体温的控制
3.5.1 变温动物和恒温动物的概念和区别
1.变温动物定义:体温随着外界温度改变而改变的动物,叫做变温动物。如鱼、蛙、蛇、变色龙等。爬行动物、两栖动物、鱼类,它们的体温随外界环境的变化而变化,都属于变温动物。变温动物又称冷血动物,地球上的动物大部分都是变温动物。变温动物并不是需要寒冷,只是因为动物的体内没有自身调节体温的机制,仅能靠自身行为来调节体热的散发或从外界环境中吸收热量来提高自身的体温。当外界环境的温度升高时,动物的代谢率随之升高,体温也逐渐上升,它们便被动地离开不利的环境;当外界环境的温度降低时,动物的代谢率也随之降低,体温也逐渐下降。所以它们或是移向日光下取暖来提高体温,或是钻进地下、洞穴中进行冬眠,或是游向温暖水域。2.恒温动物定义:又叫温血动物。体温不因外界环境温度而改变,始终保持相对稳定的动物,叫做恒温动物。如绝大多数鸟类和哺乳动物。它们的体表大都被毛(羽毛)覆盖,循环路线有体循环和肺循环,体内有良好的产热和散热的结构,所以能维持正常的体温,为恒温动物。恒温动物(温血动物)在动物学中指的是那些能够调节自身体温的动物,它们的活动性并不像冷血动物(变温动物)那样依赖外界温度。鸟和哺乳动物会通过新陈代谢产生稳定的体温。这体现在基础代谢率上。温血动物(恒温动物)的基础代谢率远高于冷血动物(变温动物)。身体的体温调节系统保证体温的恒定,并且能在外界环境升高的状态下排出热量。这通常通过液体的蒸发实现,如人类的汗和狗的喘息,还有猫的舔舐。
3.5.2 产热与散热的平衡
产热与散热的平衡1.恒温动物和人类之所以能够维持稳定的体温,是因为机体的产热 和散热这两个生理过程保持动态平衡的结果。2.产热:(1)在安静时,产生的热量主要来自内脏。(2)在运动时,产生的热量主要来自骨骼肌 。寒冷时,骨骼肌战栗,能使热量一成倍增加。(3)精神活动和进食活动也能—增加产热。(例如寒冷时,想到冰冷的环境,会觉得更冷,使人“发抖”,促使骨骼肌产生更多热)3.散热:(1)散热有皮肤直接散热(90%)和汗液蒸发散热两种方式。(2)直接散热就是通过热传递散热,散热的多少决定于皮肤温度与外界温度的温度差。温度差越大,散热越多。皮肤表面温度又可通过血管中的血流量来控制。外界温度低时,血管收缩,血流量减少,散热 减少;温度高时,血管舒张 ,血流量增加,散热增加。(3)常温下,皮肤汗液的蒸发散热比较少。当外界温度等于或超过体温时,直接散热不能发挥作用,汗液蒸发成了主耍的散热方式。4.中暑:在高温环境中,人体不能及时地发挥体温调节功能,或因过高的环境温度超过了体温调节。
3.5.3 体温受脑控制
1.体温受脑控制(1)人体内的产热和散热过程是通过脑干中下丘脑的体温调节中枢来调节和控制的。气温高时→血液温度升至37摄氏度以上→刺激下丘脑小的热受体→增加汗液分泌、皮肤的血管舒张→增加散热→血温降低回到正常的温度。气温低时→血液温度降至37摄氏度以下→刺激下丘脑中的热受体→战栗和使皮肤的血管收缩→增加产热.减少失热→血温增高回到正常的温度。(2)另一种体温调节:行为性体温调节如狗夏天伸舌头降温等。
4 电路的探秘
4.1 电荷与电流
4.1.1 摩擦起电
摩擦过的物体有了吸引轻小物体的性质,就说明物体带了电.用摩擦的方法使物体带电,叫摩擦起电.
4.1.2 两种电荷及判断是否带电
两种电荷:
自然界存在着两种电荷,用丝绸摩擦过的玻璃棒带正电;用毛皮摩擦过的橡胶棒带负电.同种电荷相互排斥,异种电荷相互吸引.
判断物体是否带电:
1.验电器:检验物体是否带电的仪器.它是根据同种电荷相互排斥的原理制成的.
2.如果已经确定物体带电时,可以直接根据电荷间的作用规律去判断物体带什么电.
3.当不能确定物体是否带电时,如果两个物体相互排斥,一定是都带电,且是同种电荷;如果相互吸引,两物体可能带有异种电荷,也可能只有一个物体带电,而另一个不带电(为轻小物体).
4.1.3 电流的形成
电荷的定向移动形成电流.
4.1.4 电流的方向
1.规定:把正电荷定向移动的方向规定为电流的方向.
2.在电源外部,电流的方向是从电源正极经过用电器流向负极;
在电源内部,电流的方向是从电源负极流向正极.
3.利用发光二极管判断电流的方向.
4.1.5 电路的组成
1.组成:用电器、电源、开关、导线四部分组成.
2.电源是提供电能的装置;
用电器是消耗电能的装置;
开关是控制电路通断的装置;
导线是输送电能的装置.
3.只有电路闭合时,电路中才有电流.
4.1.6 通路、断路、短路
通路:用电器能够工作的电路.
断路:电路中如果某处被切断,电路中就不会有电流流过,这种情况叫断路,也叫开路.
短路:如果电路是接通的,但用电器两端被导线直接连通,这种情况叫该用电器被短路.
1.完全短路:此时会将电源烧坏,甚至引起火灾,这样的短路会使整个电路断路,是绝对不允许的.
2.局部短路:用导线把电路中某一部分两端连接起来,这样电路会部分短路,可以利用这些短路来控制电路.
4.1.7 常见的电学元件及符号

4.1.8 电路图
用符号表示电路连接的图,叫电路图.电路图中的符号是统一规定的,使用电路图的好处是简明直观.
4.1.9 串联电路
定义:用电器首尾依次相连,然后接入电路中,我们说这些用电器是串联的.
特点:
1.电流只有一条路径,无干路、支路之分.电流依次通过每一个用电器,各用电器的工作互相影响,一个用电器因断路停止工作时,所有用电器都不能工作.
2.开关与用电器是串联的,一个开关控制所有用电器.

4.1.10 并联电路
定义:用电器的两端分别连在一起,然后接到电路中,我们说这些用电器是并联的.
并联电路中,没有出现分支的部分叫做干路,各个分支叫做支路.
特点:
1.电流有两条或两条以上的路径,有干路和支路之分.
2.干路电流在“节点”处分成两条或多条支路电流,每一支路都与电源形成一条通路,各支路用电器的工作互不影响.当某一支路开路时,其他之路仍可为通路.
3.干路上的开关控制整个电路的用电器,支路上的开关只控制本支路上的用电器.

4.1.11 判别串联、并联电路的方法
定义法:
如果电路中各元件是逐个顺次首尾相连的,此电路就是串联电路;
若各元件(用电器)“头头相接,尾尾相接”并列地接在电路两点间(“头”即为电流流入用电器的一端,“尾”即为电流流出的那端),此电路就是并联电路.
断路法:
由于串联电路中各用电器互相影响,电路中出现断点或去掉一个元件,电路中所有用电器都会停止工作;
而并联电路中各用电器互不影响,断开一个用电器的控制开关或去掉这个用电器,其他用电器仍能正常工作;
因此断开电路中一用电器,如果所有用电器不能工作就是串联,如果其他用电器仍能正常工作则是并联.
电流法:
电流法是识别串、并联电路的最常用也最实用的方法.
从电源正极开始,沿着电流流向看,电流始终是一条路径,没有分支的电路是串联电路;
电流在分支点分成几只又在会合点会合,造成电路有分有合的电路是并联电路.
节点法:
所谓“节点法”就是识别不规范的电路时,为简化和规范电路,把电路中的“公共点”找出来,即不论导线有多长,只要中间没有电源、用电器等,导线两端均可视为同一个“节点”.从而找出各电路两端的公共点,达到简化(规范)电路的目的.
4.2 电流的测量
4.2.1 电流的定义及单位
定义:电流是表示电流强弱的物理量.
单位及换算:
国际单位制中电流的单位是安培,简称为安,符号是A,常用的单位还有毫安(mA)和微安(μA).
1mA=10−3A
1μA=10−6A

4.2.2 电流表的使用规则
用途:测量电流的大小.
符号:I
电流表的使用规则:
1.三要:
a.使用前要调零;
b.要使电流从“ ”接线柱流入,从“−”接线柱流出;
c.要把电流表串联在待测电路中.
2.二不:
a.待测电路中的电流不要超过电流表量程;
b.不要把电流表直接接在电源两极上.
3.二看清:
a.看清量程;
b.看清分度值.
电流表的读数:
实验室中常用的电流表有两个量程(0∼0.6A和0∼3A),读取数据时应先确认所使用的量程,再确认最小刻度值.
4.2.3 电流表量程的选择方法
1.估计待测电路中电流的大小.
2.在不能估计待测电流大小的情况下,拿电路中的一端试触较大量程的接线柱.
3.如果待测电流超过小量程,则选择较大量程;如果在较小量程内,则使用较小量程.
4.2.4 串联电路中电流的规律
串联电路的电流规律在串联电路中各处电流相等,用表达式可以表示为I=I1=I2=···=In.也就是说,在串联电路中,流过各种电器(或元件)的电流一定相等.
4.2.5 并联电路中电流的规律
并联电路的电流规律在并联电路中干路电流等于各支路电流之和,用表达式可以表示为+++I=I1+I2+···+In.也就是说,在并联电路中,无论有多少条支路,干路电流总等于各支路电流之和;各支路电流可能相等,也可能不相等.
4.3 物质的导电性与电阻
4.3.1 导体和绝缘体
导体
容易导电的物体.
例如:金属、石墨、人体、大地、及酸、碱、盐的水溶液等都是导体.
绝缘体
不容易导电的物体.
例如:橡胶、玻璃、陶瓷、塑料、油等都是绝缘体.导体和绝缘体之间没有绝对的界限.
4.3.2 半导体
半导体:金属导电性能好,非金属导电性能一般来说比较差.
有一些元素,例如:硅导电性能介于金属和非金属之间,比金属差.比非金属强,常常称为半导体.除了导电性能外,半导体还有许多其他特征,例如:温度、光照、杂质等外界因素都对它的导电性能有很大影响.利用半导体材料可以制作二极管、三极管.
4.3.3 电阻定义及单位
定义:
在物理学中,表示导体对电流阻碍作用的大小的物理量叫电阻,用字母R表示.
单位及其换算:
国际单位制中电阻的单位是欧姆,简称欧,符号是Ω,常用的单位还有兆欧(MΩ),千欧(kΩ).
1Ω的物理意义:如果导体两端电压是1V,通过导体的电流是1A,这段导体的电阻就是1Ω.
1kΩ=1000Ω=103Ω
1MΩ=1000000Ω=106Ω
4.3.4 影响导体电阻大小的因素
影响电阻大小的因素是:材料、长度、横截面积、温度.
1.导体的电阻的大小与材料有关,材料不同,电阻不同;
2.导体的电阻与横截面积有关,导体的横截面积越大,电阻越小;
3.导体的电阻与导体的长度有关,导线越长,电阻越大;
4.导体的电阻与温度有关,温度越高,电阻越大.
4.3.5 超导体
超导现象:20世纪初,科学家发现,某些物质在很低的温度时,如铝在1.39K(−271.76∘C)以下,铅在7.20K以下,电阻就变成了零,这就是超导现象.
发生超导现象的物质叫作超导体.
4.4 变阻器
4.4.1 滑动变阻器原理
原理:通过改变接入电路中的电阻丝长度来改变电阻,从而改变电流.
4.4.2 滑动变阻器的使用方法
1.使用前观察滑动变阻器铭牌,看清变阻器的最大限值和允许通过的最大电流,不能使电路中的电流超过它的最大值.
2.接线时要“一上一下”.
3.要看清滑动变阻器的哪一段电阻线接入电路.
4.为了保护电路,闭合开关前,滑片要滑到阻值最大的位置.
4.4.3 变阻器的应用
有些家用电器音量的调节器件也是一种变阻器,通常为电位器.其分为机械电位器和数字电位器.
1.机械电位器通过机械式旋钮调节阻值的大小,
应用:可调亮度的电灯,可调温度的电热毯,电饭锅.
2.数字电位器是一种用数字信号控制阻值的器件(集成电路),
应用:自动检测与控制、智能仪器仪表、消费类电子产品.
4.5 电压的测量
4.5.1 电压作用及单位
符号:U
作用:
电压使电路中形成电流,电源是提供电压的装置.
单位及其换算:
国际单位中电压的单位是伏特,简称伏,符号是V,
常用的单位还有千伏(kV)、毫伏(mV)和微伏(μV).
1kV=1000V=103V
1mV=0.001V=10−3V
1V=103mV=106μV
4.5.2 常见的电压

4.5.3 电压表
用途:测量电压的高低.
符号:
4.5.4 电压表的使用规则
三要:
1.使用前要调零;
2.要让电压表的“ ”接线柱接在靠近电源正极的一端,“−”接线柱接在靠近电源负极的一端;
3.要把电压表并联在电路两端.
一不:待测电路两端电压不要超过电压表量程.
二看清:
1.看清量程;
2.看清分度值.
4.5.5 电压表的读数
量程0∼3V分度值为0.1V.
量程0∼15V分度值是0.5V.
4.5.6 电压表量程选择方法
1.估计待测电路中电压的大小.
2.在不能估计待测电压大小的情况下,拿电路中的导线试触较大量程接线柱(试触法).
3.如果待测电压超过较小量程则选择较大量程,如果在较小量程内则使用较小量程.
4.5.7 电流表和电压表的对比
1.电流表用途测量电流,电压表的用途为测量电压.
2.连入电路的方式:电流表与待测电路串联,电压表与待测电路并联.
电流表量程一般有0∼0.6A,0∼3A两个量程,电压表一般有0∼3V,0∼15V两个量程.
3.使用方法:
a.使用前都需要调零.
b.都需要选择量程.
c.电流都是从正接线柱流入,负接线柱流出.
d.读数时要认清分度值且视线与刻度盘面垂直.
4.5.8 串联电路的电压规律
串联电路两端的总电压等于各部分电路两端电压之和.
用表达式可以表示为+++U=U1+U2+···+Un
4.5.9 并联电路的电压规律
在并联电路中,各支路两端电压相等,都等于电源电压.
用表达式可以表示为U=U1=U2=···=Un
4.6 电流与电压、电阻的关系
4.6.1 探究电流与电压的关系
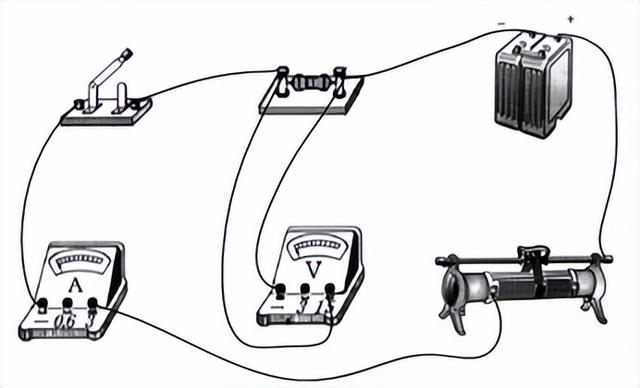
1.实验器材:电源、电流表、电压表、滑动变阻器、电阻、开关、导线.
2.实验电路:

3.实验步骤:保持R一定,通过移动滑动变阻器的滑片改变定值电阻两端的电压U,记下对应的电压值U和电流值I.
4.实验结论:在电阻一定的情况下,通过导体的电流与导体两端的电压成正比.
4.6.2 探究电流与电阻的关系
1.实验器材:电源、电流表、电压表、滑动变阻器、电阻、开关、导线.
2.实验电路:

3.实验步骤:保持电压U一定,然后改变电阻R的阻值,记下对应的电阻值R和电流值I.
4.实验结论:在电压一定的情况下,通过导体的电流与导体的电阻成反比.
4.6.3 欧姆定律内容及公式
内容:
导体中的电流,跟导体两端的电压成正比,跟导体的电阻成反比.
表达式:I=UR.
其中U的单位为伏特(V),R的单位为欧姆(Ω),I的单位为安培(A).
4.6.4 对欧姆定律的理解
1.定律中涉及的电流、电压、电阻都是相对于同一段导体或同一段电路而言的,且是同一时刻的.
2.定律中提到的“成反比”和“成正比”的两个关系分别有不同的前提条件.
即当导体的电阻一定时,通过导体的电流跟导体两端的电压成正比;
当导体两端电压一定时,通过导体的电流跟导体的电阻成反比.
3.欧姆定律公式I=UR可以变形为U=IR,但不能认为导体两端电压跟导体中的电流、导体的电阻成正比,因为电压是形成电流的原因,公式还可以变形为R=UI,但不能认为导体的电阻跟它两端的电压成正比,跟电流成反比,因为电阻是导体本身的性质,跟所加电压和通过的电流无关.应用欧姆定律时,各物理量的单位必须统一,I的单位是“A”,U的单位是“V”,R的单位是“Ω”.
4.6.5 用电流表和电压表测电阻实验原理
实验原理:用电压表和电流表测出灯泡两端的电压和通过灯泡的电流,根据R=UI求出电阻.这种测电阻的方法成为“伏安法”.
4.6.6 实验需要注意的问题
1.设计好实验电路,画出正确的电路图,是伏安法测电阻实验的首要问题.
2.选择实验器材时,应考虑器材的规格和性能.电源的电压、电流表和电压表的量程、待测电阻和滑动变阻器允许通过的最大电流必须统一考虑:待测电阻约5Ω,电源电压12V,电压表的量程选用0∼15V,由计算知,待测电阻和滑动变阻器中的最大电流约为2.4A,因此电流表的量程应选用0∼3A.必须注意该最大电流是否超过待测电阻和滑动变阻器允许通过的最大电流.
3.根据电路图,正确地连接电路,是做好实验的基础.
4.连接电路时应注意的问题:
a.开关S要处于断开状态.
b.滑动变阻器R的滑片要放在阻值最大的位置.
c.选择好电流表和电压表的量程及认清正负接线柱.
5.实验时,每次读数后开关要及时断开.因为导体电阻的大小除由导体本身因素决定外还与温度有关.当电流通过导体时,导体因发热而电阻变大,长时间通电后,前后测得的电阻值偏差较大.所以,每次读数后应及时断开开关,这样测得的电阻值较为准确.

4.7 电路分析与应用
4.7.1 串并联电阻的规律
串联电路各部分电路两端的电压与电阻成正比,即U1U2=R1R2;
并联电路各支路电流与电阻成反比,即I1I2=R2R1.
4.7.2 电阻的并联与串联
1.串联电路的总电阻比任何一个分电阻都大.
多个电阻串联,相当于多个导体串联起来,因为导体的总长度比其中任意一个导体的长度都要长,所以总电阻一定比分电阻大.
两个串联电阻的总电阻等于各分电阻之和.
R=R1 R2
2.并联电路的总电阻比任何一个分电阻都小.
多个电阻并联,相当于多个导体并联起来,因为导体总的横截面积比其中任意一个导体的横截面积都要大,所以总电阻一定比分电阻小.
两个并联电阻的总电阻的倒数,等于两个分电阻的倒数之和.
1R=1R1 1R25 电与磁
5.1 指南针为什么能指方向
5.1.1 磁性和磁体
在物理学中把物体能吸引铁、钴、镍等物质的性质叫磁性,这种物体叫磁体.
磁体有天然磁体和人造磁体,能长期保持磁性的叫永磁体,人造永磁体通常是用钢或合金经过加工处理制成的,根据需要常制成各种不同形状.
5.1.2 磁极及磁极间的相互作用
磁极:
磁体上磁性最强的部位叫磁极,磁体有两个磁极,即南极和北极.磁体总有两极,一根条形磁铁断为两截以后,每一段都有N、S两极,只有单个磁极的磁铁在自然界是不存在的.
磁极间相互作用规律:
同名磁铁相互排斥,异名磁铁相互吸引.我们可以通过磁铁的吸铁性、南北指向性和磁极间的相互作用规律来判断一个物体是否具有磁性.
磁极及磁极间的相互作用 相关资料更多

5.1.3 磁化
使原来没有磁性的物体获得磁性叫磁化.被磁化的钢又保持磁性的性质,因此,常用它制造永磁体.
5.1.4 磁场定义
磁体周围存在一种看不见、摸不着的物质,能使磁针偏转,把这种物质叫磁场.
磁体间的相互作用就是通过他们各自的磁场发生的.
5.1.5 磁场的性质
对放入其中的磁体产生力的作用
5.1.6 磁场的方向
1.在磁场中的某一点,小磁针静止时北极所指的方向就是该点的磁场方向.
2.在磁场中的某一点,小磁针北极所受磁场力的方向跟该点的磁场方向一致.
5.1.7 磁感线的定义
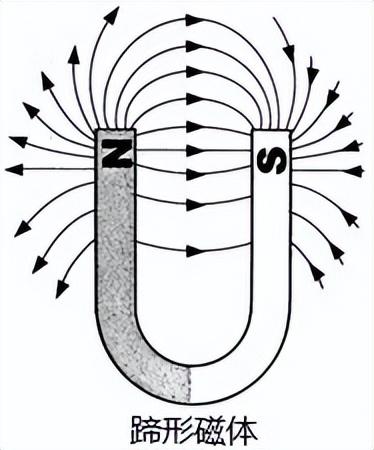
为了描述空间磁场的分布情况,在磁场中画一些有方向的曲线,曲线上任何一点的切线方向都跟放在该点的小磁针静止时北极所指的方向一致,这样的曲线叫磁感线.磁体外部的磁感线都是从磁体北(N)极出发,回到磁体南(S)极.
5.1.8 磁感线的性质
1.磁感线不是真实存在的,它是为了形象的描述磁场而画出的一些假想的曲线.
2.磁感线是有方向的,曲线上任意一点的切线方向就是该点的磁场的方向.
3.磁感线分布的疏密可以表示磁场的强弱.磁体两极处磁感线最密.表示其两极处磁场最强.
4.磁感线是一些闭合的曲线.即磁体周围的磁感线都是从磁体的北极出发,回到磁体的南极;在磁体的内部,都是从磁铁南极指向北极.
5.空间任何两条磁感线绝对不会相交,因为磁场中任何一点的磁场方向只有一个确定的方向.
5.1.9 常见磁体的磁感线分布



5.1.10 地磁场
1.地球本身是一个巨大的磁体.地球的磁场叫地磁场.地磁的北极在地理南极附近,地磁的南极在地理北极附近.磁针受到地磁场的作用一端指南另一端之北.
2.地球的两极和地磁场的两极并不重合,磁针所指的南北两极并不重合,磁针所指的南北方向与地理的南北方向略有偏离.世界上最早技术这一现象的认识我国宋代学者沈括.
5.2 电生磁
5.2.1 电流的磁效应
任何导体中有电流通过时,其周围空间均会产生磁场,且磁场的方向跟电流的方向有关,这种现象叫电流的磁效应.
5.2.2 通电螺线管
1.通电螺线管的磁场和条形磁体的磁场一样,通电螺线管的两端相当于条形磁体的两极.
2.通电螺线管的特性:通电螺线管的两端的极性由环绕电流方向决定,他们的关系可用安培定则来判断.
5.2.3 电磁铁
1.定义:电磁铁是带有铁芯的螺线管.
2.通过电磁铁线圈的电流越大,线圈匝数越多,电磁铁的磁性就越强.
3.电磁铁优点:电磁铁磁性的有无,可有电路的通断来控制;电磁铁磁性的强弱.可有电流大小和线圈匝数来控制;电磁铁的极性位置,可由电流方向来控制.
5.2.4 安培定则
通电螺线管的极性跟电流方向的关系,可用安培定则来判定.用右手握住螺线管,让四指指向螺线管中电流的方向,则大拇指所指的那段就是螺线管的N极.如图:

5.3 电磁铁的应用
5.3.1 电磁继电器
1.构造:如图所示,主要部分是电磁铁、衔铁、触点开关和弹簧.其工作电路由低压控制电路和高压工作电路两部分构成.

2.电磁继电器实质是由电磁铁控制工作电路通断的开关.
3.工作原理:电磁铁通电时,把衔铁吸下来,将工作电路的触点接通,工作电路闭合;电磁铁断电时失去磁性,弹簧把衔铁拉起来,切断工作电路.
4.主要应用:用低压电路的通断间接地控制高压电路的通断.可实现远距离控制,与其他元件配合实现自动控制.
5.3.2 电话的组成及工作原理
基本组成
话筒和听筒是电话的两个基本组成部分.
工作原理
说话引起话筒内炭粒的弹力忽松忽紧,电路中电阻忽大忽小,电话中电流忽大忽小,听筒内电磁铁的磁性忽弱忽强,膜片受到的作用力忽小忽大,引起膜片的振动而发生.
5.4 电动机
5.4.1 磁场对通电导线的作用
通电导线在磁场中要受到力的作用.
通电导线在磁场中受力的方向跟电流方向和磁场方向有关.
5.4.2 电动机
1.原理:通电线圈在磁场中受力转动.
2.组成:定子和转子
3.直线电动机换向器的作用:每当线圈刚转过平衡位置时,换向器能自动改变线圈中的电流方向.
4.电动机转动的方向:与电流和磁场方向都有关,改变电流方向或磁场方向,电动机的转动方向就随之改变;但如果同时改变电流方向和磁场方向,电动机的转动方向不变.
5.能的转化:电动机工作时,将电能转化为机械能.
5.5 磁生电
5.5.1 电磁感应现象
定义
闭合电路的一部分导体在磁场中切割磁感线运动,导体中就产生电流,这种现象叫电磁感应现象.产生的电流叫感应电流.感应电流方向与导体运动方向和磁场方向有关.
产生感应电流的条件
1.电路必须是闭合的;
2.一部分导体在磁场中;
3.在磁场中的部分导体做切割磁感线运动.
电磁感应现象中能量的转化:机械能转化为电能.
对电磁感应条件的理解
1.要有一部分导体做切割磁感线运动。这里要注意的是闭合电路的“一部分导体”而不是“整个电路”,还要注意的是“做切割磁感线运动”,就是把磁感线“切断”,这就是说,导体的运动方向一定要与磁感线方向成一定角度,而不是与磁感线平行,否则磁感线是“切不断的”.
2.电路应该是闭合的.如果是不闭合电路,即使导体做切割磁感线运动,导体中也不会有感应电流产生,只是在导体两侧产生电压,因为不闭合就形不成电荷定向移动的通路,当然电路中就没有电流.
5.5.2 发电机
原理:发电机是根据电磁感应原理制成的.
能的转化:发电机工作时将机械能转化为电能.
5.5.3 交流电和直流电
直流电流(直流电)方向不改变.大小和方向作周期性改变的电流叫交变电流(交流电).
在交变电流中,电流周期性变化的次数与所受时间的比叫做这一交变电流的频率,单位是赫兹(Hz).
我国电网的交流电频率是50Hz.
5.6 家庭用电
5.6.1 家庭电路的组成
由进户线、电能表、总开关、保险装置、用电器、插座、开关、导线组成.
5.6.2 家庭电路的连接
1.电能表直接与进户线连接,依次连接总开关、保险装置
2.各盏灯和插座安装在保险装置后.
3.灯和插座应并联,开关与其控制的灯串联.

5.6.3 火线和零线
进户的两条输电线中,一条叫端线,俗称火线,另一条叫零线.火线和零线之间有220V的电压,零线在入户之前已经和大地相连.
5.6.4 安装简单照明电路时的注意事项
1.开关机保险丝必须与电路的火线相连,开关接在火线上,当断开开关切断电路时,电路各部分都脱离火线,这样人体不小心碰到这些部分就不会触电,检修电路也比较安全.
2.螺口灯泡的螺旋套接到零线上.因为一般情况下,零线接着地,这样人体不小心碰到螺旋套灯座,也不会触电.
3.闸刀开关千万不能倒装.闸刀开关的上端为静触点,用于接输入导线.下端为动触电,用于接输出导线.切记不可接反.如果倒置安装,在推拉闸刀的过程中、由于重力作用,容易自动接通电路而造成危险.
4.电能表只有接在干路的最前端,才能测出用户全部家用电器消耗的电能.
5.6.5 试电笔
用途:试电笔是用来辨别火线和零线的.试电笔又叫验电笔或测电笔.
使用方法:在使用试电笔时,人手要握住试电笔的绝缘杆部分,同时要用手接触笔卡或笔尾的金属体.若试电笔的金属笔尖接触火线,则氖管发光;若金属笔尖接触零线,则氖管不发光.
5.6.6 保险丝
1.作用:
当电路中的电流超过电路允许通过的最大正常工作电流时,会自动熔断,从而保护电路.
2.材料:
为了使保险丝自动熔断,应选择电阻率大且熔点低的材料,一般选择铅锑合金.
3.规格:
保险丝的规格用它的额定电流来表示,与保险丝的粗细有关,保险丝越粗,额定电流越大.
4.选择:
选择保险丝时,要使保险丝的额定电流等于或者稍大于电路中的最大正常工作电流.
5.连接:
要连在闸刀开关动触头的下方,一般要接在火线上,且与要保护的电路串联.为了用电安全,绝不能用钢丝铁丝等代替保险丝.
5.6.7 三线插头和漏电保护器
三线插头
三线插头是与三孔插座对接的.三线插头上的一条线接火线,一条接零线,一条接用电器的外壳.接头插入插座后,用电器的外壳与大地就连通可,当用电器的外壳带电时就可以及时导入大地,保障人的安全.
漏电保护器
1.作用:发生漏电时,自动切断电路,保障人身安全,防止漏电.
2.原理:发生漏电时,通过火线和零线的电流不等,多余的电流就会产生磁力使开关自动断开.
5.6.8 用电器总功率过大
由P=UI知,家庭电路的电压一定,用电器的总功率越大,电路中的电流就越大.
5.6.9 发生短路
短路是指电流没有经过用电器,而使火线和零线直接连通.由于导线的电阻很小,由欧姆定律知,电路中的电流将会很大,会产生大量的热,容易造成火灾.
5.7 电的安全使用
5.7.1 常见的触电事故
1.触电:指一定强度的电流通过人体引起的伤害事故.
2.低压触电:低压触电分为单线触电和双线触电.
3.高压触电:分为高压电弧触电和跨步电压触电.
5.7.2 安全用电原则
1.不接触低压带电体,不靠近高压带电体.
2.更换灯泡、搬动电器前应断开电源开关.
3.不弄湿用电器,不损坏绝缘层.
4.保险装置、插座、导线、家用电器等达到使用寿命应及时更换.
6 微粒的模型与符号

6.1 物质的微观粒子模型
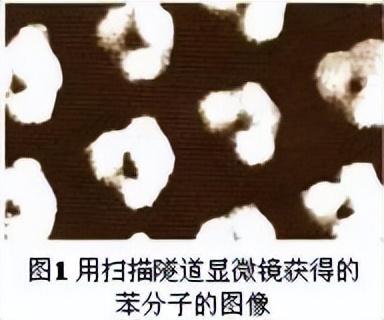
6.1.1 物质的微粒性
物质的微粒性是指物质是由极其细小的、肉眼看不见的、又确确实实存在着的微粒构成的(如图1、2、3、4、5所示),并且,这些微观粒子总是在不停地做无规则的运动(如氨气在空气中的扩散;温度不同微粒的运动速率不同,如图6所示);彼此之间都有一定的间隙(如热胀冷缩就是物质分子间的间隔受热时增大,遇冷时缩小的缘故).这些构成物质的基本微粒,就是说是分子、原子、离子这样一些主要的微粒.其中,原子是化学科学最重要的基础和研究对象(它既可以构成分子,还可以转变为离子),它是由原子核和核外电子构成的;而原子核又是由质子和中子构成的.




6.1.2 微粒观点及模型图的应用
微粒观点的应用就是从物质的微粒性角度来分析解决实际问题.也就是,运用分子、原子或离子等微观粒子的知识来分析解释实际问题.
例如,水受热变成了水蒸气,是由于水受热时,水分子获得的能力大,运动加剧,分子间隔逐渐变大,从而使水由液态变成了气态.
模型图的应用是指把看不见的、抽象的微观粒子,用能够看到的模型图的形式形象展现出来,以便用来解释抽象的概念、化学反应或实际问题等.例如,
分析图1中的模型图可知:

(1)A表示的是某种原子(因为原子模型之间没有连接起来);当该原子是能够直接物质的原子(即金属元素的原子、稀有气体元素的原子和能够构成固态非金属的非金属元素的原子)时,该图还能表示由这种原子直接构成的单质.
(2)B表示的是由同种原子构成的分子(因为原子模型之间连接起来了,即原子结合构成了分子),还表示由该分子构成的单质.
(3)C表示的是由不同种原子构成的分子,还表示由该分子构成的化合物.
(4)D表示的是两种由同种原子构成的不同的分子,还表示由这两种分子构成的混合物.
(5)原子模型之间没有连接起来的表示是原子;原子模型之间连接起来的表示是分子(即原子结合构成了分子).
(6)单质是只含有一种原子或分子(指由同种原子构成的)的物质;化合物是只含有一种分子(指由不同种原子构成的)的物质;混合物是含有多种分子的物质.
分析图2中的模型图可知:
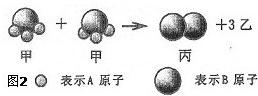
(1)2个甲分子反应生成1个丙分子和3个乙分子.
(2)参加反应的甲物质属于化合物,反应生成的丙物质和乙物质都属于单质.
(3)该反应中原子的种类没有发生改变.
(4)根据质量守恒定律可推知,1个乙分子中含有2个A原子.
(5)甲、乙、丙的化学式分别是BA3(或A3B)、A2和B2.
(6)该反应的化学方程式是2BA3(或A3B)=B2 3A2(由于不知条件和物质的状态,所以暂时不够全面).
(7)该反应的类型是分解反应.
6.1.3 分子和原子的区别和联系
分子和原子的区别和联系,如表所示:

6.2 原子结构的模型
6.2.1 原子的定义与构成
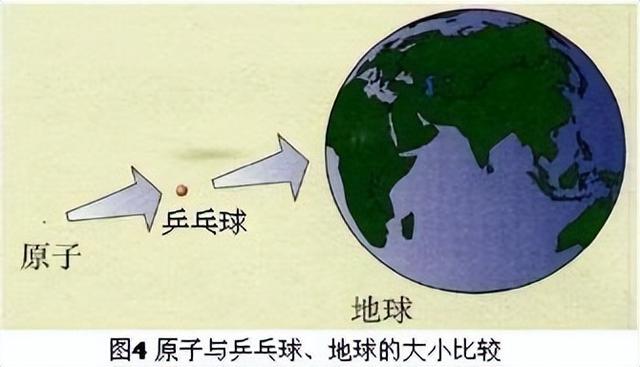
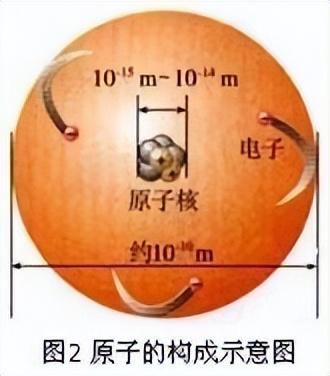
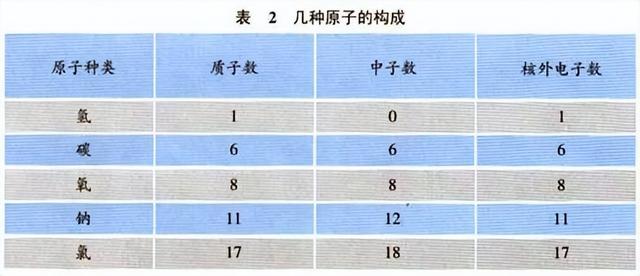
原子的定义是化学变化中的最小粒子.原子很小,一个原子跟一个乒乓球体积相比,就相当于乒乓球跟地球体积之比(如图1).尽管原子很小,但是,它还是能够再分的,即原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的(如图2).并且,原子核也不是简单的、不可分割的,它由质子和中子两种粒子构成.原子核比原子又小很多,如果把原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁.因此,原子里有很大的空间,电子就在这个空间里作高速的运动.构成原子的各种粒子的电性和质量如表1所示.由于核内的质子带一个单位的正电荷,中子不带电,原子核带正电,所带的正电荷数(即核电荷数,也就是质子数)与核外的电子数相等,电子带一个单位的负电荷,所以原子不显电性.不同种类的原子,核内的质子数、中子数不同,核外电子数也不同;如表2所列出的几种原子的构成.
核电荷数=质子数=核外电子数=原子序数


6.2.2 原子的有关数量计算
原子的有关数量计算包括以下几种:
1.原子中各粒子间的个数推算,其原理是各粒子间的数量关系;利用如下等式,进行推算.
(1)核内质子数=核电荷数=原子序数=核外电子数(注意:该等号不适用与离子)=相对原子质量−核内中子数;
(2)核内中子数=相对原子质量−核内质子数.
2.相对原子质量的近似计算,其原理是根据原子的质量主要集中在原子核上(因为跟质子、中子相比,电子的质量很小);利用公式“相对原子质量=质子数 中子数”来进行计算.
元素是具有相同核电荷数(即核内质子数)的一类原子的总称.
例如,氧气分子和水分子中都含有氧原子,它们的核电荷数都是8,即核内都含有8个质子,就把它们统称为氧元素.同样,把核电荷数为1的所有的氢原子统称为氢元素,把核电荷数为6的所有的碳原子统称为碳元素,等等.
分子、原子、离子、元素与物质之间的关系,如图所示:

它们的区别是:1.物质和元素都是宏观概念,它们只讲种类,不讲个数;而分子、原子和离子等是微观粒子,既可以讲种类,也可以讲个数.2.元素是具有相同核电荷数(即核内质子数)的一类原子的总称;它与物质之间是组成关系,也就是,它是用来描述物质的宏观组成的,习惯上用“组成”来描述.
例如,水是由氢元素和氧元素组成的(但不能说“水是由二个氢元素和一个氧元素组成的”).而分子、原子和离子都是微观粒子;它们与物质之间是构成关系,也就是,它们是用来描述物质的微观构成的,习惯上用“构成”来描述.例如,水是由水分子构成的(一个水分子是由两个氢原子和一个氧原子构成的;但不能说“一个水分子是由氢元素和氧元素组成的”);铁是由铁原子构成的;氯化钠是由钠离子和氯离子构成的.3.对于分子、原子和离子来说,分子是保持物质化学性质的最小粒子,它在化学变化中是可以再分的;原子是化学变化中的最小粒子,它在化学变化中是不可再分的;而离子是指带电的原子或原子团(实际上是一种特殊的原子).
6.3.3 单质和化合物的概念
单质是指由同种元素构成的纯净物(如铁、氧气等);化合物是指由不同种元素组成的纯净物(如水、二氧化硫等).
它们的相同点是:它们都是纯净物,都是元素的存在状态;不同点是:单质只含有一种元素,化合物含有两种或两种以上元素.由此可见,它们的概念是建立在纯净物的基础上的,是从元素角度引出的两个概念.
6.3.4 纯净物和混合物的概念
纯净物是指由一种物质组成的物质(如二氧化碳、水等);而混合物是指由两种或两种以上物质组成的物质(如空气、海水等).
它们的特点是:纯净物只含有一种物质,混合物含有两种或两种以上物质.
值得一提的是:所谓的纯净物是一个相对概念,也就是相对于混合物来说,其纯度比较高罢了;实际上绝对纯净的物质是不存在的,就拿目前纯度最高的高纯硅来说吧,它的纯度是99.999999999%,但是它还是含有0.000000001%的杂质的.
一般将元素分为三类:
(1)金属元素[其中文名称一般都带有“钅”字旁,金属汞(Hg)除外],如铝元素(Al)、铁元素(Fe)、铜元素(Cu)等;
(2)非金属元素(其中文名称一般都带有“石”字旁、“氵”字旁或“气”字头),如氮元素(N)、氧元素(O)、碳元素(C)等;
(3)稀有气体元素(其中文名称一般都带有“气”字旁),如氦元素(He)、氖元素(Ne)、氩元素(Ar)等.
6.3.6 地壳中元素的分布与含量
地壳中元素的分布与含量,如图所示:

地壳中元素含量记忆谐音小故事:“养(氧)闺(硅)女(铝),贴(铁)给(钙)那(钠)家(钾)美(镁)青(氢)年”,这个顺序是比较重要,也比较关键的;特别是,其中的氧、硅、铝、铁、钙一定要熟练地记住它们.
6.3.7 人体的元素组成与元素对人体健康的重要作用
人体的元素组成:我们周围世界的物质是由100多种元素组成的,而组成人体自身的元素约有50多种.其中,含量较多的元素有11种,它们约占人体质量的99.95%.在人体中含量超过0.01%的元素,称为常量元素,如图表所示:


含量在0.01%以下的元素,称为微量元素,如铁(Fe)、钴(Co)、铜(Cu)、锌(Zn)、铬(Cr)、锰(Mn)、钼(Mo)、氟(F)、碘(I)、硒(Se)等.它们在人体中的含量虽然很小,却是维持正常生命活动所必需的.
元素对人体健康的重要作用:在人体中,除氧、碳、氢、氮几种元素以水、糖类、油脂、蛋白质和维生素的形式存在外,其余的元素主要以无机盐的形式存在于水溶液中.它们有些是构成人体组织的重要材料.有些能够调节人体的新陈代谢,促进身体健康.例如,钙元素:成人体内约含钙1.2kg,其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙[Ca10(PO4)6(OH)2]晶体的形式存在,它使得骨骼和牙齿具有坚硬的结构支架.幼儿及青少年缺钙会得佝偻病和发育不良;老年人缺钙会发生骨质疏松,容易骨折.又如,钠元素和钾元素:人体内含钠80∼120g,其中一半以Na 的形式存在于细胞外液中.成人每千克体重含钾约2g主要以K 的形式存在于细胞内液中.细胞内液和细胞外液中的K 和Na 各自保持一定的浓度,这对维持人体内的水分和体液恒定的pH(如血液的pH为7.35∼7.45)有重要的作用,而这是人体维持正常生命活动的必要条件.
还有,一些必需微量元素对人体的重要作用及成年人每天的适宜摄入量,如表所示:
另外,几种元素的主要食物来源,如表所示:

.
在我国人民膳食中容易缺乏的元素有钙、铁、碘等元素.当然,在一些地质条件特殊的地区,也存在因摄入氟或硒过多而发生的氟中毒或硒中毒问题.如果人体所需的元素仅从食物中摄取还不足时,可通过食品添加剂、保健药剂等来予以补充.如在食品中添加含钙、锌、硒、锗的化合物,或制成补钙、补锌等的保健药剂或加碘食盐,来增加对这些元素的摄入量.
6.4 表示元素的符号
6.4.1 元素的符号及其意义
元素的符号是指用来表示元素的特有符号.它是化学学科所特有的一种用语,是化学科学研究物质组成、结构和变化规律的一种重要工具.现在国际上,统一常用元素的拉丁文名称的第一个大写字母来表示,如果几种元素的第一个字母相同时,可再附加一个小写字母来区别.例如,用C表示碳元素,Ca表示钙元素,S表示硫元素,Si表示硅元素,N表示氮元素,Na表示钠元素,等等.元素符号的意义有两个:(1)表示一种元素,(2)表示这种元素的一个原子.例如,H既表示氢元素,还表示一个氢原子;等等.
6.4.2 元素周期表的特点及其应用
元素周期表的具体内容,如图所示:

一、元素周期表的特点1.横向共有7个横行,每一横行叫做一个周期;就是把电子层数相同的各种元素按元素原子的核电荷数(即核内质子数或原子序数)递增的顺序从左到右排列起来;因此,每一周期的特点是:每一周期中元素的原子的电子层数是相同的,而最外层电子数却依次增多一个;还有,元素周期序数等于该元素原子的电子层数.2.纵向共有18个纵行,每一个纵行叫做一个族(8、9、10三个纵行共同组成一个族);就是把最外层电子数相同的各种元素按电子层数递增的顺序从上到下排列起来;因此,每一主族(过渡元素之外的,即除了最外层电子层以外的电子层的电子数都是排满电子的化学元素)的特点是:主族中元素的最外层电子数相同,而电子层数依次增多一层;还有,族序数等于最外层电子数.3.元素周期表中的每一个单元格的构成及其含义都是一样的,就拿第13个单元格来说吧,如图所示:

,该单元格由四部分构成,其中的“13”是原子序数,“Al”是元素符号,“铝”是元素名称,“26.98”是相对原子质量.4.在元素周期表中,金属元素位居左边,非金属元素一般位居右边(只有氢位居左上角),稀有气体元素位居表的最后一列.二、元素周期表的应用有:1.可以根据其中的单元格的任意一部分信息(如原子序数、元素符号、元素名称或相对原子质量等),查找出其余的各个信息或它在元素周期表中的位置.
2.原子的结构决定了元素在周期表中的位置,而元素在周期表中的位置也可以反映元素的原子结构和元素的某些性质.所以,我们可以根据位置去推测它的原子结构和某些性质.概言之,原子结构、元素性质和元素在表中的位置之间的关系,如图所示:

3.科学家在元素周期律和元素周期表的指导下,对元素的性质进行了系统的研究,并为新元素的发现和预测它们的原子结构和性质提供线索.4.由于在周期表中位置靠近的元素性质相近,在周期表的一定区域内寻找元素,发现物质的新用途被视为一种有效的方法.例如,通常用来制造农药的元素,如氟、氯、硫、磷等在周期表里占有一定的区域.对这个区域里的元素进行充分的研究,有助于制造出新品种的农药.又如,可以在周期表里金属与非金属的分界处找到半导体材料;在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料,等等.
6.5.1 化学式的书写及意义
化学式的书写分两种情况:
1.单质的化学式的书写:分为两种:
(1)由原子构成的单质,用组成该单质的元素的元素符号来表示它的化学式.例如,铁的化学式为Fe;硫的为S;氦气的为He;等等.
(2)由分子构成的单质,要先写出组成该单质的元素的元素符号,再在其右下角标出该分子的构成(即该分子中所含的原子个数);才能完成其化学式的书写.例如,氧气的化学式为O2;氮气的为N2;氢气的为H2;等等.
2.化合物的化学式的书写:
(1)是要先按照“左正右负”的原则[即正价元素或原子团写在左边,负价元素或原子团写在右边;但甲烷(CH4)、氨气(NH3)除外],书写出组成该化合物的元素的元素符号;
(2)是采用交叉法(即交叉正、负化合价的数值),找到并标出各元素符号右下角所要标注的原子或离子个数;即可得到该化合物的化学式.
化学式的意义一般是指宏观上表示该物质及该物质的元素组成,微观上表示该物质的构成.如果构成该物质的粒子是原子,那么它还能表示元素和一个该原子;如果构成该物质的粒子是分子,它除了表示一个该分子外,还表示该分子的构成;等等.当然,有时根据物质的化学式,结合所给的原子的相对原子质量,还能计算出该物质的相对分子质量、其中的元素质量比或某元素的质量分数,等等.具体的表述是这样的:
(1)由原子构成的物质的化学式的意义,以铁(Fe)为例,它除了表示铁这种物质、铁由铁元素组成、铁由铁原子构成以外,还能表示铁元素和一个铁原子,等等.
(2)由分子构成的物质的化学式的意义,以水(H2O)为例,如图所示:

另外,根据水的化学式(H2O)还可以计算出:①水的相对分子质量是18;②水中氢元素与氧元素的质量比是1:8;③水中氢元素的质量分数是11.11%,氧元素的是88.89%;等等.
(3)由离子构成的物质的化学式的意义,以氯化钠(NaCl)为例,它既表示氯化钠这种物质,又表示氯化钠由钠元素和氯元素组成,还表示氯化钠由钠离子和氯离子构成,等等.
6.5.2 化学符号及其周围数字的意义
化学符号及其周围数字的意义分别是指元素符号、化学式和离子符号等及其周围的四种数字所表示的含义.具体内容如下:1.元素符号宏观上表示元素,微观上表示该元素的一个原子2.化学式宏观上表示物质及其组成,微观上表示该物质的构成.如果构成该物质的粒子是原子,那么它还能表示元素和一个该原子;如果构成该物质的粒子是分子,它除了表示一个该分子外,还表示该分子的构成;等等.3.离子符号整体上表示一个该离子,右上角表示一个该离子带几个单位的正或负电荷.
4.四种数字的含:
(1)化学符号前面的数字,表示微粒的个数.例如,2H2表示2个氢分子;2H表示两个氢原子,2H 表示两个氢离子,等等.
(2)化学符号右下角的数字,表示一个该微粒中所含该原子的数目.例如,H2表示一个氢分子中含有二个氢原子;SO4表示一个硫酸根中含有四个氧原子;等等.
(3)化学符号右上角的数字,表示一个该离子所带的电荷数.例如,H 表示一个氢离子带一个单位的正电荷;SO42−表示一个硫酸根离子带二个单位的负电荷;等等.
(4)化学符号正上方的数字,表示在该化合物里该元素或原子团所显的化合价.例如,H2O−2表示在水中氧元素显−2价;NaOH−1表示在氢氧化钠中氢氧根显−1价;等等.
6.5.3 化合价规律和原则
化合价的一般规律:在化合物中,氧通常显−2价,氢通常显 1价;当金属元素跟非金属元素化合时,金属元素通常显正价,非金属元素通常显负价;当两种非金属元素组成的化合物,则共用电子对偏向的元素显负价,偏离的元素显正价;一些元素(即可变价元素)在不同物质中可显不同的化合价.化合价的原则:在化合物中,正负化合价的代数和为零;在单质里,元素的化合价为零.概言之,化合价的规律和原则可以简记为:“四个通常,两个为零”.
6.5.4 有关元素化合价的计算
有关元素化合价的计算是指根据化合价的原则,结合着常见元素或原子团的化合价,来推算化学式中某种元素或原子团的化合价;或者是来推断化学式;或者是推算化学式中某原子或原子团的个数;等等.
例如,计算二氧化硫中硫元素的化合价是多少?解:在SO2里,O为−2价,根据“在化合物中,正负化合价的代数和为零”的原则,硫元素肯定为正价.设:硫元素的化合价为x,列:x (−2)×2=0,解得:x= 4.答:二氧化硫中硫元素的化合价为 4.
6.6 元素符号表示的量
6.6.1 相对原子质量的概念及其计算方法
相对原子质量是以一种碳原子(即碳−12原子)质量的112作为标准,其它原子的质量(实际质量)跟它相比较所得的值,就称为该原子的相对原子质量(符号为Ar).相对原子质量的计算方法是根据相对原子质量的概念,利用公式:“相对原子质量某原子的实际质量碳原子实际质量相对原子质量=某原子的实际质量碳−12原子实际质量×112”来进行计算.另外,还有一个近似计算公式是:“相对原子质量≈质子数 中子数”.不过,该公式一般不用来计算相对原子质量,而常用来计算质子数或中子数的.
6.6.2 相对分子质量的概念及其计算
相对分子质量是化学式中各原子的相对原子质量的总和,就是相对分子质量(符号Mr).相对分子质量的计算方法是根据相对分子质量的概念,利用公式:“相对分子质量=相对原子质量与相应原子个数的乘积和”来进行计算.
6.6.3 元素质量比的计算
元素质量比的计算是指利用相对原子质量,根据化学式来计算某物质中所含的元素的质量比.计算公式是:“元素质量比=相对原子质量与相应原子个数的乘积比”.当然,如果知道了物质中各元素的实际质量,就可以利用元素的实际质量来直接相比即可.
6.6.4 元素的质量分数计算
元素质量分数的计算是指利用相对原子质量,根据化学式来计算某物质中所含的某元素的质量分数.计算公式:“某元素质量分数该原子的相对原子质量该原子个数该物质的相对分子质量某元素质量分数=该原子的相对原子质量×该原子个数该物质的相对分子质量×100%”.当然,如果知道了物质和其中某元素的实际质量,就可以利用公式该元素的实际质量该物质的实际质量该元素的实际质量该物质的实际质量×100%来直接相比即可.
6.6.5 化合物中某元素的质量计算
化合物中某元素的质量计算是指利用化合物的化学式先求出某元素的质量分数,然后结合化合物的质量来求解其中某元素的质量的一种综合性计算.
计算公式是:“化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数”.
7 空气与生命

7.1 空气与氧气
7.1.1 空气的成分及各成分的体积分数
空气的成分及各成分的体积分数:“氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、其他气体和杂质0.03%”.
由此可见,空气中体积分数最大(或含量最多)的气体是氮气.最早通过实验得出空气是由氧气和氮气组成的结论是法国化学家拉瓦锡.
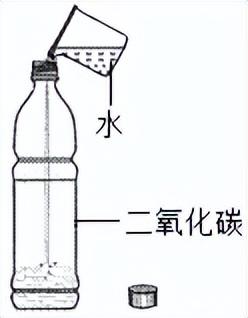
7.1.2 测定空气里氧气含量的探究
该探究是为了测定空气里氧气含量,并且是测定其中氧气的体积含量的.最早是二百多年前,法国的化学家拉瓦锡用定量的方法,通过实验得出空气由氧气和氮气组成,其中氧气约占其体积的15.目前,人们已能用实验方法精确地测定空气里氧气大约占其体积的21%.
实验步骤:
①检查装置的气密性.
②在集气瓶内加入少量水,并将水面上方空间分为5等份.
③用弹簧夹夹紧胶皮管.点燃燃烧匙内的红磷后,立即深入瓶中并把塞子塞紧,观察红磷燃烧的现象.
④待红磷熄灭并冷却后,打开弹簧夹,观察实验现象及水面的变化情况.

7.1.3 空气对人类生活的重要作用
空气对人类生活的重要作用,实际上是指空气中的各成分的重要作用.具体内容如下:1.氧气:在过去人们曾把它叫做“养气”,这充分说明了氧气的重要性;通常状况下,人吸入空气就可以,但如潜水、医疗急救等时,则需要用纯氧(或富氧空气);还有,燃料燃烧离不开氧气,炼钢、气焊、金属切割以及化工生产和宇宙航行等都要用到氧气.2.氮气:用途也比较广泛.它是制硝酸和化肥的重要原料;由于氮气的化学性质不活泼,因此常用作保护气,如焊接金属时常用氮作保护气,灯泡中充氮以延长使用寿命,食品包装时充氮以防腐;医疗上可在液氮冷冻麻醉条件下做手术;超导材料在液氮的低温环境下能显示超导性能.3.稀有气体:在空气中所占比率虽然不大,但它们却是一类很重要的气体.它在生产和科学研究中,有着广泛的用途.由于稀有气体有惰性,所以常用作保护气,如焊接金属时用稀有气体来隔绝空气,灯泡中充稀有气体以使灯泡耐用;稀有气体在通电时能发出不同颜色的光,可制成多种用途的电光源,如航标灯、闪光灯、霓虹灯等;氦、氖、氩、氪、氙等可用于激光技术;氦可用于制造低温环境;氙可用于医疗麻醉.4.二氧化碳:只占空气总体积的0.03%.可是,它对自然界的生命活动是非常重要的.没有二氧化碳,绿色植物就无法进行光合作用,也就无法满足人和动物所需的有机物的合成和对氧气的需求;以及空气中氧气含量的相对稳定和自然界的碳、氧的循环等.
7.1.4 氧气的物理性质
氧气的物理性质是指在通常状况下,氧气是一种没有颜色、没有气味的气体.在标准状况(即温度为0∘C和压强为101.325kPa时的情况)下,氧气的密度是1.429g/L,比空气的密度(1.293g/L)略大.它不易溶于水,在室温下,1L升水中只能溶解约30mL氧气.在压强为101kPa(准确地说应为101.325kPa)时,氧气在约−183∘C时变为淡蓝色液体,在约−218∘C时变成雪花状的淡蓝色固体.(工业上使用的氧气,一般是加压贮存在蓝色钢瓶中.)
7.1.5 氧气的化学性质
氧气的化学性质主要是指氧气具有助燃性和氧化性,还有能支持呼吸.即它是一种化学性质比较活泼的气体,可以与非金属、金属、化合物等多种物质发生氧化反应,反应剧烈程度因条件不同而异,可表现为缓慢氧化、燃烧或爆炸等,但在反应中都放出大量的热.具体情况如下:
1.氧气与非金属反应,例如:
(1)木炭在氧气里剧烈燃烧,发出白光,生成无色、无气味能使澄清石灰水变浑浊的气体(即二氧化碳);但是,当氧气不充足时,会生成一氧化碳;
(2)硫在氧气里剧烈燃烧,产生明亮的蓝紫色火焰(在空气中燃烧发出微弱的淡蓝色火焰),生成无色、有刺激性气味的气体(即二氧化硫);
(3)红磷在氧气里剧烈燃烧,生成大量的白烟(即五氧化二磷),发出白光(在空气中燃烧产生黄色火焰),而白磷可以与空气中氧气的发生缓慢氧化,达到着火点(40∘C)时,引起自燃;
(4)氢气在氧气中燃烧,产生淡蓝色火焰,罩一干冷烧杯在火焰上会有水雾生成.
2.氧气与金属反应,例如:
(1)镁在氧气中或在空气中剧烈燃烧,发出耀眼白光,生成白色粉末状物质(即氧化镁);
(2)红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体物质(即四氧化三铁)注意:铁丝在空气中不燃烧,因为空气中氧气的浓度不足以支持铁丝的燃烧;
(3)铜在氧气中或在空气中加热,会逐渐变成黑色的固体(氧化铜).
3.氧气与化合物反应,例如:
(1)一氧化碳在氧气中燃烧产生蓝色火焰,生成能使澄清石灰水变浑浊的气体(即二氧化碳);
(2)甲烷(沼气)在氧气中燃烧火焰明亮呈蓝色,生成能使石灰水变浑浊的气体(即二氧化碳),罩一干冷烧杯在火焰上还会有水雾生成.
(3)酒精(乙醇)在氧气中或在空气中燃烧,产生淡蓝色的火焰,生成能使石灰水变浑浊的气体(即二氧化碳),罩一干冷烧杯在火焰上还会有水雾生成.
(4)蜡烛在氧气中燃烧发出白光,在空气中燃烧发黄光,集气瓶的内壁有水珠出现,并能使澄清的石灰水变浑浊的气体(即二氧化碳).
(5)葡萄糖在酶作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供机体活动和维持恒定体温的需要.
4.呼吸作用是生物从自然界里吸入氧气,而呼出二氧化碳的过程.实际上它是一种缓慢氧化.
7.1.6 从组成上识别氧化物
从组成上识别氧化物就是指氧化物的具体辨析,也就是从氧化物的组成特点上,来分析判断一下某物质是不是氧化物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素的物质.根据氧化物的概念,不难看出氧化物的组成特点是含有两种元素,并且其中一种必须是氧元素(如二氧化硫、五氧化二磷和氧化铜等).
7.1.7 实验室制取氧气的反应原理
实验室制取氧气的反应原理:是指实验室用什么物质,在什么条件下,通过什么反应来制取氧气.一般在实验室里,常采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾.
用文字表达式表示为:过氧化氢二氧化锰→二氧化锰水 氧气、氯酸钾加热二氧化锰→加热二氧化锰氯化钾 氧气、高锰酸钾加热→加热锰酸钾 二氧化锰 氧气.
用化学方程式表示为:2H2O2=MnO22H2O O2↑、2KClO3=△MnO22KCl 3O2↑或2KMnO4=△K2MnO4 MnO2 O2↑.其反应类型都是分解反应.
7.1.8 检查装置的气密性
检查装置的气密性,就是检查一套装置经过装配或连接完毕后,是不是一个密闭的、不漏气的好装置.其检查原理是通过气体的发生装置与辅助容器中的液体(一般是水)构成一个密闭装置,依据改变密闭装置内压强时产生的现象(如冒气泡、形成水柱、液面的升降等)来判断其气密性的好坏.由于气体的发生装置的出口个数不同,因此检查的方法也有所不同.一般考查以下两种情况:
1.气体的发生装置有一个出口时,可利用装置内空气的热涨冷缩原理,如图所示

先把导管插入辅助容器中的水,用手握气体的发生装置,使其中的空气受热膨胀,空气就会从导管口逸出,辅助容器中的水中就会冒出小气泡;当手移开后,其中的空气温度降低,体积收缩,辅助容器中的导管中会形成一小段水柱.此时,说明此装置气密性良好.若看不到冒气泡或者形成水柱,则说明此装置气密性不好.2.气体的发生装置有两个出口时,一定要先设法堵住一个,再进行检查其气密性的好坏.此时又分为两种情况:(1)如果要想堵住的是进气口(即长颈漏斗之类的仪器等),那么就可以先从长颈漏斗中注入水,使水浸没其下端管口,然后再按照上面的气体的发生装置的出口一个的那种情况,进行检查即可.
(2)如果要想堵住的是出气口(即连接有胶皮管的导气管),如图所示:

那么还是要先从长颈漏斗中注入水,当水浸没其下端管口时,用弹簧夹,夹住导气管上连接的胶皮管,保证此处不漏气;然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好.若继续下降,则说明此装置气密性不好.
7.1.9 氧气的制取装置
氧气的制取装置,主要是指氧气的实验室制取装置.它包括发生装置和收集装置两部分.其中,发生装置又分为“固体加热型”和“固液常温型”两种装置;收集装置分为“排水法”和“向上排空气法”两种装置.具体如图所示:

另外,还需要注意的有:
1.在“固体加热型”的装置中,管口应略向下倾斜,铁夹应夹在试管的中上部,应用酒精灯的外焰加热;为了便于氧气的导出,试管内的导管不能伸的太长,刚露出橡皮塞即可.2.在“固液常温型”的装置中,长颈漏斗的下端管口应浸在液面下;同理可知,瓶内的导管不能伸的太长,刚露出橡皮塞即可.3.用排水法收集氧气时,要先将集气瓶装满水,倒立于水槽中,瓶底不能有气泡;当气泡连续、均匀冒出时,再把导管口放在瓶口内开始收集;导管口一开始冒气泡时,不宜立即收集,因为此时的氧气中混有空气.当瓶内收集满氧气(瓶内的水全部排净)时,要在水下用毛玻璃片盖好后取出;将集气瓶正放在桌面上备用即可.4.用向上排空气法收集氧气时,一定要将导管伸到集气瓶的底部,并且收集的时间要稍微延长一点(以防瓶内的空气排不干净),还要注意用毛玻璃片盖住一半瓶口(以防密度更大的气体进入瓶内);否则,会使收集的氧气的纯度不高.不过,这样收集的氧气的纯度确实不如用排水法收集的高,但是比较干燥.
7.1.10 氧气的收集方法
氧气的收集方法,主要有“排水法”和“向上排空气法”两种.选取的原因(即理论依据)分别是根据氧气不易溶于水且不与水发生反应和密度比空气的大且不与空气的成分发生反应.具体操作如图所示:

其中,还需要注意的有:1.用排水法收集氧气时,要先将集气瓶装满水,倒立于水槽中,瓶底不能有气泡;当气泡连续、均匀冒出时,再把导管口放在瓶口内开始收集;导管口一开始冒气泡时,不宜立即收集,因为此时的氧气中混有空气.当瓶内收集满氧气(瓶内的水全部排净)时,要在水下用毛玻璃片盖好后取出;将集气瓶正放在桌面上备用即可.2.用向上排空气法收集氧气时,一定要将导管伸到集气瓶的底部,并且收集的时间要稍微延长一点(以防瓶内的空气排不干净),还要注意用毛玻璃片盖住一半瓶口(以防密度更大的气体进入瓶内);否则,会使收集的氧气的纯度不高.不过,这样收集的氧气的纯度确实不如用排水法收集的高,但是比较干燥.
7.1.11 氧气的检验和验满
氧气的检验方法是用带火星的木条伸入瓶内(或试管内)来检验,如果它能使带火星的木条复燃,则证明该气体是氧气,如图所示:


氧气的验满方法是把带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了.如图所示:


7.1.12 化合反应及其应用
化合反应是指由两种或两种以上的物质生成另一种物质的反应.它是四大基本反应类型之一,可以用通式简明地表示为:A B→AB.其特点是多种物质生成一种物质,可以简记为:“多变一”.例如,点燃S O2=点燃SO2,点燃2Mg O2=点燃2MgO,等等.化合反应的应用是根据化合反应的原理,既可以用来探究、推断物质的化学性质、制取及其用途等,又可以用来推断、鉴别某些物质,还可以采用来置换某些物质,以生成一些人类所需要的物质或新物质,从而极大地丰富人类的物质生活等.
7.1.13 分解反应及其应用
分解反应是指由一种反应物生成两种或两种以上其他物质的反应.它是四大基本反应类型之一,可以用通式简明地表示为:AB→A B.其特点是一种物质生成多种物质,可以简记为:“一变多”.例如,2HgO=△2Hg O2↑,通电2H2O=通电2H2↑ O2↑,等等.分解反应的应用是根据分解反应的原理,既可以用来探究、推断物质的化学性质、制取及其用途等,又可以用来推断、鉴别某些物质,还可以采用来置换某些物质,以生成一些人类所需要的物质或新物质,从而极大地丰富人类的物质生活等.
7.2 氧化和燃烧
7.2.1 氧化反应
氧化反应是指物质与氧发生的反应.但它不是四大基本反应类型之一,因为它只考虑了反应物是不是含有氧,而没有考虑到生成物的问题.其特点是物质与氧的反应,可以简记为:“物与氧反应”.例如,点燃S O2=点燃SO2,点燃2Mg O2=点燃2MgO,等等.
7.2.2 燃烧与燃烧的条件
燃烧是可燃物与氧气发生的一种发光、放热的剧烈的氧化反应.
燃烧的条件:(1)可燃物;(2)氧气(或空气);(3)温度达到着火点.

7.2.3 燃烧、爆炸、缓慢氧化与自燃
燃烧是可燃物与氧气发生的一种发光、放热的剧烈的氧化反应.爆炸是可燃物在有限的空间内急剧地燃烧,就会在短时间内聚集大量的热,使气体的体积迅速膨胀而引起的现象;这种爆炸是化学变化.但是,还有一种爆炸不是由于化学反应引起,而仅仅是由于气体的受热膨胀或压强增大而导致的现象;这种爆炸就是物理变化.缓慢氧化是指有些氧化反应进行得很慢,甚至不容易被察觉,这种氧化叫做缓慢氧化.自燃是指由缓慢氧化而引起的自发燃烧.
燃烧、爆炸、缓慢氧化与自燃的关系,如图所示:

7.2.4 灭火的原理和方法
灭火的原理和方法,主要有如下三种:1.清除可燃物或使可燃物与其他物品隔离;如森林失火时,经常砍到一条带树木(即造隔离带).2.隔绝氧气或空气;如油锅着火时,可盖严锅盖.3.使温度降低着火点以下,如用嘴吹灭燃烧的蜡烛.
7.2.5 几种常用的灭火器
几种常见灭火器的灭火原理和适用范围,如图所示:

7.2.6 物质发生化学变化时的能量变化
物质发生化学变化时的能量变化,就是在物质发生化学反应的同时,通常伴随着热量的变化,即有放热现象或吸热现象发生.当然,有时也涉及到其它形式的能量转化问题;例如,电解水时,电能转化成了化学能;燃料电池时,化学能转化成了电能;等等.
7.3 化学方程式
7.3.1 质量守恒定律及其应用
质量守恒定律是指参加化学反应的各物质的质量总和,等于反应后生成各物质的质量总和.从微观来说,该定律成立的原因是:“在化学反应前后,原子的种类、数目和质量三不变”.该定律的含义是:“宏观上的‘反应前后物质总质量、元素的种类、各元素质量’和微观上的‘原子的种类、原子的数目、原子的质量不变’六不变”.质量守恒定律的应用主要有如下四个方面:1.解释一些实验事实,
例如,细铁丝在氧气中燃烧后的生成物的质量比原来细铁丝的质量大了.利用质量守恒定律解释为:“根据质量守恒定律的含义(即六不变)中的“反应前后物质总质量不变”可知,参加化学反应的铁和氧气的质量之和,等于反应后生成的四氧化三铁的质量;所以,生成物四氧化三铁的质量比原来细铁丝的质量大了”.2.推测一些物质的元素组成,
例如,生物的呼吸作用可以表示为“有机物 氧气→二氧化碳 水 能量”.以下有关有机物的组成元素推断正确的是( )A.只含碳元素 B.只含碳元素和氧元素 C.一定含碳、氢、氧三种元素 D.一定含有碳元素和氢元素,可能含有氧元素.解:根据质量守恒定律的含义(即六不变)中的“元素的种类不变”可知,生成物所含的碳、氢、氧三种元素中的碳元素和氢元素一定来自于有机物,至于氧元素可能全部来自于氧气,也可能部分来自于氧气,另一部分则来自于有机物;所以,选项D是正确的.3.推断一些物质的化学式,
例如,一氧化氮是空气的主要污染物之一.近年来又发现生物体内存在少量一氧化氮,它有扩张血管、增强记忆的功能;这成为当前生命科学的热点.工业上制取一氧化氮的化学方程式为:4X 5O2=4NO 6H2O,则X的化学式为NH3.解:根据质量守恒定律的含义(即六不变)中的“元素的种类不变、原子的种类不变、原子的数目不变”可知,X中应该含有氮元素和氢元素,其化学式中应该含有氮原子和氢原子,并且其原子个数分别是1和3;所以,答案应该是“NH3”.4.计算有关物质的质量,
例如,现将10gA和足量的B混合加热,使它们发生化学反应,10gA完全反应后,生成15gC,则参加反应B的质量是5g.解:根据质量守恒定律的含义(即六不变)中的“反应前后物质总质量不变”可知,反应物B的质量等于生成物C与反应物A的质量之差(即15g−10g).
7.3.2 质量守恒定律的探究实验
该探究是为了验证质量守恒定律而进行的实验探究.为此,教材中安排了如图所示的这四个实验:




来验证和解释质量守恒定律(即参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和).
7.3.3 化学方程式的概念、读法和含义
化学方程式是用化学式来表示化学反应的式子.
化学方程式的读法有三种,具体以化学方程式:点燃C O2=点燃CO2为例,表达如下:
(1)宏观读法:碳与氧气在点燃的条件下生成二氧化碳;
(2)微观读法:每12份质量的碳跟32份质量的氧气完全反应,生成44份质量的二氧化碳;
(3)量的读法:每一个碳原子与一个氧分子在点燃的条件下反应生成一分子二氧化碳.
化学方程式的含义也有三个,它们分别是:
(1)宏观意义:表示反应物、生成物和反应条件(可简记为“反、生、条”);
(2)微观意义:表示各物质之间的粒子个数关系(即该物质之间的粒子个数比);
(3)量的意义:表示各物质之间的质量关系(即各物质之间的质量比).
7.3.4 书写化学方程式、文字表达式、电离方程式
书写化学方程式的步骤:1.根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式,并在式子的左、右两边之间画一条短线;当反应物或生成物有多种时,中间用加号(即“ ”)连接起来.2.配平化学方程式,并检查后,将刚才画的短线改写成等号(表示式子左、右两边每一种元素原子的总数相等).3.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热(常用“△”号表示)、催化剂、通电等.并且,一般都写在等号的上面,若有两个条件,等号上面写一个下面写一个,等等.4.注明生成物中气体或固体的状态符号(即“↑”、“↓”);一般标注在气体或固体生成物的化学式的右边.但是,如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了.书写文字表达式的步骤:1.根据实验事实,将反应物和生成物的名称分别写在式子的左、右两边,并在式子的左、右两边之间标出一个指向生成物的箭头(即“→”);当反应物或生成物有多种时,中间用加号(即“ ”)连接起来.2.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热、催化剂、通电等.并且,一般都写在箭头的上面,若有两个条件,箭头上面写一个下面写一个,等等.
7.3.5 化学方程式的配平
1.化学方程式配平
根据质量守恒定律,反应前后原子的种类、数量不变原则,在反应物和生成物的化学式前适当的配上化学计量数,使得各元素的原子个数在反应中前后相等.化学计量数为“1”是一般不写.但如果方程式中化学式前面有“⊙”或“—”时,也需要写.
2.常用方法
(1)观察法,简单方程式用眼观察即可配平;
(2)最小公倍数法,找出化学方程式中左右两边个出现一次,且原子个数既不相等又又相对较多的元素,求出最小公倍数;
(3)奇数配偶法,找出化学式中两边出现次数最多而且在化学式中原子个数总是一奇一偶的元素,在原子个数是奇数的化学式前面配上最小偶数2,使得原子个数由奇数变为偶数并加以配平,如2配不平,再换成4.如FeS2 O2→Fe2O3 SO2;
(4)可燃烧物的化学方程式的配平法,一般以可燃物作为配平起点先配碳、氢原子个数,最后配氧原子.
1)可燃物中不含氧原子,根据生成物二氧化碳和水中的氧原子个数可以确定氧气前面的化学计量数;
2)可燃物中含有氧元素时,生成的二氧化碳和水中氧原子个数先减去可燃物中氧原子个数在确定氧气前面的化学计量系数;
3)若配平后计量系数出现分数,则在式子的两边同时乘以分母,使得化学计量系数变为整数.
7.3.6 根据化学反应方程式的计算
根据化学反应方程式的计算的步骤一般分为六步:1.设未知量,即---的质量为x.2.书写用到的化学方程式(即写→配→标→注),特别是化学方程式的配平是至关重要的.3.将用到的物质的质量关系标注在相应的化学式的正下方;上行是相对质量关系(即利用相对原子质量或相对分子质量乘以相应的化学计量数得来的),下行是纯物质质量(即已知量和未知量x).4.列计算用到比例式,即上行的相对质量比等于下行的实际质量比.5.求算结果,注意一定要有单位.6.写出简明的答案,一般是问什么就答什么.例:工业上,高温煅烧石灰石(主要成分为CaCO3)可制得生石灰(CaO)和二氧化碳.如果制取10t氧化钙,需要碳酸钙多少吨?”
解:设碳酸钙的质量为x,
高温CaCO3=高温CaO CO2↑10056x10t
10056=x10t
x=17.9t
答:需要碳酸钙17.9t.
7.4 二氧化碳
7.4.1 二氧化碳的物理性质
二氧化碳的物理性质:在通常状况下,它是一种无色、无臭、无味的气体,能溶于水,1体积的水约能溶解1体积的二氧化碳.在20∘C时,将二氧化碳加压到5.73×106 Pa即可变成无色液体,常压缩在钢瓶中存放,在−56.6∘C、5.27×105 Pa时变为固体.液态二氧化碳减压迅速蒸发时,一部分气化吸热,而另一部分骤冷变成雪状固体,将雪状固体压缩,成为冰状固体,即俗你“干冰”.“干冰”在1.013×105 Pa、−78.5∘C时可直接升华变成气体(可用作制冷剂).二氧化碳比空气重,在标准状况下密度为1.977g/L,约是空气的1.5倍.
7.4.2 二氧化碳的化学性质
二氧化碳的化学性质有:1.二氧化碳无毒,不能燃烧,也不能支持燃烧,还不能供给呼吸(它是一种窒息性气体).2.二氧化碳能与水反应生成碳酸,该反应的化学方程式为:H2O CO2=H2CO3.3.二氧化碳能与澄清的石灰水反应,使之变浑浊,该反应的化学方程式为:Ca(OH)2 CO2=CaCO3↓ H2O.4.二氧化碳能与炽热的碳反应,生成一氧化碳,该反应的化学方程式为:高温CO2 C=高温2CO5.二氧化碳与水被绿色植物利用,而进行光合作用的反应,合成有机物(主要是淀粉),该反应的化学方程式为:叶绿体光能6CO2 6H2O=叶绿体光能C6H12O6 6O2.
7.4.3 探究二氧化碳的性质
探究二氧化碳的性质就是通过设置实验、问题情景,来探究二氧化碳的性质;它包括物理性质和化学性质两部分.具体如下:1.二氧化碳的物理性质是:在通常状况下,它是一种无色、无臭、无味的气体能溶于水,溶解度为1.45g/L(25∘C,100kPa).在20∘C时,将二氧化碳加压到5.73×106 Pa即可变成无色液体,常压缩在钢瓶中存放,在−56.6∘C、5.27×105 Pa时变为固体.液态二氧化碳减压迅速蒸发时,一部分汽化吸热,二另一部分骤冷变成雪状固体,将雪状固体压缩,成为冰状固体,即俗你“干冰”.“干冰”在1.013×105 Pa、−78.5∘C时可直接升华变成气体(可用作制冷剂).二氧化碳比空气重,在标准状况下密度为1.977g/L,约是空气的1.5倍.
2.二氧化碳的化学性质有:
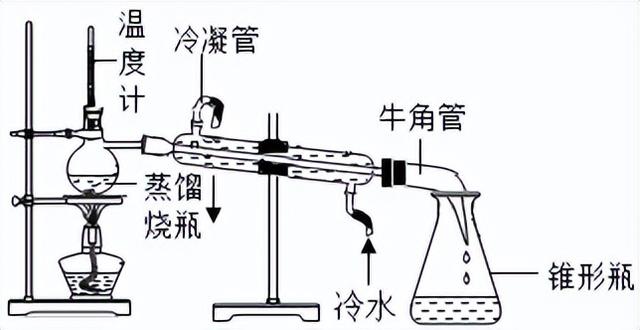
(1)二氧化碳无毒,不能燃烧,也不能支持燃烧,还不能供给呼吸(它是一种窒息性气体).
(2)二氧化碳能与水反应生成碳酸,该反应的化学方程式为:H2O CO2=H2CO3.
(3)二氧化碳能与澄清的石灰水反应,使之变浑浊;该反应的化学方程式为:Ca(OH)2 CO2=CaCO3↓ H2O.
(4)二氧化碳能与炽热的碳反应,生成一氧化碳.该反应的化学方程式为:高温CO2 C=高温2CO.
(5)二氧化碳与水被绿色植物利用,而进行光合作用的反应,合成有机物(主要是淀粉).该反应的化学方程式为:叶绿体光能6CO2 6H2O=叶绿体光能C6H12O6 6O2 .
3.探究实验
①二氧化碳的倾倒实验
|
实验操作 |
实验现象 |
实验结论 |
|
将二氧化碳慢慢倒入烧杯中
|
低的蜡烛先熄灭,高的蜡烛后熄灭. |
二氧化碳不能燃烧,也不能支持燃烧 |
②二氧化碳的溶解性实验
|
实验操作 |
实验现象 |
实验结论 |
|
向一个收集满二氧化碳气体的质地脚软的塑料瓶中加入约13体积的水,立即旋紧瓶盖,振荡
|
塑料瓶变瘪 |
二氧化碳能溶于水 |
7.4.4 二氧化碳的实验室制法
二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取,用向上排空气法进行收集.其反应原理是CaCO3 2HCl=CaCl2 CO2↑ H2O.其制取装置如图所示:

7.4.5 二氧化碳的检验和验满
二氧化碳的检验方法是将该气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明该气体是二氧化碳.
二氧化碳的验满方法是用燃着的木条放在瓶口,如果木条熄灭则说明瓶内已收集满二氧化碳
7.4.6 二氧化碳的用途
二氧化碳的用途,如图所示:


也就是,用于光合作用和灭火,用作化工原料和气体肥料,其固体(即干冰)可作制冷剂.可见,它对自然界的生命活动是非常重要的.没有二氧化碳,绿色植物就无法进行光合作用,也就无法满足人和动物所需的有机物的合成和对氧气的需求;以及空气中氧气含量的相对稳定和自然界的碳、氧的循环,等等.
7.5 生物的呼吸和呼吸作用
7.5.1 呼吸作用的概念和意义
1.概念:活细胞利用氧,将有机物分解成二氧化碳和水,并且将储存在有机物中的能量释放出来。供给生命活动的需要,这个过程叫作呼吸作用。2.呼吸作用的表达式:

3.呼吸作用的场所:生物体的所有活细胞在生命活动中都要消耗能量,细胞中的线粒体是呼吸作用的主要场所,是细胞中的能量转换器。4.呼吸作用的意义:呼吸作用是生物体获得能量的主要方式。5.影响呼吸作用的外界因素:温度、水分、氧气和二氧化碳浓度是影响呼吸作用的主要因素。(1)温度:温度对呼吸作用的强度影响最大,温度升高,呼吸作用加强;温度过高,呼吸作用减弱。(2)水分:植物含水量增加,呼吸作用加强。(3)氧气:在一定范同内,随着氧气浓度的增加,呼吸作用显著加强。(4)二氧化碳:二氧化碳浓度大大超出正常值时,抑制呼吸作用,在储藏蔬菜、水果、粮食时采取低温、干燥、充加二氧化碳等措施,可延长储藏时间。
7.5.2 呼吸系统的组成和功能
1.呼吸系统的组成:由呼吸道和肺组成。呼吸系统具有适合与外界进行气体交换的结构和功能。
(1)呼吸道:鼻、咽、喉、气管、支气管,是气体进出肺的通道。
呼吸道的作用:气体的通道,对吸入的气体进行处理,使肺部的气体温暖、湿润、清洁。
(2)肺:是进行气体交换的器官,全身的静脉血在肺泡毛细血管处动脉化,将氧气带到全身各个器官。


7.5.3 呼气和吸气
肺的通气:肺与外界进行气体交换的过程,就是肺的通气。肺的通气是通过呼吸运动实现的,胸廓有节律地扩大和缩小叫作呼吸运动。呼吸运动包括呼气和吸气两个过程(平静呼吸),其动力来自于呼吸肌。与呼吸有关的肌肉叫呼吸肌。呼吸肌主要指的是肋骨间肌肉(肋间肌)和膈肌,肋间肌又包括肋间外肌和肋间内肌。胸廓横向地扩张和收缩,是肋间肌和膈肌收缩和舒张的结果。
呼气和吸气
1.吸气时,肋间外肌收缩,肋骨上提,胸骨向上、向外移动,使胸廓的前后径和左右径都增大;同时,膈肌收缩,膈顶部下降,使胸廓的上下径增大。这时,胸廓扩大,肺随着扩张,肺的容积增大,肺内气压下降,外界空气就通过呼吸道进入肺,完成吸气动作。
2.呼气时,肋间外肌舒张,肋骨因重力作用而下降,胸骨向下、向内移动,使胸廓的前后径和左右径都缩小:同时,膈肌舒张,膈顶部回升,使胸廓的上下径缩小。这时,胸廓缩小,肺跟着回缩,肺的容积缩小,肺内气压升高,迫使肺泡内的部分气体通过呼吸道排到体外,完成呼气动作。

3.特别提醒:
(1)无论是吸气还是呼气,在结束的一瞬间,肺内气压都等于外界气压。
(2)平静呼吸时,吸气是主动的,呼气是被动的。深呼吸时,吸气和呼气都是主动的。深呼吸时除了胸部肌肉参与活动外,腹部的肌肉也参与了活动。
7.5.4 肺的结构和功能
1.肺:
肺位于胸腔内,左右各一个,共五叶,左二右三,是呼吸系统的主要器官,也是气体变换的场所。
2.肺的结构:
支气管入肺后反复分支,愈分愈细,形成许多树枝状的分支,这甚分支的结构与气管相似,但随其管径变小,管壁变薄,软骨环逐渐变小,平滑肌则相对地逐渐增加。分支到细支气管口(口径在1毫米以下的小管)时,管壁的软骨环消失,管壁几乎全部由平滑肌构成,它的收缩和舒张影响着细支气管口径的大小,从而控制进出肺内的气体量。细支气管再分支到呼吸性细支气管时,其管壁的某些部位向外突出,形成肺泡。因此,肺内含有大量的肺泡。
3.肺适于气体交换的特点:
(1)肺泡数量多,肺泡外包绕着许多毛细血管和弹性纤维。
(2)肺泡壁和毛细血管壁均只由一层上皮细胞构成,有利于肺泡和血液进行气体交换。

7.5.5 肺泡内的气体交换
肺泡内的气体交换1.气体交换原理:气体总是由多的地方向少的地方扩散,即总是由浓度高的地方向浓度低的地方扩散,直到平衡为止。气体的浓度与压强有关,浓度高,压强就大;浓度低,压强就小。因此也可以说,气体是由压强高的地方向压强低的地方扩散的。气体在肺泡和组织内的交换,都是通过这种扩散作用实现的。2.肺泡与血液之间的气体交换:当空气中的氧气进入肺泡时,肺泡内的氧气比血液中的多,故氧气由肺泡进入血液;而血液中的二氧化碳比肺泡中的多,故二氧化碳由血液进入肺泡。

肺泡与血液进行气体交换后,肺泡中的二氧化碳通过呼气排到体外,进入血液的氧气随着血液循环不断输送到全身各处的组织细胞里被利用。
7.5.6 人工呼吸
根据呼吸运动的原理,可用人工方法让胸廓有节律地扩大和缩小,以帮助呼吸运动减弱或暂时停止呼吸的患者维持肺的通气功能,这就叫人工呼吸,最常用的人工呼吸法是口对口吹气法。做人工呼吸时,如果口腔内有泥土、血块等,必须先清除干净,使病人保持呼吸道的畅通,然后再进行口对口的吹气。成年人在平静状态下的呼吸频率大约是15−20次/分,人体活动加强时,呼吸的频率和深度都会增加,人工呼吸的频率应和人体自然呼吸的频率相同。
7.5.7 呼吸系统的卫生保健
呼吸系统的卫生保健:(如图)
首先不要有伤害呼吸系统的恶习,如吸烟;其次要保持所居住环境的空气清洁,可以养些植物,以净化空气。

7.5.8 探究植物的呼吸作用
探究过程1.植物呼吸作用产生二氧化碳(1)取甲、乙两个锥形瓶,在每个锥形瓶内倒入少量的澄清石灰水。
(2)实验前一天,将100g新鲜的和烫过的蔬菜分别装入两个不漏气的黑色塑料袋中插入软管扎紧袋口,并用止水夹夹紧软管。

(3)取两袋蔬菜,将软管分别插入盛有澄清石灰水的锥形瓶中,移开止水夹,轻轻地挤压塑料袋。(小组成员仔细观察并记录,教师巡回指导。)2.教师提出问题:实验用的塑料袋为什么是黑色的?用白色塑料袋可以吗?3.小组内同学展开讨论,得出以下两种结论:(1)可以用白色塑料袋,因为绿色植物在白色塑料袋内也能呼吸,呼吸就能产生二氧化碳,能使石灰水变浑浊。(2)不能用白色塑料袋。因为在光照下若用白色塑料袋,里面的绿色植物不但进行呼吸而且进行光合作用。光合作用会利用二氧化碳,使二氧化碳含量减少,不能使石灰水变浑浊,因此不能证明植物呼吸作用产生二氧化碳。
7.6 光合作用
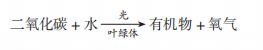
7.6.1 光合作用的概念和实质
光合作用的概念
1.概念:
绿色植物利用光提供的能量,在叶绿体中把二氧化碳和水合成了淀粉等有机物,并且把光能转化成化学能,储存在有机物中,这个过程就叫光合作用。
2.反应式:

叶片见光部分遇到碘液变蓝,说明叶片的见光部分产生了有机物——淀粉
3.条件:
光和叶绿体是不可缺少的条件,其中光能供给能量,叶绿体提供光合作用的场所。

7.6.2 光合作用的意义
光合作用的公式:
意义:光合作用是一切生物生存、繁衍和发展的根本保障。绿色植物通过光合作用制造的有机物不仅能满足自身生长、发育和繁殖的需要,而且为生物圈中的其他生物提供了基本的食物来源,其产生的氧气是生物圈的氧气的来源。
7.6.3 呼吸作用与光合作用的区别和联系
呼吸作用与光合作用的区别和联系

从物质转变和能量转变上看,光合作用是物质合成与储能的过程,呼吸作用是物质分解与释能的过程,这是两个正好相反的过程。但两者并非简单的逆转。

7.6.4 探究光合作用的条件、场所、原料和产物
1.确定课题
2.作出假设
3.设计方案
原理提示:从蚕豆(或其他植物)上选取健壮、叶龄相似的成长叶数片,用直径1cm的钻孔器,避开叶脉,打小圆片数十片,放于大注射器中注入水,排除空气后,用手指堵住注射器前端小孔,把活塞用力往后拉,即可造成减压环境而逐出叶肉组织中的空气,放开手指,水即进入组织中,如此重复多次,整个叶子圆片全部充满水分而下沉。把下沉的圆叶片连同水倒入小烧杯中,放在黑暗处备用。
植物进行光合作用时,吸收二氧化碳放出氧气,由于氧气在水中的溶解度很小,而在细胞间隙中积累,结果会使原来下沉的叶片上浮。
请根据你们前面提出的假设,思考以下其中一个问题,小组同学通过讨论,设计出你们下一步的实验方案。
(1)如果你探究的是光照对光合作用的影响,你如何设置单一的光照变量?根据什么现象观察实验结果?
(2)如果你探究的是温度对光合作用的影响,你如何设置单一的光照变量?根据什么现象观察实验结果?
(3)如果你探究的是二氧化碳对光合作用的影响,你如何设置单一的光照变量?根据什么现象观察实验结果?
(当然你也可以不参照提示,自己设计一个更合理的方案)
1.选择你所需要的实验器材:叶片、打孔器、注射器、烧杯、40W台灯、温度计、可调式控温器、NaHCO3。
2.方法步骤:
3.实验结果记录:
请你设计一个简单、合理的表格,记录你的实验结果。
4.老师选择几组实验方案设计得较好的组别,派代表到讲台宣读,供其他组别参考,经进一步修改完善后便可实施。
5.实施方案
按实验方案进行操作,仔细观察,认真记录。
6.分析与结论
把你的实验结果填写在前面设计的记录表上,并根据实验结果绘出曲线图。小组同学共同分析和讨论实验结果,得出结论。
7.表达与交流
向全班同学展示你们的实验成果,并对其他小组提出的质疑作出合理的解答;认真倾听其他小组的汇报,共同归纳出提高光合作用强度的措施。
7.7 自然界中的氧循环和碳循环
7.7.1 温室效应和臭氧层破坏造成的影响及其防治
1.产生:温室效应主要是由于现代化工业社会过多燃烧煤炭、石油和天然气,大量排放尾气,这些燃料燃烧后放出大量的二氧化碳气体进入大气造成的。二氧化碳气体具有吸热和隔热的功能。它在大气中增多的结果是形成一种无形的玻璃罩,使太阳辐射到地球上的热量无法向外层空间发散,其结果是地球表面变热起来。因此,二氧化碳也被称为温室气体。2.影响:(1)气候转变。“全球变暖”温室气体浓度的增加会减少红外线辐射放射到太空外,地球的气候因此需要转变来使吸取和释放辐射的份量达至新的平衡。(2)地球上的病虫害增加。温室效应可使史前致命病毒威胁人类。(3)海平面上升。假若“全球变暖“正在发生,有两种过程会导致海平面升高。第一种是海水受热膨胀令水平面上升。第二种是冰川和格陵兰及南极洲上的冰块溶解使海洋水份增加。(4)气候反常,海洋风暴增多。(5)土地干旱,沙漠化面积增大。3.温室效应的预防对策:(1)全面禁用氟氯碳化物。(2)保护森林的对策方案:今日以热带雨林为主的全球森林,正在遭到人为持续不断的急剧破坏。有效的因应对策,便是赶快停止这种毫无节制的森林破坏,另一方面实施大规模的造林工作,努力促进森林再生。(3)汽车使用燃料状况的改善。(4)改善其他各种场合的能源使用效率。(5)对化石燃料的生产与消费,依比例课税。(6)鼓励使用天然瓦斯作为当前的主要能源。(7)汽机车的排气限制。(8)鼓励使用太阳能。(9)开发替代能源,利用生物能源(Biomass Energy)作为新的干净能源。4.臭氧层破坏会造成以下危害:(1)对人类的影响过量的太阳紫外线辐射对人类健康最直接的危害是破坏脱氧核糖核酸(即DNA),而DNA的损伤会导致癌症。在和紫外线辐射有关的诸多病症中,尤为引人注意的是晒斑,它被认为是引起皮肤癌的主要原因。损害眼睛(角膜和晶状体),从而增加白内障患者。危害免疫系统,增加传染疾病的发病率,如疟疾、流行性感冒和疤疹等,并减弱接种疫苗的效果。(2)对动物的影响增加家禽患病率,导致减产。对鱼类、虾、蟹、浮游动物和水体等都有很大损害,从而降低水产品产量。(3)对植物的影响紫外线辐射的增强会改变植物的叶面结构、生理功能、芽苞发育过程等,对小麦、稻米、大豆、大麦、土豆等主要农作物产生有害影响,从而降低农作物的产量。破坏树木的正常生长,减少森林种类的数量,对森林生态系统有相当大的破坏。对浮游植物和构成水生食物链的植物也都有很大损害。(4)对材料的影响塑料和橡胶制品使用寿命越来越短,例如温室用塑料和汽车轮胎等,需要经常被更换。
7.7.2 光合作用原理在生产上的应用
光合作用在农业生产上的应用:1.合理密植合理密植既充分利用了单位面积上的光照而避免造成浪费,又不至于让叶片相互遮挡,影响光合作用的进行。2.间作套种(立体种植)立体种植就是把两种或两种以上的作物,在空间和时间上进行最优化组合,以达到增产,增收,延长应的目的。3.增加二氧化碳的浓度二氧化碳是植物进行光合作用的主要原料,空气中二氧化碳浓度一般是0.03%,当空气中二氧化碳的浓度为0.5%~0.6%时,农作物的光合作用就会显著增强。产量有较大的提高。在温室中,增加二氧化碳浓度的方法有很多。例如,增施有机肥料(农家肥),利用微生物分解有机物放出二氧化碳;喷施储存在钢瓶中的二氧化碳;用化学方法产生二氧化碳等。4.其他方面植物光合作用受诸多因素的影响,最大限度地满足农作物光合作用对水、无机盐、温度、光照等方面的要求,农业生产就能获得丰收。
7.7.3 绿色植物有助于维持生物圈中的碳氧平衡
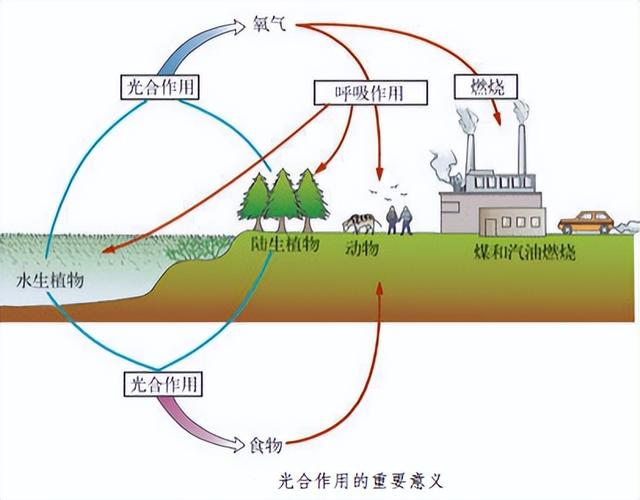
绿色植物是生物圈中有机物的制造者及维持生物圈中的碳-氧平衡:光合作用是指绿色植物利用光能,在叶绿体里,把二氧化碳和水合成有机物,释放氧气,并把光能转化成化学能储存在制造的有机物中的过程,可见绿色植物光合作用的意义有三个:1.完成物质转变。它把无机物转变成有机物,不仅用来构成植物体的本身,也为其它生物以及人类制造了食物和其他生活资料。同时释放出氧气,除了满足植物自身的需要外,还供给了动物呼吸利用。2.完成了自然界规模巨大的能量转变。在这一过程中,它把光能转变为贮存在有机物中的化学能。是自然界的能量源泉。3.从根本上改变了地面上的生活环境。维持大气中氧气和二氧化碳的相对平衡。由这三大意义可知:绿色植物的光合作用是地球上生物的食物、氧气和能量的源泉。


7.8 空气污染与保护
7.8.1 空气质量影响人体健康
空气质量影响人体健康
1.空气质量影响人体健康:
大气中的污染物对人体健康的危害极大。这些污染物既可以引起包括肺癌在内的呼吸系统疾病,还可以通过呼吸系统进入血液,引起其他系统的疾病,如引起急性中毒和死亡、慢性中毒等,另外还有致畸变的作用。
2.空气质量的三项常用指标:
空气污染指数、空气质量状况、可吸入颗粒物,空气污染指数和空气质量状况的关系见下表:

可吸入颗粒物是指飘浮于空气中的、粒径小于10微米的颗粒物,包括固体颗粒物、液体微粒与固体吸附被体或气体后形成的颗粒物。可吸入颗粒物容易被人吸入,因此与人体健康有密切的关系。近些年来。许多国家将可吸入颗粒物列为检测空气质量的一项重要指标。
3.大气污染的来源:
(1)工业生产的排放
发电厂、钢铁厂、氮肥厂、烧碱厂等各类工厂排放的粉尘、二氧化硫等。
(2)车辆,船舶尾气
车辆、船舶排放的污染物主要有碳氢化合物、一氧化碳(CO)和氮氧化物(NOx)等。
(3)秸秆焚烧
在田间焚烧秸杆,会给空气质量造成很大的影响。空气中弥漫着的烟雾会对人体呼吸道产生刺激。引起呼吸系统疾病。另外,也降低了空气的能见度,还会影响飞机的正常飞行。
(4)地面扬尘
地面扬尘主要来自各种建筑工地和沙尘暴天气,其中直径在10微米以下的能长时间飘浮在空气中。扬尘沉积于肺部,会引起呼吸系统疾病,如咳嗽、哮喘等,并加重呼吸系统疾病。
4.防治大气污染的措施:
控制污染物排放是防治大气污染、改善空气质量的根本措施。此外,植物有吸附和吸收各种有害污染物的功能,大面积的树林效果尤为显著,因此植树造林是防治大气污染的有效措施。
7.8.2 酸雨对生物的影响及其防治
1.酸雨是指PH值小于5.6的雨雪或其它形式的大气降水,是大气受污染的一种表现。当大气受到污染时,大气中的酸性气体如二氧化硫、氮氧化物浓度增高,溶于雨雪中生成亚硫酸、硝酸使降水的PH值降低。
2.酸雨的形成是一种复杂的大气化学和大气物理现象。煤和石油燃烧以及金属冶炼等过程释放到大气中的二氧化硫,通过一系列的气相或液相氧化反应生成硫酸。高温燃烧生成的一氧化氮排入大气中大部分转化为二氧化氮,遇水生成硝酸和亚硝酸。
3.酸雨对生物的危害:
(1)使土壤中的养分发生化学变化,从而不能被植物吸收利用;
(2)使河流和湖泊酸化,从而影响鱼虾等水生生物的生长发育甚至死亡;
(3)引起水源酸化,影响饮用;
(4)直接危害植物的叶和芽。
4.控制酸雨的根本措施在于减少二氧化硫和氮氧化物的人为排放。
目前的有效手段是使用干净能源,发展水力发电和核电站,使用固硫的型煤,使用锅炉固硫、脱硫、除尘新技术,发展内燃机代用燃料,安装机动车尾气催化净化器,培植耐酸雨农作物和树种等。
7.8.3 采集和测算空气中的尘埃粒子
1.准备:(1)材料用具:载玻片、透明胶带(宽)、缝衣针、凡士林(2)加工载玻片:将透明胶带贴在载玻片背后,用缝衣针在透明胶带上画出20毫米×20毫米的方格,再分成2毫米×2毫米的小方格100个,在载玻片的正面涂上凡士林。2.采样:采集空气中的尘埃粒子。采样地点:学生宿舍、教室、走廊等。采样时间:1−4小时。3.计数:选择五点20个小格计数,算出这20格的平均粒子数,再乘以100,就可算出所有小方格内的粒子数。五点取样法:在进行科学研究和社会调查时,对于怎样抽取样本有一定的要求。这里采用的是先确定对角线的中点作为中心抽样点,再在对角线上选择四个与中心样点距离相同的点作为样点,这就是五点取样法。五点取样法在农田产量的估测等方面用得较多。4.探究:(1)提出问题。(2)制定并实施计划:通过小组讨论,确定采样的时间、地点、方法及组员间的分工,按计划去做,及时回收样本,并在显微镜下观察和计数。(3)表达与交流:交流各自的研究结果,就实验设计方案、测算结果展开小组讨论。
8 植物与土壤
8.1 土壤的成分
8.1.1 水对植物分布的影响
1.水对植物的作用:(1)水是原生质的主要成分。原生质的含水量一般在80%~90%,这些水使原生质呈溶胶状态,从而保证了新陈代谢旺盛地进行,例如根尖、茎尖就是这样。如果含水量减少,原生质会由溶胶状态变成凝胶状态,生命活动就大大减弱,例如休眠的种子就是这样。如果细胞失水过多,就可能引起原生质破坏而招致细胞死亡。(2)水是新陈代谢过程的反应物质。在光合作用、呼吸作用、有机物的合成和分解的过程中,都必须有水分子参与。(3)水是植物对物质吸收和运输的溶剂。一般说来,植物不能直接吸收固态的无机物和有机物,这些物质只有溶解在水中才能被植物吸收。同样,各种物质在植物体内的运输也必须溶解于水中才能进行。(4)水能保持植物体的固有状态。细胞含有大量水分,能够维持细胞的紧张度(即膨胀),使植物体的枝叶挺立,便于充分接受光照和交换气体,同时也使花朵开放,有利于传粉。(5)水能维持植物体的正常体温。水具有很高的汽化热和比热,又有较高的导热性,因此水在植物体内的不断流动和叶面蒸腾,能够顺利地散发叶片所吸收的热量,保证植物体即使在炎夏强烈的光照下,也不致被阳光灼伤。2.水影响植物的分布:水在生物圈的分布是不均匀的。有的地区雨最充沛,气候湿润;有的地区终年少雨,气候干燥,水的多少直接影响植物的分布。在我同,从东到西、从湿润到干旱,依次分成三个大的植被区域--湿润森林区域、半干旱草原区域和干早荒漠区域。在湿润森林区域内,从南到北依次分布着热带雨林、亚热带常绿阔叶林、温带落叶阔叶林和寒温带落叶针叶林;在半干旱草原区域分布着温带草原和高寒草甸草原;在干旱荒漠区域分布着温带荒漠和高寒荒漠。
8.1.2 土壤的成分与形成过程
1.土壤的成分:
(1)土壤中的生命——土壤生物:生活在土壤中的各类生物统称为土壤生物,如动物、植物、细菌、真菌等。
(2)土壤中的非生命物质:空气、水、无机盐和有机物等。
2.从岩石到土壤:
从岩石到土壤的形成,是一个长时间多种自然因素共同作用的及其复杂的过程。即存在岩石从大到小的过程和有机物在岩石颗粒的积累过程。(1)风化:自然外力—风力、水流外力、水形成冰产生的外力;热胀冷缩骤热骤降使岩石爆裂;植物和动物的作用。(2)植物和动物的尸体和排泄物积累在岩石颗粒间,是土壤腐殖质和有机物的重要来源。(3)土壤的形成目前还在正常进行,土壤形成的速度极其缓慢,所以我们要注意保护耕地。
8.1.3 合理灌溉
1.合理灌溉:灌溉的基本要求是利用最少量的水取得最好的效果。合理灌溉要有一个量化标准。这可以根据土壤容重、土壤有效水分、萎蔫系数、田间持水量来确定。2.灌溉时期:灌溉的基本要求是利用最少量的水取得最好的效果。进行合理灌溉,首先要注意选择灌溉时期,具体有以下四种方法:(1)根据土壤湿度决定灌溉时期。判断准确,但不能充分发挥灌溉效益,因为灌溉的真正对象是植物而不是土壤。(2)根据植物水分临界期事先拟定灌溉方案。但因不同年份的气象条件不同、不同地块植物生长不同而常会有所变动。(3)根据灌溉形态指标确定灌溉时期。植物缺水时,幼嫩的茎叶因水分供应不上而发生凋萎,茎颜色转为暗绿或变红,生长速度下降。这种方法的优点是灌溉形态指标易观察,缺点是需要经过多次实践才能掌握好。(4)依据灌溉生理指标确定灌溉时期。一般地,我们将叶片长势、细胞液浓度、渗透势和气孔开张度作为灌溉的生理指标。3.量化标准:合理灌溉要有一个量化标准。这可以根据土壤容重、土壤有效水分、萎蔫系数、田间持水量来确定。4.灌溉方法:灌溉的方法也很重要。作物的灌溉方法通常采用的是沟渠排灌法。但是近年来,人们又较广泛地应用了喷灌(sprinkling irrigation)和滴灌(drop irrigation)技术。喷灌技术是利用喷灌设备将水喷到作物的上空呈雾状,再降落到作物或土壤中。滴灌技术是指在地下或土表装上管道网络,让水分定时定量地流出到作物根系的附近。上述两种方法都可以更有效地节约和利用水分,同时是作物能及时地得到水分。土壤有效水分最大含量=田间持水量−萎蔫系数例如:在某地1亩(667平方米)土地耕层厚度20厘米,容重1.15克/立方厘米,萎蔫系数为5%,田间持水量25%。由此可知,该地块的耕层总重量为:6.67×106×20×1.15=1.5×108(克)=150(吨)每亩灌溉定额为:150吨×(25%−5%)=30吨通过明确的量化标准,可以使土壤含水量始终保持在植物能正常生长的范围内。
8.2 各种各样的土壤
8.2.1 土壤的结构与植物生长
1.土壤的结构(1)土壤的组成:土壤由矿物质颗粒、腐殖质、水和空气组成;矿物质颗粒较小,土壤的空隙就较小,于是水和空气也就少。(2)土壤主要由矿物质颗粒构成(矿物质占固体部分的95%),矿物质的多少影响土壤结构。矿物质颗粒粗的叫砂粒,细的叫黏粒,介于两者之间的叫粉砂粒。
土壤颗粒的分类
|
名称 |
直径/毫米 |
|
砂粒 |
2.0−0.02 |
|
粉砂粒 |
0.02−0.002 |
|
黏粒 |
<0.002 |
2.土壤的分类:
根据土壤中砂粒、粉砂粒和黏粒所占的比例不同,分为砂土类土壤、黏土类土壤、壤土类土壤。(1)砂土类土壤:砂粒多,黏粒少;土壤颗粒较粗。(2)黏土类土壤:黏粒、粉砂多;土壤颗粒较细。(3)壤土类土壤:砂粒、黏粒、粉砂大致相等;土壤质地较均匀。【总结】①通气性能最强--砂土类土壤②透水性能最强--砂土类土壤③保水性能最强--黏土类土壤
④通气性能最差--黏土类土壤
3.土壤的性状与植物的生长:最适合植物生长的土壤是黏性适度,通气透水,保水保肥能力强的土壤。(1)砂土类土壤 :疏松,不易黏结,通气、透水性能强,易干旱。有机质分解快,易流失。(2)黏土类土壤 :质地黏重,湿时黏,干时硬。保水、保肥能力强,通气、透水性能差。(3)壤土类土壤 :不太疏松,也不太黏。通气、透水,能保水、保肥,宜于耕种。壤土类土壤最适合大部分植物生长,土壤固体部分(矿物质颗粒和腐殖质)占土壤总体积的50%,其中有机质占固体部分的

;水和空气各占25%。这样既通气、透水,又保水,保肥,能为植物的生长提供充足的水分、空气和有机质。
8.3 植物的根与物质吸收
8.3.1 根系及其在土壤里的分布和意义
大多数陆生植物的根在地下分布深而广,形成庞大的根系,比地上的枝叶系统还发达。可谓“根深叶茂”,“树大根深”,可见根在植物生长过程中的重要作用。
1.根系:根系是一株植物上所有根的总和由种子的胚根发育而成的根叫主根,主根向土壤深处生长;从主根上生出的根叫侧根,主根与侧根相连,向土壤四周生长;从茎、叶上生出的根叫不定根;根系是一株植物上所有根的总和。主要由主根和侧根组成的根系叫直根系,直根系主根发达,直而粗,侧根细小如大豆、萝卜的根系;主要由不定根组成的根系叫须根系,须根系主根不明显,不定根发达如玉米、小麦的根系。

2.根系在生长过程中,具有向水性。蹲苗、烤田是土壤表层的水分少,利用根的向水性促进根向土壤深处(水分较多)生长;
3.根还具有向土壤肥力高的地方生长的特性即根的向肥性,深层施肥有利于促进根向土壤深处生长;
4.由于重力作用向地的一面生长素浓度高,高浓度生长素对植物根有抑制生长的作用,所以根向近地的一面弯曲生长,使根从地表发芽向下生长,使根的生长具有向地性。
8.3.2 根尖结构与功能特点
根尖结构以及与吸收功能相适应的特点:
1.根尖是指从根的顶端到生有根毛的一段.根尖的结构从顶端向上,一般可以划分为四个部分:根冠、分生区、伸长区和成熟区。


2.特点
(1)根冠位于根的顶端,属于保护组织,细胞比较大,排列不够整齐,像一顶帽子似地套在外面,具有保护作用。
(2)分生区被根冠包围着,属于分生组织,细胞很小,细胞壁薄,细胞核大,细胞质浓,具有很强的分裂能力,能够不断分裂产生新细胞,向下补充根冠,向上转化为伸长区。
(3)伸长区在分生区上部,细胞逐渐停止分裂,开始迅速伸长,是根伸长最快的地方,是根深入土层的主要推动力,能够吸收水分和无机盐。
(4)成熟区也叫根毛区:在伸长区的上部,细胞停止伸长,并且开始分化,表皮一部分向外突起形成根毛。根吸收水分和无机盐的主要部位。成熟区及其上部,根内部一部分细胞分化形成导管,能输导水分和无机盐。注:①根的不断生长是伸长区细胞不断伸长和分生区细胞不断分裂的结果;②根吸收水分和无机盐主要是通过根毛区的根毛实现的;③根尖的四部分结构中,出现细胞分化的是根毛区,它的内部形成了导管,表面形成了根毛;④植物的根毛很多,一条根毛就是一个表皮细胞的突起。根毛细胞内液泡大,细胞质少,细胞壁极薄,这些特点都有利于水分和无机盐进入根毛,所以,根毛区是根吸收水分和无机盐的主要部位。
8.3.3 根对水和无机盐的吸收
植物吸收水和无机盐的主要器官是根。根适于吸水的特点是根尖成熟区生有大量的根毛,大大增加了根与土壤中水接触的面积,有利于吸水。而且根尖成熟区及其内部一部分细胞分化形成导管,能输导水分和无机盐。因此植物根吸收水的主要部位是根尖的成熟区。

8.3.4 植物细胞的吸水、失水
植物细胞的吸水和失水:
1.这主要取决于细胞周围水溶液的浓度和植物细胞细胞液的浓度的大小,当周围水溶液的浓度小于细胞液的浓度时,细胞就吸水。
2.当周围水溶液的浓度大于细胞液的浓度时,细胞就失水。

8.3.5 植株的生长发育所需营养物质:水、无机盐和有机物
植物的生长需要的营养物质有:水、无机盐、有机物。
有机物是植物通过光合作用制造的,水和无机盐是植物通过根从土壤中吸收的。植物的生活需要多种无机盐,但以含氮的、含磷的、含钾的无机盐需要量最大,不同的植物需要的无机盐的含量和种类都不同,同一植物的不同时期对无机盐的需要量也不同,所以对植物要做到合理施肥。
8.3.6 无机盐的类型及其对植物的作用
植物的生长需要多种无机盐,无机盐对植物的生长发育起着重要的作用,这些无机盐包括含氮、磷、钾、钙、镁、硫、硼、锰、锌、钼等的多种无机盐,其中植物生活中最多的无机盐是含氮、磷、钾的无机盐。
氮肥作用:促使作物的茎,叶生长茂盛,叶色浓绿;
钾肥的作用:促使作物生长健壮,茎秆粗硬,增强病虫害和倒伏的抵抗能力;促进糖分和淀粉的生成;
磷肥的作用:促使作物根系发达,增强抗寒抗旱能力;促进作物提早成熟,穗粒增多,籽粒饱满。
粪等肥料中含有大量的有机物,其中的微生物可以分解有机物产生水和无机盐,施肥的目的就是给植物提供生长必需的无机盐。
|
元素 |
对植物生长的作用 |
植物缺乏和过量时的症状 |
|
含氮(N)的无机盐 |
促进细胞的分裂和生长,使枝叶长的繁茂,增加产量,延缓衰老 |
缺乏症状:植株矮小瘦弱,叶片发黄,严重时叶脉呈淡棕色 |
|
含磷(P)的无机盐 |
促进幼苗的发育和花的开放,使果实、种子的成熟提前,增强抗性等 |
缺乏症状:生长缓慢,发育迟缓,嫩叶变小,老叶先呈暗绿色,后转变为微红色或紫红色过量症状:开花提前 |
|
含钾(K)无机盐 |
是合成糖和转运糖的重要元素,也是许多酶的活化剂;可以调节气孔的开闭,增加细胞壁的厚度,尤其能促进植物茎秆健壮,促进淀粉的合成 |
缺乏症状:生长缓慢、茎细,易倒状,叶片易干尖,老叶易发黄,出现褐斑过量症状:会出现节间变短、叶片泛黄等中毒现象 |
8.3.7 合理施肥
1.合理施肥:合理施肥是实现高产、稳产、低成本,环保的一个重要措施。
(1)要做到因土施磷、看地定量;
(2)根据各类作物需肥要求,合理施用;
(3)掌握关键、适期施氮;
(4)深施肥料、保肥增效;
(5)有机肥与无机肥配合施用。
2.增产作用:有机肥料养分全,肥效慢;化肥肥分浓,见效快。
(1)特别是有机肥料中含有大量的有机质,经微生物作用,形成腐殖质,能改良土壤结构,使其疏松绵软,透气良好,这不仅有利于作物根系的生长发育,而且有助于提高土壤保水、保肥能力。
(2)化肥可以供给微生物活动需要的速效养分,加速微生物繁殖和活动,促进有机肥料分解,释放出大量的二氧化碳和有机酸,这就有利于土壤中难溶性养分的溶解。
因而有机肥料和化肥配合施用,能取长补短、互相调剂,充分发挥这两种肥料的作用。
8.3.8 无土栽培
- 学习情况
1.无土栽培指的是不用土壤,而是依据植物生活所需无机盐的种类和数量的多少,将无机盐按照一定的比例配成营养液,用营养液来培养植物。
2.由于根所吸收的水分和无机盐来自于土壤,而土壤颗粒只是对植物起着固定作用。所以植物可以采取无土栽培的方式即用营养液来培育植物。
3.无土栽培可以更合理的满足植物对各类无机盐的需要,具有产量高、不受季节限制、节约水肥、清洁无污染等优点。
8.4 植物的茎与物质运输
8.4.1 茎的基本结构和主要功能
双子叶植物木质茎的基本结构和主要功能。1.茎的分类
按形态分为:直立茎,攀缘茎,匍匐茎,缠绕茎;植物的茎具有背离地面向上生长的特性。
按组成成分:草质茎,木质茎。
2.木质茎的结构:树皮,木质部,髓。

(1)树皮:可分为最外层的表皮、韧皮部。
A表皮:细胞排列紧密、细胞间隙比较小,起保护作用。
B韧皮部:由筛管、韧皮纤维和薄壁细胞等组成。茎里的筛管与根和叶里的筛管相连通,属于输导组织,筛管的功能是运输有机物,韧皮纤维属于机械组织,最大的特点就是韧性强。C形成层:在韧皮部和木质部之间,细胞只有2—3层,能分裂产生新细胞,向外形成新的韧皮部,向内形成新的木质部,使得茎能逐渐增粗。(2)木质部:由导管和木纤维组成。A导管:运输水分和无机盐,属于输导组织。B木纤维:是又细又长的死细胞,细胞壁厚,没有弹性,有很强的支持力。(3)髓:位于茎的中央,由薄壁细胞构成,有贮存营养的功能。
8.4.2 导管的位置和对水分和无机盐的运输
植物体内主要有两条运输管道——导管和筛管1.导管是植物体内把根部吸收的水和无机盐由下而上输送到植株身体各处的管状结构。导管是为一串管状死细胞所组成,只有细胞壁的细胞构成的,而且上下两个细胞是贯通的;当根毛细胞从土壤中吸收的水分和无机盐通过一定方式进入根部的导管,然后植物就通过根、茎、叶中的导管把水分和无机盐运输到植物体的全身。

2.导管和筛管比较:

特别提醒:单子叶植物的维管束由韧皮部和本质部组成,无形成层,所以茎不能无限加粗;双子叶植物的维管束由韧皮部、形成层、木质部组成,木本双子叶植物的茎能不断加粗。
3.导管和筛管的功能辨析:
水分被植物体吸收,大致需要经历以下几个阶段:首先,水分从土壤溶液进入根部,通过根毛细胞进入成熟区内部的导管,然后水分进入茎部木质部里的导管,继续运输一直到叶片的木质部;接着,水分从叶脉木质部末端细胞进入气孔下腔附近的叶肉细胞,通过蒸腾作用散发出去,无机盐溶解于水中,随水进入植物体的各个器官中。筛管是另一种运输管道,它把叶片进行光合作用制造的有机物运输给(除叶以外)其他器官。
8.4.3 植物体内水分和无机盐的运输过程
植物吸收水的主要器官是根,根吸水的主要部位主要是根尖的成熟区,成熟区生有大量的根毛,扩大了根的吸收面积,可以吸收更多水分。水分在茎内的运输途径--导管,除茎外,根和叶内也有导管,它们是连接贯通的,根部吸收的水分,就是沿着导管运输到植株各处的,水中溶解的无机盐也就“搭着便车”运输了。
水分在植物体内的运输路径是:
土壤中的水分→根毛细胞→表皮内的层层细胞→根内的导管→茎内的导管→叶脉的导管→叶片的导管→叶肉细胞→气孔→大气(水蒸气)。
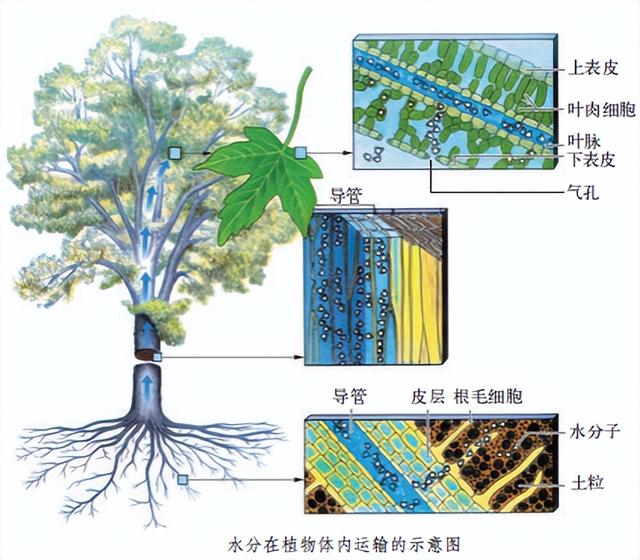
植物体内主要有两条运输管道——导管和筛管
1.筛管是植物体中由上而下输导有机物的管道,筛管是植物韧皮部内输导有机养料的管道,由许多管状活细胞上下连接而成,相邻两细胞的横壁上有许多小孔,称为“筛孔”,两细胞的原生质体通过筛孔彼此相通,筛管没有细胞核,但筛管是活细胞。

2.有机物的运输:
有机物是在叶中形成的,其中大部分的有机物由韧皮部中的筛管自上而下的运输到植物体的其他器官中。因此,将植物树皮环割,会破坏韧皮部中的筛管,使得叶产生的有机物无法向下运输,影响植物的生长,而有机物积累在环割切口的上端,并产生愈伤组织易形成“节瘤”,切割橡胶树皮采胶乳,实际上就是切割筛管,让有机物—胶乳流出来的过程。
3.导管和筛管比较:

特别提醒:单子叶植物的维管束由韧皮部和本质部组成,无形成层,所以茎不能无限加粗;双子叶植物的维管束由韧皮部、形成层、木质部组成,木本双子叶植物的茎能不断加粗。
4.导管和筛管的功能辨析:
水分被植物体吸收,大致需要经历以下几个阶段:首先,水分从土壤溶液进入根部,通过根毛细胞进入成熟区内部的导管,然后水分进入茎部木质部里的导管,继续运输一直到叶片的木质部;接着,水分从叶脉木质部末端细胞进入气孔下腔附近的叶肉细胞,通过蒸腾作用散发出去,无机盐溶解于水中,随水进入植物体的各个器官中。筛管是另一种运输管道,它把叶片进行光合作用制造的有机物运输给(除叶以外)其他器官。
8.4.5 茎进行的营养繁殖
营养繁殖是植物繁殖方式的一种,不通过有性途径,而是利用营养器官:根、茎、叶等繁殖后代。营养繁殖能够保持某些栽培物的优良性征,而且繁殖速度较快。主要有分根,压条,扦插,嫁接等。1.分根:用于夹竹桃,腊梅等灌木,它们的丛生茎下各自都有根,可以直接把它们分开,成为独立的植株。这种繁殖方式叫分根。2.压条:用于桑,夹竹桃等植物,可以选择树上较长的枝条,把它弯下来,压埋在土中的枝条部分长出根后,再把枝条与母体截断,长成新的植株。这种方式叫压条。3.扦插:用于月季,柳树,葡萄等植物,可以剪取植物上带芽的枝段,插入土中,不久这些枝段就会生根发芽,长成新的植株。扦插是指将枝条剪成小段,插入土中,不定根产生后,芽便可形成新的侧枝,于是新植株就产生了。有的植物很容易长根,扦插的成活率很高。有的植物不易长根,可以用植物激素等进行处理,促进生根。4.嫁接:用于橘,桃等果树,可以将它们的枝或芽接到另一种植物的茎或根上,使两者的形成层上(茎中具有分生能力的组织)紧贴,不久它们就会长成一体,成为一株新植物。这种繁殖方法叫嫁接。嫁接的原理是植物受伤后,具有愈伤的功能。两个伤面紧紧贴在一起,其形成层也非常贴近,由于细胞的增生彼此会愈合,于是接穗和砧木的维管组织便连成一个整体。利用嫁接技术,还可以改良品种。
8.5 植物的叶与蒸腾作用
8.5.1 叶片的基本结构及其主要功能
叶片的基本结构及其主要功能1.各组成部分的特性:(1)表皮:为叶片表面的一层初生保护组织,分为上、下表皮,表皮细胞扁平,排列紧密,外壁有一层角质层,保护叶片不受病菌侵害,防止水分散失,通常不含叶绿体;在表皮上分布有气孔,气孔由两个半月形的保卫细胞组成,可以张开或关闭,是植物蒸腾失水的“门户”,也是气体交换的“窗口”;保卫细胞控制气孔开闭。

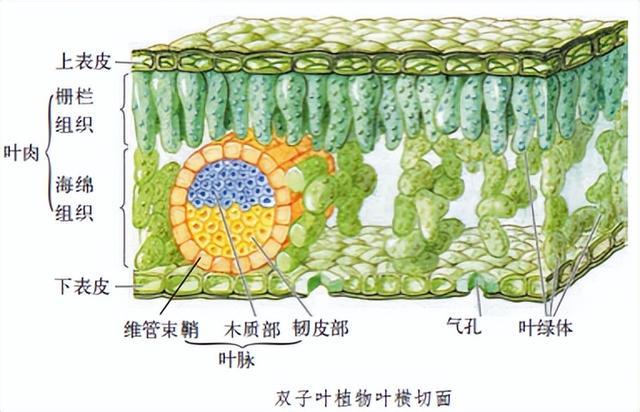
(2)叶肉:为表皮内的同化薄壁组织,通常有下列两种。栅栏组织:细胞通常1至数层,长圆柱状,垂直于表皮细胞,并紧密排列呈栅状,内含较多的叶绿体。海绵组织:细胞形状多不规则,内含较少的叶绿体,位于栅栏组织下方,层次不清,排列疏松,状如海绵。(3)叶脉:为贯穿于叶肉间的维管束。2.特别提醒:(1)叶片上面的绿色比下面的深,这是因为接近上表皮的栅栏组织比接近下表皮的海绵组织含叶绿体多。(2)栅栏组织比海绵组织细胞排列紧密,所以自然落下的树叶大都正面向下。(3)从气孔进出叶片的气体主要是水蒸气、二氧化碳、氧气。(4)一般陆生植物叶的下表皮上的气孔比上表皮多。(5)构成气孔的保卫细胞与表皮细胞的最大区别是:保卫细胞内含有叶绿体。
8.5.2 气孔的功能结构及开闭原理
气孔,叶、茎及其他植物器官上皮上许多小的开孔之一,高等陆地植物表皮所特有的结构。狭义上常把保卫细胞之间形成的凸透镜状的小孔称为气孔。有时也伴有与保卫细胞相邻的2-4个副卫细胞。把这些细胞包括在内是广义的气孔(或气孔器)。紧接气孔下面有宽的细胞间隙(气室)。气孔在碳同化、呼吸、蒸腾作用等气体代谢中,成为空气和水蒸汽的通路,其通过量是由保卫细胞的开闭作用来调节,在生理上具有重要的意义。气孔通常多存在于植物体的地上部分,尤其是在叶表皮上,在幼茎、花瓣上也可见到,但多数沉水植物则没有。
1.气孔的分布
不同植物的叶、同一植物不同的叶、同一片叶的不同部位(包括上、下表皮)都有差异,且受客观生存环境条件的影响。浮水植物只在上表皮分布,陆生植物叶片的上下表皮都可能有分布,一般阳生植物叶下表皮较多。2.气孔的类型
双子叶植物的气孔有四种类型:
(1)无规则型,保卫细胞周围无特殊形态分化的副卫细胞;
(2)不等型,保卫细胞周围有三个副卫细胞围绕;
(3)平行型,在保卫细胞的外侧面有几个副卫细胞与其长轴平行;
(4)横列型,一对副卫细胞共同与保卫细胞的长轴成直角。
围成气孔间隙的保卫细胞形态上也有差异,大多数植物的保卫细胞呈肾形,近气孔间隙的壁厚,背气孔间隙的壁薄;稻、麦等植物的保卫细胞呈哑铃形,中间部分的壁厚,两头的壁薄。
3.气孔的开闭机理当肾形保卫细胞吸水膨胀时,细胞向外弯曲,气孔张开,而保卫细胞失水体积缩小时,壁拉直,气孔关闭;哑铃形保卫细胞吸水时两头膨胀而中间彼此离开,气孔张开,失水时两头体积缩小中间部分合拢,气孔关闭。可见气孔运动的原因主要是保卫细胞吸水膨胀引起的。
当气孔张开时,叶片内的水分吸收热量变成水蒸气,经气孔扩散到外界空气中。因此,气孔是植物体蒸腾失水的“门户”,也是植物体与外界进行气体交换的“窗口”。气孔的开闭受叶内水分、光照强度、温度的影响。一般来说,光照强度越强,气孔就张开或扩大,蒸腾作用就越强。在晚上,没有光照,植物的气孔就闭合或是缩小,植物的蒸腾作用就弱。体内水分和无机盐的运输就越慢。 当土壤潮温时,植物吸水旺盛,保卫细胞吸水时,细胞膨胀,细胞厚度增加,两细胞分离,气孔张开;当土壤干燥时,植物吸水的功能大大下降,保卫细胞失水,细胞收缩,细胞厚度减小,两细胞并合,气孔闭合。

8.5.3 绿色植物的蒸腾作用
1.概念:是水分从活的植物体表面(主要是叶子)以水蒸气的形式散失到大气中的过程。2.部位:成熟植物的蒸腾部位主要在叶片。叶片蒸腾有两种方式:一是通过角质层的蒸腾,叫作角质蒸腾;二是通过气孔的蒸腾,叫作气孔蒸腾。气孔蒸腾是植物进行蒸腾作用最主要的方式。
3.过程:土壤中的水分→根毛→根部导管→茎→叶→气孔→大气。


4.意义:(1)对植物体自身的意义:①促进根对水分的吸收以及对水分、无机盐的运输;②降低植物体的温度,防止叶片被太阳灼伤。(2)对自然界的意义:①提高空气湿度;②降低空气温度;③增加降水量。5.影响蒸腾作用的环境条件:(1)光照强度:在一定限度内,光照强度越强,蒸腾作用越强。(2)温度:在一定限度内,蒸腾作用随温度的升高而加强。(3)空气湿度:空气湿度越大,蒸腾作用越弱;反之越强。(4)空气流动状况:空气流动越快,蒸腾作用越强。6.知识总结:蒸腾作用是植物的一种重要生理功能,它主要由叶片进行,气孔的张开、闭合控制着蒸腾作用,气孔的开闭又受环境的影响。蒸腾作用不仅对植物自身有重大意义;对调节气候、促进生物圈的水循环也有重大作用。
8.5.4 蒸腾作用的意义
蒸腾作用是水分从活的植物体内以水蒸气的状态散失到大气中的过程,植物的蒸腾作用散失的水分约占植物吸收水的99%。蒸腾作用为大气提供大量的水蒸气,增加空气湿度,降雨量增多,蒸腾作用散失水分,吸收热量,使气温降低,夏天也较凉爽,形成良性循环。蒸腾作用是根吸水的动力,促进了水和无机盐的运输,蒸腾作用还能降低温度。森林地区植物的蒸腾作用非常旺盛,为大气提供大量的水蒸气,增加空气湿度,降雨量增多。
1.对植物体自身的意义:促进根对水分的吸收以及对水分、无机盐的运输;降低植物体的温度,防止叶片被太阳灼伤。2.对自然界的意义:提高空气湿度;降低空气温度;增加降水量。
8.6 保护土壤
8.6.1 土壤污染与保护
土壤污染与保护土壤资源的最大威胁来自土壤的污染和过度开发。
1污染:废水和固体废物的任意排放,农药、化肥的大量使用,都有可能会导致土壤的化学污染,从而破坏土壤的结构和性质。另外,某些病菌、寄生虫和病毒也会对土壤造成生物污染。
(1)土壤污染物的种类:物理污染、化学污染、生物污染。(2)土壤污染主要表现在土壤结构和土壤生态系统受到破坏,从而失去其原有的土壤功能。【思考】会引起土壤污染的污染物还有核反应给土壤带来的辐射性污染、工业废气带来的化学污染、重金属的任意排放。(3)耕地被蚕食、水土流失、土地沙漠化和盐渍化,都是影响土壤资源的开发和利用。(4)水土流失是全球环境中存在的大问题。我国水土流失相当严重。沙漠化现象严重,主要在内蒙古、甘肃、宁夏、青海、新疆一带。我国盐渍化耕地约为10万平方千米。
窗体底端
,