《化学》是一门重在研究物质宏观组成和微观构成的学科,对于初学者而言如何正确区分"物质的宏观组成和微观构成"呢?尤其是物质的微观构成特别难以理解,这确实让很多学生头疼,他们无法正确区分元素和离子,以及如何标出元素的化合价和离子的电荷数。每年的化学中考试题中都会出现"要求标出化学式中某元素的化合价的题目和写离子符号的题目"。根据对以往全国各省化学中考试题中关于"元素化合价和离子符号"考点分析,学生失分较为严重,其原因主要是学生没有理解元素的化合价、离子的电荷数以及如何书写等知识。
一、理解"元素和元素的化合价"的关键在于把握其中的概念
1、熟练掌握原子的概念和原子的结构是重点。
根据化学微观理论知识,可知物质是由微观粒子构成的,构成物质的粒子主要有分子、原子和离子三种粒子。分子、原子和离子都是及其微小的粒子,例如一个水分子的质量约为3×10-26kg,一个氧原子的质量大约为2.657×10-26kg。虽然原子很小,但是原子不是一个实心球体,而是由更微小的粒子构成。

图1-1原子结构示意图
原子的组成:原子是一个球体结构,中心是原子核和核外电子构成;原子核带正电荷,核外电子带负电荷;原子核由质子和中子构成,质子带正电荷,中子不带电荷。

图1-2原子构成示意图
1个质子带一个单位正电荷;
1个电子带一个单位负电荷
中子不带电
原子核所带的电荷就是核内质子带的电荷,即原子核带的电荷数(核电荷数)就是质子数。因为原子是呈中性的,也就是说原子里质子和核外电子所带的电荷电性相反,电量相等,所以我们可以得出以下结论
核电荷数=核内质子数=核外电子数
2、进一步理解元素的概念是基础。
元素是核电荷数(即核内质子数)相同的一类原子的统称。元素是一个宏观概念,是原子的总称。比如所有的氧原子总称为氧元素;氢元素是所有氢原子的总称等,而不是某一个或几个原子的总称。有的元素有几种原子,比如碳元素就有3种碳原子:C12就是原子核内有6个质子和6个中子的碳原子;C13就是原子核内有6个质子和7个中子的碳原子;C4就是原子核内有6个质子和8个中子的碳原子;即碳元素有三种同位素,统称为碳元素;故元素是一类原子的总称,而不是指某一个原子。比如:核电荷数为1的所有氢原子总称为氢元素;核电荷数为6的所有的碳原子总称为碳元素。元素的种类的判断标准是核电荷数,即核内质子数。
核电荷数即核内质子数相同,同种元素
核电荷数即核内质子数不同,不同种元素
3、如何理解元素、原子的联系与区别是关键
元素和原子首先在概念描述方面不同,元素是指具有相同核电荷数(即核内质子数)的一类原子的总称;原子是化学变化中的最小粒子。
(1)元素是宏观概念,只有讲"种类",不讲"个数"。
元素是一种宏观概念,表示的是一类原子的总称。在描述元素时,只能用"某种"字样来描述元素;而不能说"几个"元素。比如水这种物质中有两种元素,即氧元素和氢元素。如果说水中有两个元素,那就不对了。
(2)元素,只有讲"组成",不讲"构成"。
描述物质的组成时,只能用元素,也就是说元素讲组成物质,不能用元素构成物质来描述。在化学中,宏观用组成、微观用构成。我们可以说水(H2O)是由氧元素和氢元素组成,不能说水(H2O)是由氧元素和氢元素构成。葡萄糖的化学式是C6H12O6,我们可以说葡萄糖是由碳、氢、氧三种元素组成。
(3)原子是微观概念,既讲"种类",又讲"个数"。
原子是一个微观概念,在描述原子的时候,可以用"种类"和"个数"两种词语表示。比如葡萄糖的化学式是C6H12O6,可以说葡萄糖分子中有C、H、O三种原子,一个葡萄糖分子中有6个碳原子、12个氢原子和6个氧原子;二氧化碳(CO2)分子是由C和O两种原子构成,一个二氧化碳分子是由1个碳原子和2个氧原子构成。
(3)原子只有讲"构成",不讲"组成"。
在描述原子与物质的关系时,可以用"构成",但是不能够说"组成"。可以这样描述:某物质由某种原子直接构成;某分子由某原子构成。比如某有机物的化学式是C9H18N2S,可以说该物质分子中有C、H、N、S四种原子,一个这种物质的分子中是由9个碳原子、18个氢原子、2个氮原子和1个硫原子构成;五氧化二氮(N2O5)分子中是由N和O两种原子构成,一个五氧化二氮分子是由2个氮原子和5个氧原子构成。
二、如何学好"离子",重点在于理解离子与原子的联系和区别
离子也是构成物质的其中一种粒子,碱和盐类化合物大部分是由离子构成,比如我们经常食用的食盐(氯化钠)就是由钠离子和氯离子直接构成。
1、如何正确把握离子的概念
离子与分子、原子一样是构成物质的一种粒子,离子也特别小,是我们肉眼无法看见的微小粒子。虽然离子很小,也是有大小和质量的,也在不停地做无规则运动。那么离子到底是什么呢?
离子:是原子或原子团得失电子后形成的粒子。比如溴原子的核外有35个电子,最外层上有7个电子;在发生化学反应的时候,溴原子就容易从别的原子那里得到一个电子变成了溴离子。还有氯化钠的形成过程就是原子得失电子变成阴阳离子,通过静电作用结合在一起的。

图1-3离子的形成过程
上图是氯化钠的形成过程,是由离子构成的物质。
2、熟悉离子的种类
常见的离子有两种:阳离子和阴离子,由离子直接构成的物质中都存在阳、阴两种离子,而且它们所带的正负电荷数量相等,从而物质显电中性。
阳离子:带正电荷的原子(或原子团),例如
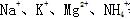
图1-4常见的阳离子
阴离子:带负电荷的原子(或原子团)例如
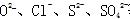
图1-5常见的阴离子
3、掌握离子与原子的联系和区别
离子的形成是与原子有着密切的关系,原子或原子团在得失电子后形成相应的离子。这是什么意思呢?例如一个钾原子在化学反应过程失去一个电子,则形成钾离子;而不会变成其它的离子,也就是说原子形成离子仅仅是最外层电子数目发生了改变,原子核的结构和粒子均未发生改变,所以原子与离子有着很多内在的联系和区别。
原子:核电荷数=核内质子数=核外电子数。
对于原子而言,因为其呈电中性,所以质子数和核外电子数是相等的。
阳离子:核电荷数=核内质子数>核外电子数。
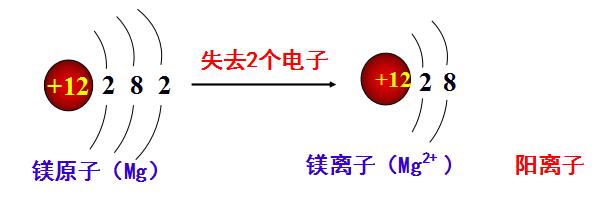
图1-6阳离子的形成过程
阳离子的形成过程是失去了最外层上的电子,其原子核没有发生改变,即原子核内的质子和中子都不变,仅仅是该原子最外层上的电子失去了,所以变化后的原子内质子数和电子数就不相等,电子数减少了,则导致其呈电正性,所以质子数大于核外电子数。
阴离子:核电荷数=核内质子数<核外电子数。

图1-7阴离子的形成过程
阴离子的形成过程是得到了电子,导致最外层上的电子增加,其原子核没有发生改变,即原子核内的质子和中子都不变,仅仅是该原子最外层上的电子数多了,所以变化后的原子里质子数和电子数就不相等,电子数变多了,则导致其呈电负性,所以质子数小于核外电子数。
三、如何正确标出元素的化合价和离子的电荷数
1、元素的化合价的正确写法
元素的化合价是元素在形成化合物的时候表现出来的一种性质,所以只有化合物中的元素才有化合价,单质中的元素化合价是0。元素的化合价受哪些因素的影响呢?元素化合价取决于该元素原子的最外层电子数。元素化合价的书写方法一定要掌握,这是中考必考的知识点。
(1)书写:写在元素符号的正上方,如果元素显正价,则在元素符号正上方写" "号,再" "后面加上相应价态的数字;如果元素显负价,则在元素符号正上方写"-"号,再"-"后面加上相应价态的数字。
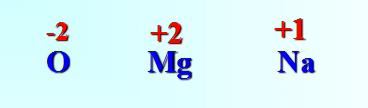
图1-8元素化合价的正确标法
书写元素化合价时注意事项:
①表示化合价的正负号在前面,数字在后面。
② 正负化合价为1时,1不能够省略。
③ 化合价的数值=该原子得失的电子数目
2、离子电荷数的正确写法
(2)书写:写在元素符号的右上方,如果离子带正电荷,则在元素符号右上方写" "号,再" "前面加上相应电荷的数字;如果离子带负电荷,则在元素符号右上方写"- "号,再"-"前面加上相应电荷的数字;

图1-9离子符号的正确书写
注意事项:
①表示化合价的数字在前面,正负号在后面。
② 离子所带电荷数为1时,1省略不写。
③ 离子所带的电荷数的数值=该原子得失的电子数目
最后,我们必须清楚元素是一个宏观方面的概念,表示的是物质的组成,只能江"种类和组成",不能够讲"个数和构成",离子是微观方面的概念,表示物质的构成。但是一定要记住:某元素的化合价与相应离子的电荷,一般情况下数值是相等的,它们的正负相同,但是书写的位置不同,正负号与数字前后相反。
,




