软骨是一种致密的结缔组织,成年人的软骨主要分布与关节之间、耳廓、肋软骨以及椎间盘等处。按照纤维组成成分的不同,软骨可以分为透明软骨、纤维软骨和弹性软骨三种类型[1]。
一、什么是关节软骨?关节软骨是透明软骨的一种,其框架是由较为致密的结缔组织构成。它的表面光滑,胶原纤维较多,具有缓冲应力、吸收震荡、降低摩擦、润滑关节的作用。由于其自身特殊的生理结构,软骨内既没有神经也没有血管通过,其营养来源主要来自于关节囊滑膜层以及关节滑液。

关节软骨缺乏血供以及受伤后未分化的细胞难以迁移到受伤部位,所以其自身修复的能力较差[1]。按照损伤程度的不同,关节软骨损伤可分为以下三级:①直径为1.0-2.0mm的软骨损伤,其修复的组织与正常的透明软骨组织相似;②直径大于3mm的软骨损伤(关节软骨缺损articular cartilage defects,ACD),修复的组织主要为纤维软骨,但大多不能完全修复;③直径大于6mm的ACD,该种缺损往往不能通过自身进行修复,同时还会引起周围骨壁和关节软骨的损伤,继而引起周围软骨下骨的塌陷,最终不可避免的引发骨性关节炎[2]。

目前软骨损伤修复包括保守治疗及手术治疗,保守治疗主要是通过使用药物来缓解炎症和疼痛,主要使用的药物有选择性2型环氧酶抑制剂[3]、非甾体抗炎药以及关节腔内注射皮质类固醇[4]。
四、关节软骨手术治疗技术迭代
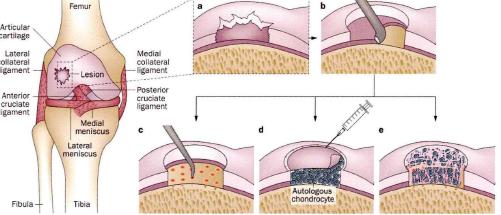
图中a为软骨缺损,b为清理软骨缺损周围坏死组织,c为微骨折术,d为自体软骨细胞移植,e为基质诱导自体软骨细胞移植。
1.第一代修复技术
第一代修复技术主要利用自体细胞,包括1980年提出的微骨折技术(microfracture,MF)、1992年提出的马赛克移植技术(mosaicplasty)和1994年提出的自体软骨细胞移植 (autologous chondrocyte implantation, ACI)。MF技术是对软骨下骨进行破坏,促进来源于骨髓的多能基质细胞向软骨缺损区域募集,从而对损伤部位进行修复[5]。但是微骨折术后修复区域的软骨主要为纤维软骨,力学性能不如透明软骨,因此MF技术的局限性是仅能对缺损较小的软骨损伤进行修复,对于面积较大的软骨缺损修复效果并不理想[6]。马赛克技术是将低负重区域的软骨移植到软骨缺损处,它主要适用于面积较小(小于2cm2)的全层软骨缺损病例[7],虽然移植后所形成的软骨大约有80%的组织为透明软骨[8],但该项技术受限于年龄、性别和病变大小[9],手术损伤了其他部位的软骨组织,会造成供区出现骨性关节炎[10]。且有学者[11]认为虽然自体软骨生物相容性较好,但是软组织从低负重区到高负重区后其应力情况发生改变,这将会影响术后软骨的修复。

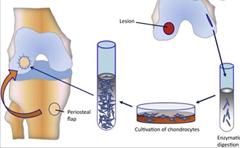
自体软骨细胞移植技术也是取低负重区域软骨细胞,之后通过对其在体外培养扩增,再通过关节镜手术将扩增后的软骨细胞移植到骨缺损处,并通过骨膜覆盖[9]。ACI的优点在于使用少量自体软骨,造成的关节软骨损伤较小且患者感染、排异的风险较低。但是由于组织培养时间较长(6-12个月)、操作过程繁琐且要对患者进行两次关节镜手术。
2.第二代修复技术
第二代修复技术对第一代技术进行了改进,在自体细胞的基础上增加了细胞外基质,将含有自体软骨细胞的特殊三维支架移植到软骨缺损区域中,并且认为这种特殊的生物支架能够为提供润滑作用,有利于软骨细胞的渗透[12]。第二代技术的弊端在于它同样也需要进行两次关节镜手术,仍对患者取软骨区域造成创伤、操作过程繁琐,并且有研究证明运用此技术修复移植的软骨细胞有肥大的可能性[13].
3.第三代修复技术
第三代技术总结了前两代技术的不足,致力于在体内或体外构建与正常关节软骨结构和功能相类似的关节软骨,实现关节软骨的无创修复[14]。第三代修复技术运用了组织工程的方法,包括NT/ET,CAIS,3D生物打印技术等,开始采用异体细胞移植、传导基质材料及预先体外培养组织提高材料生物力学以便利于移植[15]。但是第三代技术存在一定的排异性和疗效的不确定性,并且价格昂贵。
4.第四代修复技术
前三代修复技术对于损伤在4mm以上软骨缺损效果一般。目前第四代软骨修复组织工程技术仍在积极研发中,并未得到广泛的应用。第四代技术主要包括组织3D打印、基因治疗、干细胞疗法等[16]
5.PRP技术
富血小板血浆(PRP)是通过抽取自体血液,经过浓缩分离后得到含有约正常血液4-5倍血小板含量的血浆。由于血小板再激活后可以释放出大量的、高浓度的生长因子,因此PRP对于自身组织的修复具有积极的作用,再加上这些生长因子来源于自身,不会出现排异反应,获取途径简单,对人体伤害较小,在临床中具有很高的应用价值。

PRP第一次应用于临床骨缺损的修复是在1988年,Marx将骨移植与PRP联合应用在下颌骨缺损修复中[17]。Haleem[18]将PRP与骨髓基质干细胞混合来治疗股骨关节软骨损伤,经过一年的随访,患者膝关节功能均比治疗前有了显著的提高。国外一些优秀运动员如科比、霍华德等人也曾接受过PRP治疗。PRP的成分相对复杂,目前PRP技术修复软骨的机制尚不明确,不同方法获取的PRP也存在较大差异,不同的使用方法、形式及浓度的治疗效果存在较大的差异,现阶段对于PRP的研究仍在不断探索中。
最后总结
关节软骨损伤的发生在临床上十分常见,对其放任不管后期将会发展为严重的骨性关节炎。人们对关节软骨修复的探索从未停止,近年来随着科学技术的发展,软骨修复技术方面也有了诸多发现。相信随着生物、医学领域的不断发展,未来能够催生成熟的技术,为软骨损伤患者及骨性关节炎患者带来福音。
参考文献
[1]胥少汀,葛宝丰,徐印坎,等.实用骨科学[M.人民军医出版社,2015.10(4):1676-1678.
[2]Tatman P D , Osbun J , Kaur S , et al. Clinical Outcomes Assessment for Articular Cartilage Restoration[J]. The Journal of Knee Surgery, 2013, 26(01):031-040.
[3]Grol, Matthew W, Lee, Brendan H. Gene therapy for repair and regeneration of bone and cartilage[J]. Current Opinion in Pharmacology, 40:59-66.
[4]Bellavia, Daniele, Veronesi, F, Carina, V,等. Gene therapy for chondral and osteochondral regeneration: is the future now?[J]. Cellular & Molecular Life Sciences Cmls.
[5]Steadman, J. Richard, Rodkey, William G, Rodrigo, Juan J. Microfracture: Surgical Technique and Rehabilitation to Treat Chondral Defects[J]. Clin Orthop Relat Res, 391:S362-S369.
[6]Bae D K , Yoon K H , Song S J . Cartilage Healing After Microfracture in Osteoarthritic Knees[J]. Arthroscopy, 2006, 22(4):367-374.
[7]孙祥燚, 张聘, 赵建宁, et al. 关节软骨缺损的临床治疗及研究进展[J]. 转化医学电子杂志, 2018, 5(6).
[8] Di Benedetto P , Citak M , Kendoff D , et al. Arthroscopic Mosaicplasty for Osteochondral Lesions of the Knee: Computer-Assisted Navigation Versus Freehand Technique[J]. Arthroscopy: The Journal of Arthroscopic & Related Surgery, 2012, 28(9):1290-1296.
[9] Nakagawa, Y, Mukai, S, Yabumoto, H,等. Serial Changes of the Cartilage in Recipient Sites and Their Mirror Sites on Second-Look Imaging After Mosaicplasty[J]. American Journal of Sports Medicine, 44(5):1243-1248.
[10] Hangody L , Dobos J , Balo E , et al. Clinical Experiences With Autologous Osteochondral Mosaicplasty in an Athletic Population: A 17-Year Prospective Multicenter Study[J]. The American Journal of Sports Medicine, 2010, 38(6):1125-1133.
[11] Hunziker E B . Articular cartilage repair: basic science and clinical progress. A review of the current status and prospects[J]. Osteoarthritis & Cartilage, 2002, 10(6):432-463.
[12] Brittberg M , Recker D , Ilgenfritz J , et al. Matrix-Applied Characterized Autologous Cultured Chondrocytes Versus Microfracture: Five-Year Follow-up of a Prospective Randomized Trial[J]. The American Journal of Sports Medicine, 2018:036354651875697.
[13]Bartlett, W. Autologous chondrocyte implantation versus matrix-induced autologous chondrocyte implantation for osteochondral defects of the knee: A PROSPECTIVE, RANDOMISED STUDY[J]. Journal of Bone and Joint Surgery - British Volume, 87-B(5):640-645.
[14] Wakitani S , Kawaguchi A , Tokuhara Y , et al. Present status of and future direction for articular cartilage repair[J]. Journal of Bone & Mineral Metabolism, 2008, 26(2):115-122.
[15] Kessler M W , Ackerman G , Dines J S , et al. Emerging Technologies and Fourth Generation Issues in Cartilage Repair[J]. Sports Medicine and Arthroscopy Review, 2008, 16(4):246-254.
[16] 史冬泉,李嘉威.软骨修复临床转化的挑战与机遇[J].医学研究生学报,2019,32(09):897-903.
[17] 伊芸, 王超有. 富血小板血浆(prp)促进骨及关节软骨修复的研究进展[J]. 临床医药文献电子杂志, 2019.
[18]Haleem AM,Singergy AA,Sabry D,et al.The clinical use of human culture expanded autologous bone narrow mesenchymal stem cells transplanted,platelet rich fibrin glue in the treatment of articular cartilage defects;a pilot study and preliminary results[J].Cartilage,2010,1(4):253-261.
,




