
一、酸及酸的化学性质
酸在水溶液中能解离出氢离子(H )和酸根离子。常见的酸有①盐酸(HCl)②硫酸(H2SO4) ③硝酸(HNO3)④醋酸(CH3COOH)
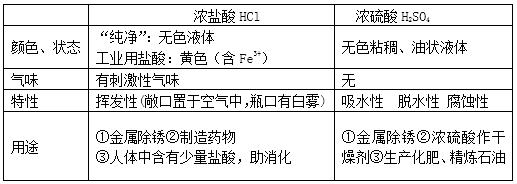
1.浓盐酸、浓硫酸的特性、用途
2.酸的化学性质
①紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色。
②活泼金属 酸→盐 氢气(注:此处酸不包括浓硫酸和硝酸)
Zn H2SO4=ZnSO4 H2↑ Zn 2HCl=ZnCl2 H2↑
Fe H2SO4=FeSO4 H2↑ Fe 2HCl=FeCl2 H2↑
2Al 3H2SO4=Al2(SO4)3 3H2↑
2Al 6HCl=2AlCl3 3H2↑
③金属氧化物 酸→盐 水
Fe2O3 6HCl=2FeCl3 3H2O
Fe2O3 3H2SO4=Fe2(SO4)3 3H2O
CuO H2SO4=CuSO4 H2O
CuO 2HCl=CuCl2 H2O
④碱 酸→盐 水
NaOH HCl=NaCl H2O
Ca(OH)2 H2SO4=CaSO4 2H2O
3HCl Al(OH)3 = AlCl3 3H2O
⑤*盐 酸→新盐 新酸
AgNO3 HCl=AgCl↓ HNO3
BaCl2 H2SO4=BaSO4↓ 2HCl
二、碱及碱的化学性质
碱由离子构成,碱在水溶液中能解离出金属离子和氢氧根离子(OH-)。
常见的碱有氢氧化钠(NaOH) 、氢氧化钙 Ca(OH)2、氨水(NH3·H2O)等。
1.氢氧化钠、氢氧化钙的物理性质、用途

2.碱的化学性质
紫色石蕊试液遇碱溶液变蓝,无色酚酞试液遇碱溶液变红。
①酸性氧化物 碱→盐 水
2NaOH CO2=Na2CO3 H2O
*2NaOH SiO2=Na2SiO3 H2O
Ca(OH)2 CO2=CaCO3↓ H2O
②酸 碱→盐 水(中和反应)
NaOH HCl=NaCl H2O
Ca(OH)2 H2SO4=CaSO4 2H2O
③*盐 碱→新盐 新碱(反应物均可溶)
2NaOH CuSO4=Na2SO4 Cu(OH)2↓
三、盐的性质
1.常见的盐
盐由离子构成,组成里含有金属离子(或NH4 )和酸根离子的一类化合物。

2.粗盐提纯
去除粗盐中不溶性杂质。
3.盐的化学性质
①盐溶液 金属→新盐 新金属(按金属活动性顺序)
CuSO4 Zn=ZnSO4 Cu
盐 酸→新盐 新酸 【视频】
CaCO3 2HCl=CaCl2 H2O CO2↑
Na2CO3 2HCl=2NaCl H2O CO2↑
NaHCO3 HCl=NaCl H2O CO2↑
BaCl2 H2SO4=BaSO4↓ 2HCl
盐溶液 碱溶液→新盐 新碱(必有一个是沉淀)
Ca(OH)2 Na2CO3==CaCO3↓ 2NaOH(明星反应)
3NaOH FeCl3=3NaCl Fe(OH)3↓
盐溶液 盐溶液→新盐 新盐(必有一个是沉淀)
CaCl2 Na2CO3=CaCO3↓ 2NaCl
AgNO3 NaCl=AgCl↓ NaNO3
四、明确复分解反应发生的本质
复分解反应:由两种化合物(通常为酸碱盐)相互交换成分,生成另外两种化合物的反应。
通式:AB CD=AD CB
发生的条件:生成物中如果有↑、↓或有H2O(稳定、难溶、难电离物质)
注意:碱与氧化物的反应不属于复分解反应
五、熟记酸、碱、盐的溶解性口诀
碱溶氨、钠、钾、钡、钙(俺拿假被盖)
钾钠铵(铵盐)硝(硝酸盐)全都溶。
硫酸盐不溶钡和铅;氯化物不溶银亚汞,碳酸盐只溶钾钠铵。
六、几个常见离子的检验
1.Cl-离子的检验 (选)
取少量样品于试管中,滴加AgNO3溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,样品含有Cl-, AgNO3 KCl=AgCl↓ KNO3
2.SO42-离子的检验 (选)
取少量样品于试管中,滴加Ba(NO3)2溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,样品含有SO42-, Ba(NO3)2 H2SO4=BaSO4↓ 2HNO3
3. CO32-离子的检验
取少量样品于试管中,滴加稀HCl,将生成的气体通入澄清石灰水有无色气体生成,该气体使澄清石灰水变浑浊,样品含有CO32-,
K2CO3 2HCl=2KCl CO2↑ H2O
CO2 Ca(OH)2=CaCO3↓ H2O
4.检验NH4 (选)
取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生。
5、鉴别稀盐酸和稀硫酸
分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸。
七、常见俗称、成分和化学式
生石灰——CaO
熟石灰——Ca(OH)2
石灰石、大理石——CaCO3
食盐——NaCl
火碱、烧碱、苛性钠——NaOH
纯碱、苏打——Na2CO3
小苏打——NaHCO3
铁锈、赤铁矿——Fe2O3
磁铁矿——Fe3O4
金刚石、石墨——C
干冰——CO2
冰——H2O
天然气(甲烷)——CH4
酒精(乙醇)——C2H5OH
*醋酸(乙酸)——CH3COOH
八、常见物质的颜色
红色的固体——Cu、Fe2O3、P(红磷)
黑色的固体——C、CuO、Fe3O4、FeO、MnO2
白色的固体——KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等
暗紫色的固体——KMnO4
淡黄色的固体——S
*蓝色晶体——CuSO4•5H2O
*蓝色沉淀——Cu(OH)2
*红褐色沉淀——Fe(OH)3
*白色沉淀(不溶于酸)——BaSO4、AgCl
白色沉淀(碳酸盐)——CaCO3、BaCO3
*白色沉淀(碱)——Mg(OH)2、Al(OH)3
蓝色溶液——CuSO4、Cu(NO3)2等含Cu2+溶液
浅绿色溶液——FeSO4、FeCl2等含Fe2+溶液
棕黄色溶液——FeCl3、Fe2(SO4)3等含Fe3+溶液
,




