
【原创】ICH M4框架整理——思维导图
ICH(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)为国际人用药品注册技术协调会,自1990年成立以来,为应对制药行业全球化的快速发展,ICH指南逐渐发展与完善,被越来越多的监管机构采用。其中,注册资料撰写的相关的指导原则为ICH M4。
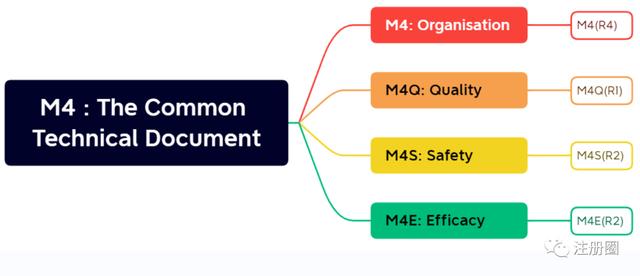
M4为CTD(The Common Technical Document),即通用技术文件,由4部分文件组成:M4(R4),M4Q(R1),M4S(R2)和M4E(R2)。
CTD很大程度上改变了监管审查流程,促进了电子提交方式(即eCTD)的发展,有助于GRP(good review practices)的实施。对于行业而言,可满足申请机构同时提交给不同ICH监管机构的需求,消除了不同地区申报资料格式的不统一,加速申报进度。CTD分为五个模块。模块 1 各个国家/地区都有特定要求,模块 2、3、4 和 5 通用于不同国家/地区。2003年7月,欧盟和日本新药申请时要求格式为CTD,申报美国时FDA也强烈建议选择CTD格式。
M4(R4)包含粒度文件,提供文件位置及分页指导。适用于新药(含生物制品)的注册申请。M4(R4)适用于新药(包括生物技术产品)注册申请过程中需要提交资料的组织架构信息。模块 1 为行政管理信息(Administrative Information and Prescribing Information),不同地方要求不同,此处展示了FDA要求的内容。模块 2 包含 CTD总结(CTD Summaries),应首先对药物进行一般性介绍,包括其药物分类、作用方式和拟定的临床用途。模块 2 还包括质量综述(Quality Overall Summary)、非临床综述(Nonclinical Overview)和临床综述(Clinical Overview),以及非临床文字总结和列表总结(Nonclinical Written and Tabulated Summaries),以及临床总结(Clinical Summary)。模块 3 为质量(Quality),模块 4 包含非临床研究报告(Nonclinical Study Reports),模块 5 包含临床研究报告(Clinical Study Reports)。这些总结的组织格式在M4Q、M4S和M4E指导原则中有详述。



M4Q(R1)为质量,包括2部分内容:模块2的2.3质量综述(QOS)和模块3质量,提供了 CMC (Chemistry, Manufacturing and Controls)部分资料撰写要求,主要涉及原料药和制剂。



M4S(R2)为安全性,包括2部分内容:模块2的2.4非临床综述和2.6非临床总结,及模块4(非临床研究报告)的组织结构。非临床综述是对药物药理学、药代动力学、毒理学研究的综合并且重要的评价,通常不超过 30 页。药理学、药代动力学、和毒理学三部分非临床文字总结的长度一般不超过 100~150页。它的3个附件ABC为非临床列表总结提供了34个模板和31个示例。



M4E(R2)为有效性,包括2部分内容:模块2的2.5临床综述和2.7临床总结,及模块5临床研究报告。M4E说明了申报资料中临床数据的结构和格式,包括总结和详细的研究报告。模块2的临床综述提供简短的临床数据关键评估;临床总结提供相对长的数据总结和整合。模块5包含临床研究报告和原始数据(如适用)。


参考法规:
1.M4: The Common Technical Document, https://www.ich.org/page/ctd
2.FDA The Comprehensive Table of Contents Headings and Hierarchy,
https://www.fda.gov/media/76444/download
因文件信息量较多,清晰版PDF导图原文件,可后台私信领取。
此文为原创文章,对以上观点,有任何不妥之处,欢迎大家积极斧正,评论留言交流。
更多其他资讯与服务请关注:注册圈。
注册圈,让注册人不再孤单!齐聚各层制药人,加入交流圈一起分享行业知识吧~
,




