原创:何琪医生
审核:广州中医药大学第一附属医院 王海彬教授
文章所属:王海彬教授团队,转发请标明出处。
一、基本原理
PCR是以拟扩增的DNA分子为模板,以一对分别与模板相互补的寡核苷酸片段为引物,在DNA聚合酶作用下,按照半保留复制的机制沿着模板链延伸直至完成新的DNA的合成,不断重复可以扩增目的DNA片段,由于新合成的DNA也可作为模板,因此合成量呈指数增长。
而实时荧光定量PCR技术,则是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。

图片来源于网络
实验步骤:
一、样品RNA的抽提
离心机提前4°预冷
1. 细胞裂解或组织匀浆。a. 贴壁细胞 吸走培养基,6孔板每孔1ml Trizol,12孔板0.5ml b. 悬浮细胞 离心收集细胞,吸尽液体,每五百万至一千万动植物或酵母细胞,或一千万细菌,加入1ml Trizol。用枪吹打或适当vortex,确保全部裂解。某些酵母和细菌如裂解不充分,可用匀浆器匀浆,确保全部裂解。c. 组织 组织剪成小块研磨。每50mg-80mg组织加入1ml Trizol,裂解20min,对于RNA完整性要求比较高的情况,应用液氮保存组织。2. 吹打,室温裂解5min。3. 每毫升Trizol加入200ul氯仿,vortex混匀或剧烈上下震荡15-30s,室温静置3min4. 12000g 4℃离心15min,吸取含总RNA的上层无色水相至一新的离心管中,大约350ul(每毫升Trizol约可吸取0.5-0.55ml)。5. 按每毫升最初的Trizol加入500ul异丙醇,吹打混匀,室温静置10min。6. 12000g 4℃离心10min,弃上清,(用枪把EP管口出废液吸走),在管底可见RNA沉淀。7. 每毫升最初的Trizol加入1ml 75%无水乙醇(用DEPC水稀释),不用吹打。8. 7500g 4℃离心5min,弃上清,用200ul枪头吸走管口及盖子液体,用泵头套白色小枪头吸走EP管残余水珠,每个样本需更换枪头)倒扣在卫生纸上静置5min。[或用离心机甩一下(>5,000rpm, 离心1秒),小心吸尽液体]
图片来源于网络
二、RNA质量检测
1. 紫外吸收法测定
先用稀释用的TE溶液将分光光度计调零。然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA溶液 浓度和纯度。
(1)纯度检测:RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。
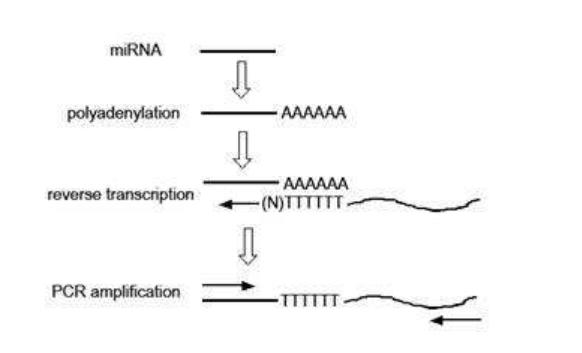
三、样品cDNA合成
1. 反应体系:一般根据所购买试剂盒操作步骤执行
2. 混合液在加入逆转录酶之前先70℃干浴3分钟,取出后立即冰水浴至管内外温度一致,然后加逆转录酶0.5 μl,37℃水浴60分钟。
3. 取出后立即95℃干浴3分钟,得到逆转录终溶液即为cDNA溶液,保存于-80℃待用。
四、梯度稀释的标准品及待测样品的管家基因(β-actin)实时定量PCR
1. 反应体系如下:参照所使用的试剂盒。
2. 制备好的阳性标准品和检测样本同时上机,反应条件为:93℃ 2分钟,然后93℃ 1分钟,55℃ 2分钟,共40个循环。

图片来源于网络
,




