有关化学方程式的知识点,是课堂中老师讲课内容的重中之重,也是课外我们巩固复习必不可少的,今天主要给大家分析化学方程式的四个重要考点,学明白了这些化学方程式知识要点梳理,化学考试中自然容易拿高分。

化学方程式难吗
考点1质量守恒定律
⒈质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
⒉质量守恒定律的分析归纳
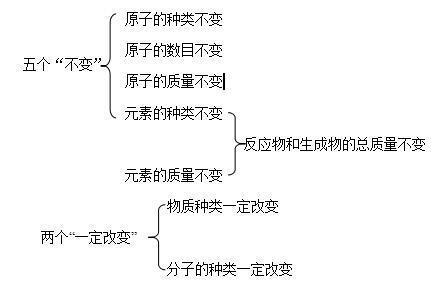
一个“可能改变”——分子总数可能改变
⒊词的理解
(1)在反应中,所给予物质不一定都参加反应,若反应物有剩余,剩余的物质没有参加反应,所以必须强调“参加化学反应”,而且质量守恒定律只能用于解释化学变化。
(2)质量总和是参加化学反应的物质的质量总和与反应后生成的物质的质量总和。如:镁在氧气中燃烧生成氧化镁,参加反应的镁的质量和参加反应的氧气的质量之和等于反应后生成的氧化镁的质量。
⒋探究质量守恒定律的几个重要实验
(1)白磷燃烧前后质量的测定(P88)。(2)铁钉跟硫酸铜溶液反应前后质量的测定(P89)。
(3)蜡烛燃烧前后质量的测定(P90)。(4)镁条燃烧(P91)。
⒌质量守恒定律的应用
(1)根据质量守恒定律进行简单的计算。
(2)运用质量守恒定律解释化学反应中的一些简单的现象和问题。
(3)判断化学反应中某种物质的组成。
(4)确定化学反应中某种物质的化学式。
考点2化学方程式
⒈化学方程式的定义
用化学式表示化学反应的式子。
⒉化学方程式提供的信息(意义)
(1)哪些物质参加了反应(反应物是什么);(2)生成了哪些物质(生成物是什么);
(3)反应条件;(4)反应物与生成物之间的质量比;
(5)反应物与生成物之间的粒子数量比。
⒊化学方程式的读法(以C O2CO2为例)
(1)质:碳和氧气在点燃的条件下反应生成二氧化碳;
(2)量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳;
(3)粒子:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子。
考点3化学方程式的书写
⒈书写原则
(1)以客观事实为基础;(2)要遵守质量守恒定律。
⒉书写步骤
(1)写:根据事实写出反应物和生成物的化学式,中间用短横线相连;
(2)配:配平化学方程式;
(3)等;将短横线改为等号;
(4)标:标明反应条件以及生成物的状态“↑”或“↓”;
(5)查:检查化学式是否正确、化学方程式是否配平、条件和生成物状态是否标注恰当。
考点4根据化学方程式进行计算
⒈解题步骤及格式一般分为以下六步
(1)解设未知量,一般情况下,求什么设什么;
(2)写出相应的正确的化学方程式;
(3)根据化学方程式找出相关物质的相对分子质量,列在相应的化学式下面;
(4)标出已知量和未知量;
(5)列比例式求解;
(6)答题。
⒉计算中常用的关系式
(1)m=ρ·V
(2)单位换算:1L=1000mL,1mL=1cm3。
(3)物质的纯度=纯物质的质量/不纯物质的总质量×100%
变形:纯物质的质量=不纯物质的总质量×物质的纯度
不纯物质的总质量=纯物质的质量÷物质的纯度
(4)物质的纯度(纯物质的质量分数)=1-杂质的质量分数
,




