在化学研究中,化合物的结构解析往往扮演着重要作用,尤其是在天然有机化学领域。不过,结构解析错误难以避免,时有发生结构错误常常被从事有机化学合成的小伙伴所诟病,因为花费大量的时间和精力却合成不出来已报道的化合物。不过,最近美国丹佛大学的Andrei G. Kutateladze教授等人发现,结构解析错误“这口锅”并不专属于天然有机化学,有机化学合成的小伙伴们也有得背。这到底是怎么回事呢?原来,他们发现文献中有相当部分产物、中间产物或起始物的结构都是错误的,更严重的是,这还意味着相关反应的机理也不靠谱。
近日,Kutateladze教授团队开发出一种结构解析“利器”——DU8ML,这是一种基于机器学习增强(Machine learning-augmented)密度泛函理论(DFT)的计算核磁技术。这项技术通过计算化合物结构片段的核磁自旋耦合常数和化学位移,并根据计算值和实验值的差异来进行解析。具体而言,他们先是利用DU8ML快速、准确地修正了许多天然产物结构,再“转战”有机合成领域,结果发现文献中结构解析及反应机理有问题的不在少数(图1)。相关成果发表在J. Org. Chem.上。

图1. Andrei G. Kutateladze团队在本文中修正的化学结构。图片来源:J. Org. Chem.
首先,他们研究了最近报道的一例水介导α-羰基硫叶立德的分子内环化/氧化反应,该反应的产物是一系列Corey−Chaykovsky类杂环。然而,原文中的产物结构和反应机理都显得不同寻常。因此,他们选择产物2进行DU8ML分析验证,结果显示产物2的13C NMR化学位移的计算值和实验值有显著差异,而产物7的计算值和实验值更吻合。结合文献调研,他们将产物2的结构修正为化合物7,这一修正的连锁效应导致原文报道的Corey−Chaykovsky反应机理也值得商榷(图2)。

图2. Corey−Chaykovsky类杂环的形成和DU8ML结构修正。图片来源:J. Org. Chem.
如图3所示,他们还研究了另一个不同寻常的光催化脱羟基胺化反应,该反应由铁酞菁催化的对苯二酚和4-哌啶酮扩环生成八元环苯并内酰胺产物11。然而,DU8ML计算显示产物11的13C NMR化学位移的计算值和实验值相差甚远,这表明结构解析有误,搜索修正后得到螺环吡咯烷13,后者的实验值和计算值匹配度最高。随后,他们综合文献调研和化学知识,推测整个反应机理涉及分子间Friedel−Crafts反应和pinacol−pinacolone重排。
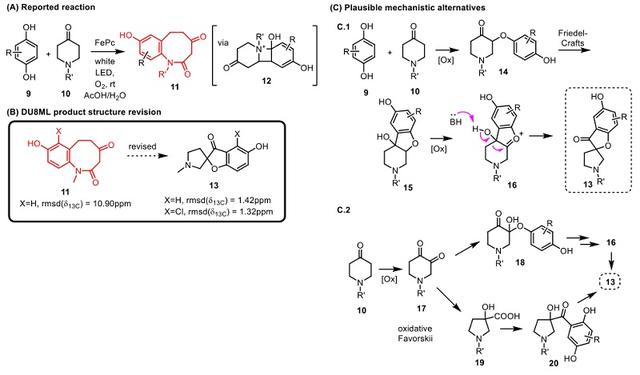
图3. 苯并内酰胺的结构修正和反应机理推测。图片来源:J. Org. Chem.
还有一例是强氧化剂DDQ催化的环庚烯和苯甲酰烯胺21之间的氧化偶联反应,生成了产物23(图4)。尽管反应机理看上去并无异常,但是细心的Andrei G. Kutateladze团队发现产物23的核磁氢谱在芳香区存在一个未知的宽单峰。事实上,DU8ML计算结果排除了23的环庚三烯结构,而是提出一个Z-式苯亚甲基产物24,后者是23的同分异构体。由于以往文献中有环己三烯氧化转化为苯甲醛的先例,因此反应机理也得到了更合理的推测。

图4. 环庚烯和烯胺氧化偶联反应的修正。图片来源:J. Org. Chem.
立体化学结构的错误解析在有机合成反应中也时有出现。例如有篇文献报道的苯醌并降冰片二烯的溴化反应机理有点不太合乎常规,此反应起始物25在-50 ℃下通过中间产物26和28分别产生化合物29、30和31(其中29 30 : 31 ≈ 1 : 2)。然而,原始论文中DFT计算发现26的能量只比28高3.5 kcal/mol。这些矛盾结论促使Kutateladze团队通过DU8ML进行分析,结果显示1,3-二溴化物30的解析有误,应修正为其差向异构体32。这样一来,产物29、32、31都是通过更稳定的中间产物28转化生成,反应机理也更合理(图5)。

图5. 溴化产物30的结构修正和溴化反应机理的重释。图片来源:J. Org. Chem.
另一个溴化反应例子是syn-7-溴降冰片烯经过逐步反应,产生了一系列三溴降冰片烷和二溴三环烯。然而,反应机理中出现了罕见的四环阳离子中间体35,为此他们通过DU8ML对产物36进行分析,发现其差向异构体37的结构更合理。在修正产物结构后,其溴化反应机理也得到了更好的阐释(图6)。

图6. 顺-溴降冰片烯的溴化反应修正。图片来源:J. Org. Chem.
此外,他们还研究了一例芳烃醚类化合物在含铁催化剂作用下的好氧脱氢α-氧化反应。原文中将观察到的区域选择性氧化与苯并二氢呋喃的卤素定位效应联系起来。然而,考虑到底物中还有吡啶并二氢呋喃,这样的机理解释未免有些牵强。实际上,他们通过DU8ML分析发现,起始原料44以及产物45、49的结构应分别修正为50、51、52。经过修正后,吡啶类底物的好氧区域选择性氧化机理就更为合理(图7)。
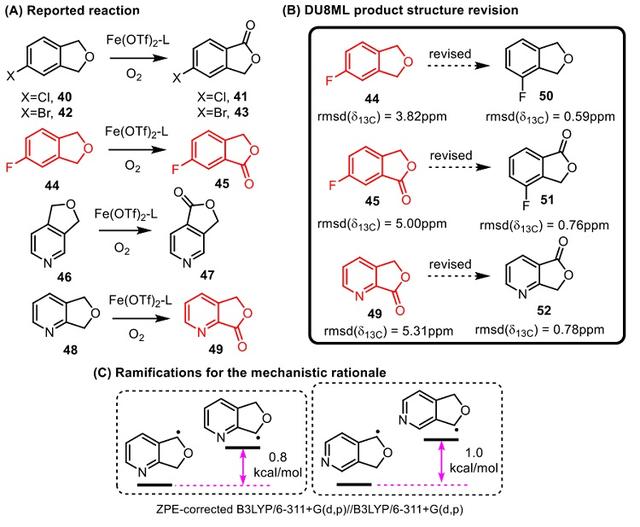
图7. 好氧脱氢α-氧化反应产物和机理的修正。图片来源:J. Org. Chem.
此外,他们还利用DU8ML成功地修正了一例1,2-二氢-3-甲基儿茶酚53的二环氧化反应中的产物结构,研究表明56的正确结构是其trans-非对映异构体60。这样的话,其相应的反应机理也更加合理(图8)。

图8. 己-3,5-二烯-1,2-二醇的结构修正。图片来源:J. Org. Chem.
对于缺乏质子的卤化产物,通过核磁正确解析其结构极具挑战性,这是因为这类化合物缺乏有价值的自旋耦合常数信息,并且难以计算出C-I或C-Br键的13C NMR 化学位移。因此,涉及这类化合物的反应机理出错概率较高。值得一提的是,在这种情况下DU8ML能派上用场,因为卤素的重原子效应使得碳化学位移计算评估更加精确。例如:他们运用DU8ML研究了2020年报道的一例亲电碘化反应产物68和71,发现扩环效应并不合理,产物应修正为72和73,并且反应机理涉及halo-Meyer−Schuster反应(图9)。在另一例类似的不合理反应中,不同底物在I2和固定化碘(III)催化剂的作用下分别扩环生成产物75、68、71。同样地,他们通过DU8ML分析将产物68、71、75分别修正为72、73、76(图9)。

图9. 两例产物结构有误的扩环反应。图片来源:J. Org. Chem.
尽管有的反应产物扩环无误,但是立体结构存在问题,例如:樟脑分子在乙炔锂的催化下逐步生成卤化的端炔中间产物86、87、88,并最终形成扩环产物90。然而,Kutateladze团队利用DU8ML分析显示,86、87、88、90的结构应修正为相应的立体异构体91、92、93、94,他们据此推测反应中炔醇扩环可能与炔基连接点的绝对构型有关(图10),即当乙炔基处于endo-构型时,亚甲基碳优先迁移;而当乙炔基处于exo-构型时,桥头碳进行迁移。

图10. 樟脑分子扩环反应产物和机理的修正。图片来源:J. Org. Chem.
最后,作者还利用DU8ML将二萜类ipomone(96)和iodoipomone(97)分别修正为98和99(图10),并提出了可能的反应机理:即H /I 先与环外双键进行加成,然后环内烯丙基碳进行迁移,从而导致产物中双环[3.2.1]辛烯酮的桥头亚甲基碳的立体化学翻转。

图11. 二萜类96和97的修正。图片来源:J. Org. Chem.
总结
这篇文章的研究提醒我们结构解析的“坑”无处不在,错误的结构会导致不靠谱的反应机理,若这样的问题结构和反应长期存在于文献中,被更多的人借鉴和引用,这会对整个有机化学研究领域产生不利的影响。因此,合理使用DU8ML等辅助解析技术,不仅能让我们的研究尽量避坑,而且将结构错误消弭于文章发表之前。
Peculiar Reaction Products and Mechanisms Revisited with Machine Learning-Augmented Computational NMR
Ivan M. Novitskiy, Andrei G. Kutateladze
J. Org. Chem., 2022, 87, 8589–8598, DOI: 10.1021/acs.joc.2c00749
(本文由天生西南供稿)
,




