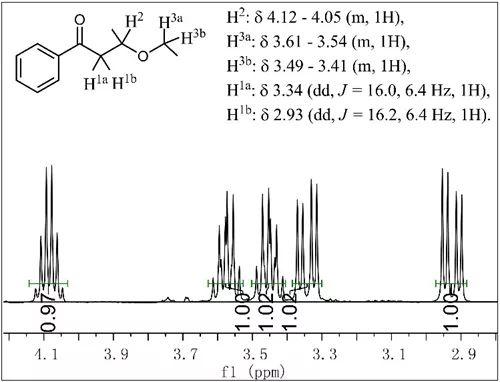
蛋白质作为生命活动实际执行的分子,在生物机理研究中处于非常重要的地位。随着蛋白与表型的相关关系、因果关系被逐渐阐明,生物机理的研究往往需要深入到蛋白相互作用层面。如何选择合适的蛋白分子,研究与之相互作用的蛋白网络,从而阐释生理过程也是科研实践中的经典问题。另一方面,天然情况下的蛋白互作,可以采用Co-IP等技术进行检测,然而对于植物、微生物、非模式动物等研究,往往缺乏合适的抗体,定制抗体周期长造价又高。
如何选择合适的蛋白,如何在没有抗体的情况下开展蛋白互作研究?这里,小编和大家一起分享一篇最新的文献,一起来看一看蛋白互作研究“套路”吧。
标题:Identification of proteins using iTRAQ and VIGS reveals three bread wheat proteins involved in the response to combined osmotic-cold stress
期刊:Journal of Proteome Research
主要技术:iTRAQ、酵母双杂交(Y2H)
研究背景:非生物逆境压力(Abiotic stress)对作物的影响巨大,其具体机制尚不明确。本文拟通过蛋白质组学与酵母双杂交等技术,初步研究渗透压-寒冷联合胁迫对小麦生长影响的机制。
研究结果:
1. 渗透压-寒冷联合胁迫影响小麦表型
图1 渗透压-寒冷联合胁迫对小麦表型的影响
2. 渗透压-寒冷联合胁迫影响小麦蛋白表达
分别提取实验组(渗透压-寒冷联合胁迫处理)与对照组小麦根和叶片的蛋白,采用iTRAQ标记进行蛋白质组学研究,分别鉴定到3703(根)和3009(叶)个蛋白,其中差异表达蛋白分别为250(根)和258(叶)个。对差异蛋白分别进行GO和KEGG分析,从整体上分析差异表达蛋白的生理功能(图2)。

图2 差异表达蛋白的GO与KEGG通路分析
3. 差异表达蛋白的结合分析与验证
对差异表达的蛋白分别进行蛋白-蛋白互作分析(PPI,图3),揭示其蛋白互作网络。选择其中5组互作蛋白,采用酵母双杂交(Y2H)技术进行点对点验证,最终发现1组存在强相互作用,1组存在较弱的相互作用(图4)。
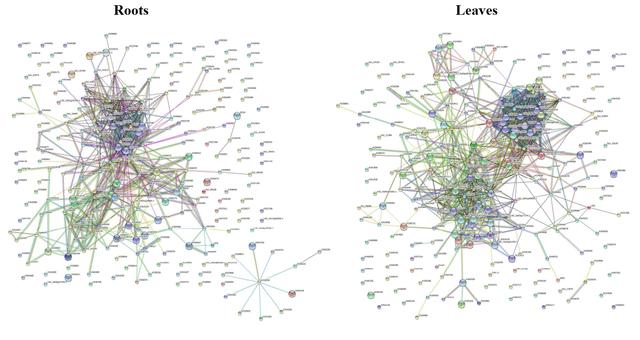
图3 差异蛋白的PPI分析

图4 酵母双杂交(Y2H)验证蛋白互作
研究小结:
在该研究中,首先通过表型实验发现暴露于渗透压-寒冷胁迫24小时的小麦幼苗显示出抑制生长,以及增加的脂质过氧化,相对电解质渗漏等表型变化。随后采用基于iTRAQ的定量蛋白质组方法确定暴露于渗透压-寒冷胁迫条件下的小麦幼苗的根和叶的蛋白质组学特征, 在根与叶中共鉴定出250个和258个差异表达蛋白质,并且这些蛋白质中的大多数显示出不同的丰度,从而揭示了器官特异性的差异。接着采用PPI互作分析阐释差异表达蛋白参与的互作调控网络,揭示蛋白互作网络在胁迫条件下的变化。最后从PPI分析中选出5对互作蛋白进行验证,确认胁迫造成的蛋白互作变化。
总结一下,本文采用了生理实验验证表型——蛋白质组学鉴定差异表达蛋白——PPI分析蛋白互作——酵母双杂交Y2H验证蛋白互作的经典套路,你学到了吗~
天然情况下,一般采用Co-IP等进行蛋白互作验证,而对于植物、微生物、非模式动物等,酵母双杂交(Y2H)完全可以帮您解决缺乏合适抗体,定制抗体周期长造价又高的难题。
,