往期链接:点击直达
- 13、高三化学总复习,硫及其化合物,高考热点元素,认真复习
- 14、高三化学总复习,氯及其化合物,强氧化,漂白,哪都有它
- 15、高三化学总复习,物质的分类,百分之70学生忘记的内容
- 16、高三化学总复习,少量过量方程式,难吗?看我总结
- 17、高三化学总复习,常见离子的检验,你学到了吗?
1、原子由原子核和核外电子构成。
原子核由质子和中子构成,位于原子的中心位置,核外电子绕核高速运动。
质子(Z)带一个单位正电荷,决定元素种类。
中子(N)不带电,一个质子约等于一个中子的质量,决定同位素的种类。
核外电子(e-)带一个单位负电荷,最外层电子可得失,决定原子是否带电荷。
2、质量数(A)=质子数(Z) 中子数(N)


3、对于原子:质子数=核外电子数=原子序数=核电荷数
4、元素:具有相同核电荷数(即质子数)的同一类原子的总称。
5、核素:具有一定数目质子和一定数目中子的一种原子称为核素。
6、同位素:
1)、定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
2)、同位素的应用

7、元素、核素、同位素的比较
- 1)、三者之间的关系

- 2)、同位素的“同”与“不同”

注意:

- 阴、阳离子中。
- ⑦核外电子数相同的微粒,其质子数不一定相同,如Na 和Al3 ,NH4 和OH-等。
- ⑧核裂变不属于化学变化。
- 1、电子层表示电子离原子核平均距离的大小,通俗地讲就是电子离原子核的远近。电子层常用n表示,n值越小,表示电子离核越近。由于电子的运动没有固定的轨迹,因此只能讲平均距离。
- 2、原子核外电子排布规律
1)、每个电子层最多能容纳2n2个电子。
2)、最外层电子数最多为8 (K层为最外层时,最多为2)。
a、最外层电子排满8个 (He为2个)形成相对稳定结构、该结构是稀有气体元素的原子结构、不易得失电子、因此化学性质稳定、一般条件下不发生反应。
b、最外层电子数较少的(1、2、3个)有失电子达到相对稳定结构的倾向、表现出金属性。
c、最外层电子数较多的(4、5、6、7个)有得电子或形成共用电子对达到相对稳定结构的倾向、表现出非金属性。
3)、次外层电子数最多为18个。
3、最外层电子数与元素性质的关系
1)、稀有气体元素原子最外层电子数一般为8(氦最外层只有2个电子),性质不活泼,既不易失去电子,又不易得到电子。常见化合价为0。
2)、金属元素的原子最外层一般少于4个电子,较易失去电子,显正价,失去几个电子就显正几价。
3)、非金属元素的原子最外层一般多于或等于4个电子,较易得到电子,显负价,得到几个电子就显负几价。
4、原子(离子)结构示意图
- 1)、原子结构示意图:质子数=核外电子数
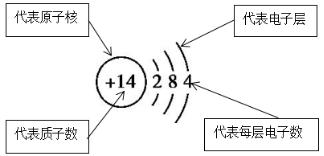
- 2)、离子结构示意图:
(1)、阳离子:失去最外层电子,质子数>核外电子数

(2)、阴离子:最外层电子得到电子,质子数<核外电子数

1、核外电子数相等的微粒的书写
1)、首先要找出所要书写的相应电子数目的稀有气体元素的原子。
2)、然后再根据“阴上阳下稀居中”的思维顺序,找出与稀有气体元素同周期的元素形成的阴离子和下一周期的主族元素形成的阳离子。
3)、写出阴离子所对应的元素的氢化物分子。
4)、若氢化物能自偶电离,则写出其电离生成的离子。如水可电离生成H3O 和OH-,氨能电离生成NH4 和NH2-。
5)、再写出特殊情况的等电子微粒。
2、10电子和18电子微粒
- 1)、10电子微粒:以Ne为核心,推断同周期的非金属元素形成的微粒和下一周期的主族金属元素形成的微粒。

- 2)、18电子微粒:以Ar为核心,推断同周期的非金属元素形成的微粒和下一周期的主族金属元素形成的微粒。

3、知识拓展
1、其他等电子数的微粒
“9电子”的微粒:—F、—OH、—NH2、—CH3(取代基)
“14电子”的微粒:Si、N2、CO、C2H2
“2电子”的微粒:He、H-、Li 、Be2 、H2
2、质子数及核外电子总数均相等的微粒
①Na 、NH4 、H3O ;②HS-、Cl-;③F-、OH-、NH2-;④N2、CO、C2H2等。
往期链接:点击直达
13、高三化学总复习,硫及其化合物,高考热点元素,认真复习
14、高三化学总复习,氯及其化合物,强氧化,漂白,哪都有它
15、高三化学总复习,物质的分类,百分之70学生忘记的内容
16、高三化学总复习,少量过量方程式,难吗?看我总结
17、高三化学总复习,常见离子的检验,你学到了吗?
如果您喜欢,可以收藏、点赞加关注,您的支持,是我继续推出文档的动力!
网页版,排版不太好,想要文字word文档的,请私信我!
,




