1.常见酸的性质和用途
(1)盐酸和硫酸的物理性质

(2)浓硫酸的特性
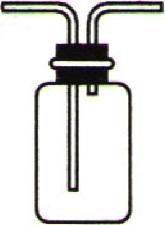
①吸水性:浓硫酸具有吸水性,在实验室常用作某些气体的干燥剂。如干燥氧气、二氧化碳等气体时,可将浓硫酸装入右图所示的洗气瓶中,然后将气体从长导管通入。
②脱水性:能够夺取纸张、木材、布料、皮肤里的氢、氧元素,按水的组成比脱去,使它们脱水生成黑色的炭,发生炭化。由于浓硫酸具有脱水性,所以表现出强烈的腐蚀性,若不慎将浓硫酸沾到皮肤上,应先用抹布擦拭,再用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
③强氧化性:与金属反应时一般不生成氢气。如金属锌与浓硫酸反应生成硫酸锌、二氧化硫和水。
(3)浓硫酸的稀释:浓硫酸溶于水时能放出大量的热,稀释浓硫酸时必须将浓硫酸沿着容器壁慢慢地倒入水中,同时用玻璃棒不断搅拌,使热量尽快散失。
(4)酸的化学性质及用途

2.常见的碱的性质和用途
(1)常见碱的物理性质

(2)碱的化学性质及用途

1.中和反应
(1)酸、碱作用生成盐和水的反应,叫中和反应。
(2)实质:氢离子 氢氧根离子 → 水
(3)应用:中和反应在日常生活和工农业生产中有着广泛的用途。如用熟石灰改良酸性土壤;服用某些含碱性物质的药物治疗胃酸过多;被蚊虫叮咬,可涂一些含碱性物质的溶液减轻痛痒。
2.溶液酸碱度的表示方法——pH

1.生活中的几种常见的盐

2.复分解反应及发生的条件

3.酸、碱、盐的溶解性规律
酸:初中范围内所学的酸全溶。(硅酸不溶)碱:钾、钠、钡、铵四碱易溶,氢氧化钙微溶,其余的全不溶。盐:钾盐、钠盐、铵盐、硝酸盐全溶。盐酸盐:除氯化银不溶,其余的全溶。硫酸盐:除硫酸钡不溶,硫酸钙、硫酸银微溶,其余的全溶。碳酸盐:除碳酸钾、碳酸钠、碳酸铵易溶,碳酸镁微溶,其余的全不溶。

其实溶解度很好记,上面这个表中,底色为浅蓝色区域(硝酸盐、氯盐、硫酸盐、铵盐、钾盐、钠盐),不溶的仅硫酸钡和氯化银。浅蓝色区域以外的,仅氢氧化钡、碳酸可溶,氢氧化钙和碳酸镁微溶。
,