
专题3-pH条件的控制
一.使某些金属离子形成氢氧化物沉淀
根据不同金属阳离子完全沉淀的pH数据,改变溶液的pH,使之处于某范围内,从而使杂质金属离子沉淀,并确保所需要的金属离子依旧存留在溶液中。
如下图可以明显发现,不同的金属阳离子形成难溶碱的pH范围存在差异。

【2019新课标Ⅲ]】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
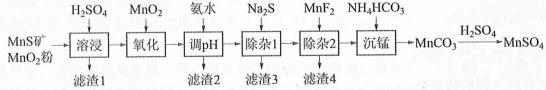
相关金属离子【c0(Mn )=0.1 mol·L−1】形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2
Fe2
Fe3
Al3
Mg2
Zn2
Ni2
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
【答案】4.7
【解析】由表中数据知pH在4.7时,Fe3 和Al3 沉淀完全,所以应该控制pH在4.7~6之间。
【2018全国卷II】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
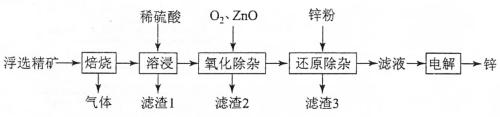
相关金属离子【c0(Mn )=0.1 mol·L-1】形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3
Fe2
Zn2
Cd2
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
【答案】调节溶液的pH 无法除去杂质Fe2
【解析】要测定铁离子,需要调节溶液的pH,又因为不能引入新杂质,所以需要利用氧化锌调节pH,即氧化除杂工序中ZnO的作用是调节溶液的pH。根据表中数据可知沉淀亚铁离子的pH较大,所以若不通入氧气,其后果是无法除去杂质Fe2 。
【练习】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
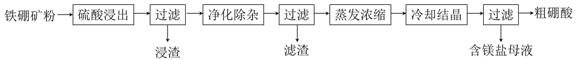
“净化除杂”需先加H2O2溶液,作用是_______。然后再调节溶液的pH约为5,目的是______________。
【答案】将Fe2 氧化为Fe3 ;使Al3 与Fe3 形成氢氧化物而除去。
【练习】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知不同杂质离子开始沉淀和沉淀完全的pH如下:

加入NH3·H2O调节pH=8可除去_______ (填离子符号),此时,溶液中该离子的浓度为_______mol·L-1。加入NaOH调pH=12.5,溶液内剩余的阳离子中_______完全沉淀,_____________ (填离子符号)部分沉淀。加入H2C2O4时应避免过量,原因是___________________________。(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39)
【答案】Fe3+ 2.6×10-21 Mg2 Ca2 H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少
【解析】根据流程图和表中数据可知:Fe3 完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3 3NH3•H2O=Fe(OH)3↓ 3NH4 ,Fe3 完全沉淀,滤渣1为Fe(OH)3,由Ksp[Fe(OH)3] =c(Fe3 )×c3(OH-)=2.6×10-39,pH为8,c(OH-)=1×10-6mol/L,则c(Fe3 )=

【2016江苏节选】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,
,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。(已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全)
【答案】至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成
【解析】(4)根据氢氧化镁和氢氧化铝沉淀的pH可知,滴加氨水的同时必须控制溶液的pH不能超过8.5,且也不能低于5.0,所以边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
二.调节溶液的酸碱性,促进或抑制水解
【练习1】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
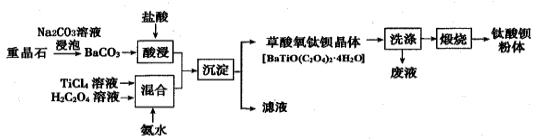
常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 。
【答案】溶于浓盐酸,再加适量水稀释至所需浓度
【解析】TiCl4是强酸弱碱盐,在溶液中Ti4 会发生水解反应:Ti4 4H2O

【练习2】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:
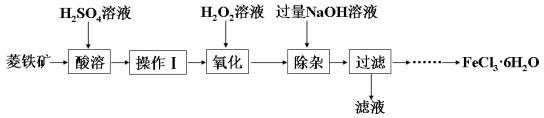
酸溶及后续过程中均需保持酸过量,其目的除了提高铁元素的浸出率之外,还有 。
【答案】抑制Fe3 水解
【解析】酸溶和后续过程中酸过量可以抑制Fe3 水解。
【练习3】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
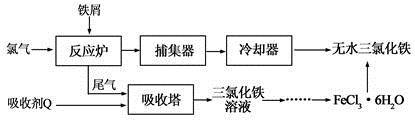
六水合氯化铁在水中的溶解度如下:
温度/℃
0
10
20
30
50
80
100
溶解度(g/100gH2O)
74.4
81.9
91.8
106.8
315.1
525.8
535.7
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。再由FeCl3·6H2O晶体得到无水FeCl3的操作是: 。
【答案】蒸发浓缩;冷却结晶;将FeCl3·6H2O晶体在干燥的HCl气流中加热;
【解析】由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加加热浓缩;再冷却结晶,Fe3 易水解,所以由FeCl3•6H2O晶体得到无水FeCl3,应在氯化氢气流中加热FeCl3•6H2O晶体,得到无水FeCl3,故答案为加热浓缩;冷却结晶;在氯化氢气流中加热FeCl3•6H2O晶体,得到无水FeCl3;
三.控制盐的水解反应进行的程度
Fe3 、Al3 、Cr3 、Ti4 等离子由于所带电荷数多,半径小,易发生强烈的水解反应。在中学教材中,对它们水解的离子方程式都做了简化处理,如Fe3 水解:Fe3 3H2O




【练习1】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶

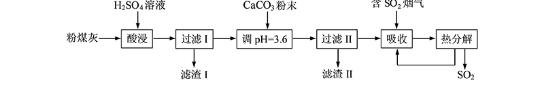
加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,
其原因是 (用离子方程式表示)。
【答案】CaSO4 3CaCO3 2Al3 3SO42- 3H2O=2Al(OH)3 3 CaSO4 3CO2↑
【解析】通过以上分析知,滤渣Ⅱ的成分是CaSO4,若溶液的pH偏高,溶液中的Al3 和OH-离子反应生成Al(OH)3沉淀,所以将会导致溶液中铝元素的含量降低,反应的离子方程式为:3CaCO3 2Al3 3SO42- 3H2O=2Al(OH)3↓ 3CaSO4 3CO2↑;
四.溶液的酸碱性影响离子的稳定性和存在形式
【练习】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

步骤①的主要反应为:FeO·Cr2O3 Na2CO3 NaNO3

步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是______ _____________(用离子方程式表示)。
【答案】小 2


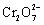
【解析】滤液2调节pH的目的是提高溶液的酸性,pH变小;因为溶液中存在2CrO42− 2H

【练习】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

根据H3BO3的解离反应:H3BO3 H2O
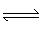
【答案】一元弱 转化为H3BO3,促进析出
【解析】由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,目的是将B(OH)−4转化为H3BO3,并促进H3BO3析出
【练习】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:

已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为______ _________;
【答案】溶液酸性过强,TeO2会继续与酸反应导致碲元素损失
【解析】TeO2能溶解于较浓的强酸性或强碱性溶液,故“加压浸出”时控制溶液pH为4.5~5.0,的酸性不能过强,否则TeO2会继续与酸反应导致碲元素损失
【2018全国Ⅲ节选】利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“调pH”中发生反应的化学方程式为 。
【答案】KH(IO3)2 KOH = 2KIO3 H2O
【解析】根据图示,碘酸钾在最后得到,所以过滤时KH(IO3)2应该在滤渣中,所以滤液中主要为KCl。“调pH”的主要目的是将KH(IO3)2转化为KIO3,所以方程式为:KH(IO3)2 KOH = 2KIO3 H2O。
【练习】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性。工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:Ⅰ.钒有多种价态,其中 5价最稳定。钒在溶液中主要以VO




Ⅱ. 部分金属离子的沉淀pH:
金属离子
Cu2
Fe2
Fe3
开始沉淀pH
5.2
7.6
2.7
完全沉淀pH
6.4
9.6
3.7
溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去___________离子,二是促使___________。
【答案】Fe3 、Cu2 VO


【解析】钒炉渣(主要含FeO•V2O3,还有少量Al2O3、CuO等杂质)进行碱浸,氧化铝溶解形成偏铝酸盐,过滤后滤渣1含有铁的氧化物、V2O5、CuO,滤液1含有偏铝酸盐,通入二氧化碳得到氢氧化铝沉淀,经过加热分解可得到氧化铝;滤渣1加入碳酸钠通入空气焙烧,产物加入硫酸,溶液1含有铁离子、VO



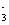
根据上面的分析可知,溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铁离子、铜离子,二是使VO



五.典型高考题
【2021全国乙卷26题】磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子
Fe3
Al3
Mg2
Ca2
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全

3.2
4.7
11.1
13.8
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,写出Al2O3转化为NH4Al(SO4)2的化学方程式_________________________________________________。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_________________。
(3)“母液①"中Mg2 浓度为_______
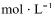
(4)“水浸渣”在160℃“酸溶”最适合的酸是____________。“酸溶渣”的成分是____________、____________。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2 水解析出
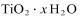
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得______________,循环利用。
【答案】(1)Al2O3 4(NH4)2SO4

(2)Fe3 、Al3 、Mg2
(3)1×10—6
(4)硫酸 SiO2、CaSO4
(5)TiO2 (x 1)H2O

(6)(NH4)2SO4
【分析】由题给流程可知,高钛炉渣与硫酸铵混合后焙烧时,二氧化钛和二氧化硅不反应,氧化铝、氧化镁、氧化钙、氧化铁转化为相应的硫酸盐,尾气为氨气;将焙烧后物质加入热水水浸,二氧化钛、二氧化硅不溶于水,微溶的硫酸钙部分溶于水,硫酸铁、硫酸镁和硫酸铝铵溶于水,过滤得到含有二氧化钛、二氧化硅、硫酸钙的水浸渣和含有硫酸铁、硫酸镁、硫酸铝铵和硫酸钙的滤液;向pH约为2.0的滤液中加入氨水至11.6,溶液中铁离子、铝离子和镁离子依次沉淀,过滤得到含有硫酸铵、硫酸钙的母液①和氢氧化物沉淀;向水浸渣中加入浓硫酸加热到160℃酸溶,二氧化硅和硫酸钙与浓硫酸不反应,二氧化钛与稀硫酸反应得到TiOSO4,过滤得到含有二氧化硅、硫酸钙的酸溶渣和TiOSO4溶液;将TiOSO4溶液加入热水稀释并适当加热,使TiOSO4完全水解生成TiO2·x H2O沉淀和硫酸,过滤得到含有硫酸的母液②和TiO2·x H2O。
【解析】(1)氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应的化学方程式为Al2O3 4(NH4)2SO4

(2)由题给开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀、然后是铝离子、镁离子,钙离子没有沉淀;
(3)由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10—5×(1×10—2.9)2=1×10—10.8,当溶液pH为11.6时,溶液中镁离子的浓度为
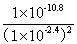
(4)增大溶液中硫酸根离子浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少TiOSO4溶液中含有硫酸钙的量,应加入浓硫酸加热到160℃酸溶;由分析可知,二氧化硅和硫酸钙与浓硫酸不反应,则酸溶渣的主要成分为二氧化硅和硫酸钙;
(5)酸溶后将TiOSO4溶液加入热水稀释并适当加热,能使TiOSO4完全水解生成TiO2·x H2O沉淀和硫酸,反应的离子方程式为TiO2 (x 1)H2O

(6)由分析可知,尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫酸铵溶液,可以循环使用。
【2021辽宁卷16】从钒铬锰矿渣(主要成分为V2O5



已知:pH较大时,二价锰在空气中易被氧化。回答下列问题:

(1)Cr元素位于元素周期表第_______周期_______族。

(2)用FeCl3

(3)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中c总(V) = 0.01mol/L,“沉钒”过程控制pH = 3.0,则与胶体共沉降的五价钒粒子的存在形态为__________(填化学式)。


(4)某温度下,
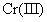








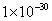
(5)“转化”过程中生成MnO2的离子方程式为___________________________________。

(6)“提纯”过程中Na2S2O3的作用为___________________________________。

【答案】(1)4 VIB



(3)
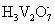



(6)防止pH较大时,二价锰被空气中氧气氧化,转化为MnO2附在Cr(OH)3的表面,使产物不纯

【解析】

(1)Cr是24号元素,价层电子对排布式为:3d54s1,根据最高能层数等于周期序数,价电子数等于族序数,故Cr元素位于元素周期表第4周期VIB族;

(2)用
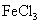



(3)常温下,各种形态五价钒粒子总浓度的对数[





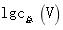

(4)某温度下,







(5)由分析可知,“转化”过程中生成
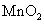

(6)由分析可知,“提纯”过程中


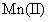
,





