化学反应速率是指表示化学反应进行的快慢。通常以单位时间内反应物或生成物浓度的变化侦(减少值或增加值)来表示,反应速度与反应物的性质和浓度、温度、压力、催化剂等都有关,如果反应在溶液中进行,也与溶剂的性质和用量有关。化学反应速率也是一些化学研究与学习的基础,我们需要铭记其中的所有知识点,高考中也是有极大的几率会考察。
一、化学反应速率
1.表示:
用单位时间内c反应物的减少或c生成物的增加来表示。
2.定义式:

注意事项
☆同一化学反应的反应速率可以用不同物质的浓度变化来表示 ,其数值可能相同,也可能不同,因此表示化学反应速率时要指明具体物质。
其他反应条件一定,化学反应速率随温度的升高而增大。
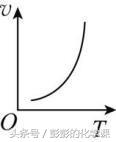
有气体参加的反应,化学反应速率随压强的增大而增大。

有气体参加的反应,化学反应速率随体积的增大而减小。

在不同温度下反应,化学反应速率随压强的增大及温度的升高而增大。

三、三段式计算化学反应速率

四、化学反应速率大小的比较方法
方法一:
第一步——统一单位
第二步——换算成同一物质表示的速率,再比较数值的大小。
方法二:
比较化学反应速率与化学计量数的比值。

五、影响化学反应速率的因素
1.内因
反应物本身的性质是影响化学反应速率的决定因素。
如在相同条件下卤素单质与H2反应的速率大小关系
F2 > Cl2 > Br2 > I2
镁、铝、锌、铁与稀硫酸反应的速率大小关系
Mg > Al > Zn > Fe
2.外因
①浓度 —— C↗,V↗
②温度 —— T↗,V↗ (除酶催化反应,T↗,酶活性降低)
③压强 —— P↗导致C↗,V↗ (有气体参与的反应)
④催化剂 —— 正逆反应速率同时增大或减小
⑤其他 —— 固体反应物表面积、光波、电磁波

六、有效碰撞理论——速率的理论解释
1.活化分子——能发生有效碰撞的分子。
2.有效碰撞——活化分子之间能够引发化学反应的碰撞。
3.活化能
E1——正反应的活化能
E2——逆反应的活化能
E3——加入催化剂后正反应的活化能
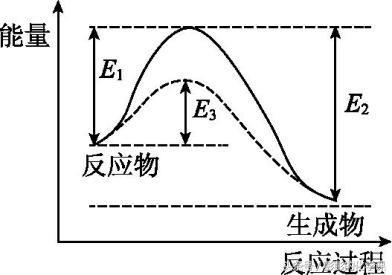
4.活化分子、有效碰撞与反应速率的关


七、充入惰性气体(或不参与反应气体)对反应速率的影响
恒容充惰→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变
惰性气体→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减慢
(效果等同于体积增大)
本节的总结就写到这了,这节的知识点接合之后的几个知识点,都是我们高中所学的几个重点知识点。现在彭老师给你你们划出来了,你们说记不记吧?化学反应没有太多的画面,需要配合你们的想象和理解去记忆。相信你们都可以迎刃而解。
文章还有很多不成熟的地方,欢迎大家提出意见,或者赞赏!






