
一、沉淀滴定:
1.概念
沉淀滴定是利用沉淀反应进行滴定、测量分析的方法。生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。
2.原理
沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。

二、典型例题讲解:
莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度.已知:
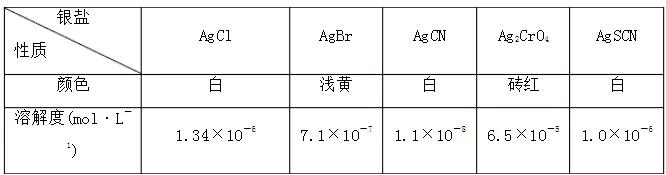
(1)滴定终点的现象是_ __.
(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________。
A.NaCl B.BaBr C.Na2CrO4
刚好达到滴定终点时,发生反应的离子方程式为______
分析:若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,
答案:(1)滴入最后一滴标准溶液,生成砖红色沉淀
(2)C 2Ag++CrO42-===Ag2CrO4↓
我们再来看一看2018年的高考真题
6.(6分)用0.100 mol•L﹣1 AgNO3滴定50.0 mL0.0500 mol•L﹣1 Cl﹣溶液的滴定曲线如图所示。下列有关描述错误的是( )

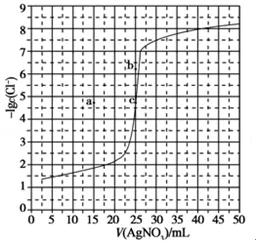
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10﹣10
B.曲线上各点的溶液满足关系式c(Ag )•c(Cl﹣)=Ksp(AgCl)
C.相同实验条件下,若改为0.0400mol•L﹣1 Cl﹣,反应终点c移到a
D.相同实验条件下,若改为0.0500 mol•L﹣1 Br﹣,反应终点c向b方向移动
分析:这是一道关于沉淀滴定曲线的试题,涉及曲线问题要找到关键点。那么哪些位置的点是关键点呢?一般情况下找起点,滴定终点。
A.沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处﹣lgc(Cl﹣)=4.8,达到沉淀溶解平衡时,c(Ag )=c(Cl﹣)=10﹣4.8mol/L,所以根据曲线数据计算可知Ksp(AgCl)=10﹣9.6Ksp(AgCl)的数量级为10﹣10,因此故A正确;
B.曲线上的点是沉淀溶解平衡的平衡点,Qc=c(Ag )c(Cl﹣)=Ksp(AgCl),故B正确;
C.溶度积常数只随温度改变而改变,改变滴定反应液浓度不改变溶度积常数,所以相同实验条件下,若改为0.0400mol•L﹣1 Cl﹣,50x0.04=0.1x x=20则所需AgNO3溶液体积就变为

D.AgBr比AgCl更难溶,Ksp(AgBr)<Ksp(AgCl)达到沉淀溶解平衡时Br﹣的浓度更低,则﹣lgc(Br﹣)值更大,消耗AgNO3溶液的体积不变,因此C点向B点靠近,故D正确。
答案:C

三、AgNO3滴定Cl-、Br-、I-图像的形态。
Ksp(Ag I)<Ksp(AgBr)<Ksp(AgCl),因此在达到滴定终点的时候溶液中:C(Cl-)> C(Br-) >C(I-),以-lgc(X-)做纵坐标时,Cl-、Br-、I-的滴定曲线越来越陡峭。
我们下面大家讲授一下如何应用这一结论。
常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:已知:p Ag =-lgc(Ag ),Ksp(AgI)=8.0×10-17,Ksp(AgBrI)=5.0×10-13,Ksp(AgCl)=1.8×10-10.下列说法正确的是( )
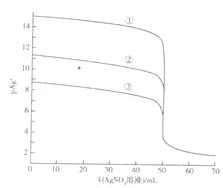
A.三种溶液各取10 mL混合,然后滴定,沉淀先后顺序为Cl-、Br-、I-
B.滴定Cl-时,可加人少量的KI作指示剂
C.当滴定AgNO3溶液至70.00mL时,溶液中c(I-)>c (Br-)>c(Cl-)
D.滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液
分析:常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,分别形成沉淀AgCl,AgBr,AgI,三种沉淀是同类型沉淀,可直接根据Ksp数值比较其溶解性情况,Ksp数值越小,则溶解度越小,
A.三种溶液各取10 mL混合,然后滴定,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),溶度积常数小的优先沉淀,所以沉淀先后顺序为I-、Br-、Cl-,故A错误;
B.若滴定Cl-时,选用KI做指示剂,则滴定优先产生AgI,不会先产生AgCl,达不到滴定Cl-的目的,故B错误;
C.当滴定AgNO3溶液至70.00mL时,此时溶液中Ag 过量,c(I-)=Ksp(AgI)/c(Ag )Ksp(AgI)c(Ag ),c(Br-)=Ksp(AgBr)/c(Ag )Ksp(AgBr)/c(Ag ),c(Cl-)=Ksp(AgCl)c(Ag )Ksp(AgCl)c(Ag ),由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),则平衡时c(I-)<c (Br-)<c(Cl-),故C错误;
D.根据刚才总结的结论,滴定相同浓度的NaCl,NaBr,NaI时,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),则平衡时,Cl-、Br-、I-的滴定曲线越来越陡峭。滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液,故D正确.
故选D.

我们再做到一道习题看一看你学会了么?
用0.1mol·L -1 AgNO 3 溶液分别滴定20.00mL浓度均为 0.1mol·L -1 Cl - 、Br - 、I - 溶液,以滴入的AgNO 3 溶液体积为横坐标, pX为纵坐标[pX=-lgc(X - ),X=Cl - 、Br - 、I - ],可绘得下图滴定曲线。已知25℃时:


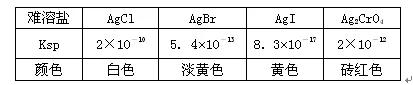
有关说法不正确的是( )
A.用硝酸银滴定法测定试样中c(Cl - ),可滴加0.1mol·L -1 K 2 CrO 4 溶液1~2滴作指示剂
B.a、b、c依次分别表示Cl - 、Br - 及I -
C.向NaCl和NaBr的混合溶液中滴加硝酸银溶液, 当两种沉淀共存时,c (Br - )/c(Cl - ) =2.7×10 -3
D.若用硝酸银溶液滴定NaI溶液,当pX=13时, 溶液中c (Ag )≈0.64×10 -17
BD
你答对了么?
,




