考点透析
一、原子的结构

注意:
1. 原子核内不一定有中子,如氢原子,核内只有一个质子;
2. 不同种类的原子,其根本区别在于它们核内
质子数的不同,这也决定了元素的种类;
3. 在原子中,核电荷数=核内质子数=核外电子数。
二、核外电子排布
原子和离子的核外电子是分层排布的,可以用结构示意图来表示。
如氧原子结构示意图如下:

1. 一般情况下,金属原子的最外层电子数较少(<4)易失去电子;非金属原子的最外层电子数较多(>4),易得到电子;最外层电子数为4时,得失电子都比较难,如C,性质反而相对稳定。
2. 当最外层电子数达到8个(只有一层时为2个)时,是一种相对稳定结构,如稀有气体的原子结构。
注意:
1. 根据粒子结构示意图可以判断某种粒子是原子还是离子(质子数-电子数=n);

2. 元素的化学性质与其原子的最外层电子数关系密切。
三、相对原子质量
1. 定义
以一种碳原子(核内质子数和中子数都是6的碳原子,这种碳原子也叫碳-12原子)质量的1/12作为标准,其他原子的质量与其比较所得的比值,作为这种原子的相对原子质量(符号为Ar)。
2. 表达式

注意:电子质量很小,因此原子的主要质量集中在原子核上。
相对原子质量≈质子数 中子数。
典例剖析
例题 根据下列粒子结构示意图,回答问题。

(1)上图A、B、C、D四种粒子共表示 种元素。
(2)D原子在化学反应中易 (填“得到”或“失去”)电子。
(3)由B元素和C元素组成的化合物BC的电子总数是 。
(4)E粒子带1个单位正电荷,则X= 。
解析:(1)决定元素、原子种类的是原子核内质子数,根据图示信息可以看出,A、B、C、D中质子数一共是三种,故表示的是三种元素;
(2)D原子最外层电子数是7,在化学反应中容易得到一个电子;
(3)B元素是镁元素,最外层电子数是2,容易失去2个电子,C元素是硫元素,最外层电子数是6,容易得到2个电子,所以当它们组合在一起时,原子个数是1:1,然后双方均可达到稳定结构,所以它们形成化合物BC里电子总数是两个原子核外电子总数之和,也就是它们核内质子总数之和,总数为12 16=28;
(4)E粒子带
1个单位正电荷,说明E原子失去一个电子,原子核外电子总数应该是2 8 1=11;
答案:(1)三(2)得到(3)28 (4)11
拓展提升
【方法提炼】
抓住等量关系,巧解原子结构题
原子是由居中的原子核和核外电子构成的,原子核带正电,核外电子带负电。原子核是由质子和中子构成的,一个质子带一个单位的正电荷,中子不带电。在原子结构中存在这样的两个等量关系:
1. 核电荷数=核内质子数=核外电子数=原子序数
2. 相对原子质量≈质子数 中子数
例题 某元素R的原子序数为m,能够形成核外有x个电子的Rn 离子,则下列关系式一定正确的是( )
A. m=n B. m=n x C. m=n-x D. m=x-n
解析:在原子中,原子序数=质子数=核外电子数,Rn 是阳离子,是由原子失去电子后形成的,Rn 带有n个单位正电荷,说明其原子一共失去n个电子,此时还有x个电子,说明原来的电子数应该是x n个,即R的核外电子数为x n,根据原子结构中的等量关系可以确定m、x、n三者的关系是m=x n。
答案:B
自我检测


(1)A、B、C属于离子的是 (填写选项序号)。
(2)若D表示某元素原子,则m= ,该元素的原子在化学反应中容易 (选填“得到”或“失去”)电子。
9. 广西矿产资源丰富,铟的生产规模居世界同类企业首位。图1是元素周期表中铟元素的信息,图2是铟原子的结构示意图,回答下列问题。

(1)铟元素属于 元素,其原子核外共有 个电子层。
(2)在化学反应中,铟原子容易 电子形成铟离子。
(3)画出第13号元素的原子结构示意图 。
10. 下图是某原子结构示意图,回答下列问题

(1)若A是某阴离子的结构示意图,则x可能是下列中的 (填字母序号)。
a.8 b.10 c.11 d.12
(2)若B表示某原子的结构示意图,则y= 。
参考答案
1. C 解析:A. 由于在第一个微粒结构示意图中,质子数=核外电子数=10,属于原子,故A错误;B. 由于在第二个微粒结构示意图中,质子数=核外电子数=18,属于原子,故B错误;C. 由于核内的质子数都是12,属于同一种元素,故C正确;D. 由于在第一个微粒结构示意图,质子数=9<核外电子数=10,属于阴离子,故D错误。
2. C 解析:圆圈内的数字表示原子的核电荷数,即核内质子数,因此A正确;该原子最外层只有1个电子,少于4个,属于金属元素,在化学反应中易失去最外层1个电子形成阳离子,B正确,C错误;根据结构示意图,核内质子数=核外电子数,该图表示的粒子是原子,原子呈电中性,D正确。
3. A 解析:元素X在周期表中的原子序数等于核内质子数,都等于16;X属于硫元素,属于非金属元素;硫最外层电子数是6,易得两个电子,带2个单位的负电荷;硫可以直接构成物质,属于非金属固体单质。
4. B 解析:根据题目给的信息,能判断出A正确;在原子中核电荷数=质子数=核外电子数,因此C正确;质子数相同就是同种元素,因此D正确;中子数=相对原子质量-质子数,因此两种原子的中子数分别为78和74,故选B。

6. A 解析:根据铱的偏旁可知铱元素属于金属元素,A正
确;原子序数=核内质子数=原子的核外电子数,据此可知B、C不正确;铱的相对原子质量=77 115=192,相对原子质量是个比值,其单位不是质量单位,D不正确。
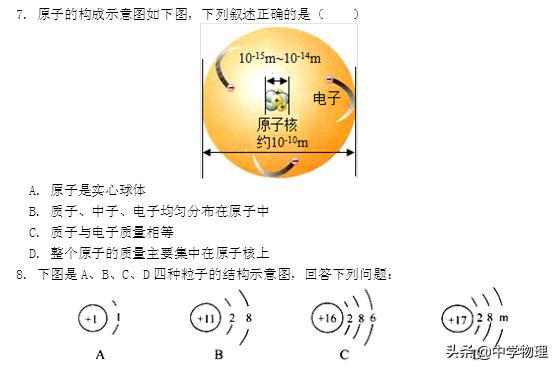
7. D 解析:A. 原子是由居于中心的原子核和核外广大空间运动的电子构成,不是实心的球体,故A错误;B. 质子与中子紧密结合形成了原子核,不是均匀分布在原子中,故B错误;C. 电子的质量很小,质子约是电子质量的1836倍,故C错误;D. 质子、中子的质量差不多,都约是电子质量的1836倍,因此整个原子的质量主要集中在原子核上,故D正确。
8.(1)B (2)7 ;得到
解析:离子是由原子得失电子后形成的,所以其核外电子数不等于核内质子数;原子结构示意图中,表示原子时,则核内质子数与核外电子数相等。

10. 6;该元素是非金属元素或该原子在化学反应中易得电子(原子不能写成元素)
解析:在原子结构示意图中,离核最远的一层为最外层,由图可知,该原子最外层有6个电子;根据最外层电子数为6,大于4,可以获取如下信息:该原子所属元素是非金属元素、该元素的原子在化学反应中易得到2个电子达到相对稳定结构、该元素的原子得到电子后形成的离子带2个单位负电荷。
11.(1)a(2)7
解析:A表示阴离子,则该粒子的质子数小于核外电子数,即X小于10,所以只有a符合;B表示原子,则其质子数等于核外电子数,即17=2 8 y,y=7。
,




