本文引用:张婷, 向波, 林勇平. 肿瘤标志物联合检测在肺癌辅助诊断中的预测价值 [J] .
摘要旨在探讨流式荧光发光法联合检测血清学肿瘤标志物癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、鳞状上皮细胞癌抗原(SCCA)、细胞角蛋白片段19(CYFRA21-1)和胃泌素释放肽前体(ProGRP)水平在肺癌辅助诊断中的预测价值,采用病例对照研究设计,本研究收集2019年12月至2020年3月广州医科大学附属第一医院诊断为肺癌的住院患者305例(其中腺癌156例、鳞癌89例、小细胞肺癌58例、大细胞肺癌2例)为肺癌组,同时选择体检健康对照组(HC)和肺部良性疾病对照组(BLD)各100例,应用流式荧光发光法检测血清中肿瘤标志物的水平。阳性率比较采用卡方检验,肿瘤标志物水平比较采用Mann-Whitney和Kruskal-Wallis检验,并绘制受试者工作特征(ROC)曲线,分析各标志物单项及联合检测在肺癌及其病理分型诊断中的应用价值。血清中五项肿瘤标志物联合检测辅助诊断肺癌、肺腺癌、肺鳞癌、小细胞肺癌的阳性率分别为:70.82%、64.74%、76.40%、81.03%,均显著高于单项检测。CEA、NSE、SCCA和CYFRA21-1水平在肺癌组、HC组和BLD组间比较(χ²值分别为90.599、32.802、8.473、40.397,P均<0.05)差异具有统计学意义;ProGRP水平在这三组间的差异无统计学意义(χ²值为3.366,P>0.05),但在小细胞肺癌与肺腺癌(Z=6.404,P<0.001)和肺鳞癌(Z=5.765,P<0.001)组间的差异有统计学意义。血清中五项肿瘤标志物联合检测可以提高早期(Ⅰ Ⅱ)和晚期(Ⅲ Ⅳ)患者诊断的阳性率,晚期患者的阳性率(76.34%)与早期(35.29%)比较差异有统计学意义(χ²=24.941, P<0.001)。血清中五项肿瘤标志物联合检测诊断肺癌淋巴结转移阳性检出率(76.31%)和远端转移的阳性检出率(78.18%)均显著高于单项检测,同时在淋巴结转移患者和远端转移患者的阳性检出率明显高于未转移患者(χ²值分别为24.60、9.50,P均<0.05)。血清中五项肿瘤标志物联合检测诊断肺癌的灵敏度(70.82%)、准确度(69.10%)、阴性预测值(59.91%)均高于单项检测,ROC曲线显示,血清中五项肿瘤标志物联合检测诊断肺癌、肺腺癌、肺鳞癌、小细胞肺癌的AUC分别为0.769、0.780、0.766和0.831。流式荧光发光法联合检测CEA、NSE、SCCA、CYFRA21-1和ProGRP五项肿瘤标志物可提高肺癌及其不同病理类型的诊断效能。
肺癌是发病率和死亡率最高的恶性肿瘤之一[1,2],已经成为严重危害人类健康的公共卫生问题。由于早期肺癌的临床症状不明显,多数患者就诊时已经为中晚期[1,3],因此肺癌的早期诊断已成为当今面临的重大难题。目前肺癌的临床诊断主要依靠影像学和病理,美国国家肺癌筛查试验(National Lung Screening Trial, NLST)推荐每年进行低剂量螺旋CT检查无症状肺癌高危患者[4],但CT筛查有时难以发现较小的肺部肿瘤,而且对部分肺部结节与肺癌难以进行有效的鉴别诊断,病理学诊断具有创伤性和标本取材的限制。而血清学肿瘤标志物的检测具有快速、准确、无创、可重复测定等优点,因此已经被广泛应用于肿瘤的临床辅助诊断,本研究采用流式荧光发光技术检测肺癌相关肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、鳞状上皮细胞癌抗原squamous cell carcinomaantigen,SCCA)、细胞角蛋白片段19(cytokeratin 19-fragments,CYFRA21-1)和胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP),评估它们在肺癌及其不同病理分型中的辅助诊断价值。
01材料与方法1.对象:采用病例对照研究设计,收集2019年12月至2020年3月在广州医科大学附属第一医院病理诊断为肺癌的住院患者305例,年龄24~81岁,中位年龄60岁,男性228例,女性77例。排除标准为合并其他恶性肿瘤或患有严重肝肾疾病及免疫系统疾病者。选择同期的健康对照组(healthy controls,HC)和肺部良性疾病对照组(benign lung diseases,BLD)各100例。HC组年龄20~79岁,中位年龄45岁,男性48例,女性52例。BLD组(肺炎47例,慢性阻塞性肺病25例,间质性肺炎10例,哮喘9例,支气管扩张并感染8例,肺脓肿1例)年龄15~87岁,中位年龄61岁,男性70例,女性30例。HC组和BLD组排除标准为明确有恶性肿瘤疾病史或目前临床资料提示恶性肿瘤可能的人群。参考国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)第八版肺癌分期标准[5]和原发性肺癌诊疗规范(2018年版)[6],对肺癌组的患者资料进行统计分析。2.方法:采集空腹静脉血3 ml,3 040 × g离心10 min,在完成临床检测项目后留取剩余血清500 μl, 保存于-80 ℃冰箱。采用流式荧光发光法检测CEA、NSE、SCCA、CYFRA21-1和ProGRP水平,检测仪器为Luminex200流式点阵分析仪,试剂均为定量测定试剂盒(上海透景),校准品、质控品均为各试剂盒原装配套,操作时严格按照仪器及试剂盒说明书的要求进行。各项目的参考区间引自试剂盒说明书并经本实验室验证如下:CEA为0~5 ng/ml,NSE为0~25 ng/ml,SCCA为0~1.5 ng/ml,CYFRA21-1为0~5 ng/ml,ProGRP为0~66.5 pg/ml。统计时将测定结果高于参考区间上限即判读为阳性,联合检测中任意一项阳性即判读为联合检测阳性,反之则为阴性。3. 统计学分析:用SPSS16.0进行统计,计数资料的阳性率用%表示,组间比较采用卡方检验,肿瘤标志物水平采用中位数(四分位数间距)描述,两两比较采用Mann-Whitney检验,三组间比较采用Kruskal-Wallis检验。采用受试者工作特征(ROC)曲线评价诊断能力,双侧检验,检验水准α=0.05。由于大细胞肺癌患者只有2例,故仅在总的肺癌组列入计算。
02结果
1.不同特征肺癌患者的血清肿瘤标志物阳性率比较:单项检测中诊断肺腺癌、肺鳞癌、小细胞肺癌阳性率最高的标志物分别为CEA、CYFRA21-1、ProGRP。五项联合检测在肺癌的病理分型、淋巴结转移、远端转移及晚期患者的阳性率均显著高于单项检测,在是否发生淋巴结转移、远端转移和早晚期各组间的比较差异有统计学意义,见表1。

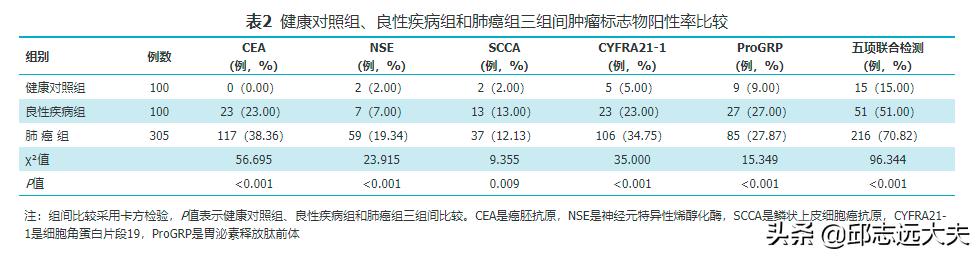
2. 健康对照组、良性疾病和肺癌组三组间肿瘤标志物阳性率的比较:结果表明,单项检测中CEA在肺癌组的阳性率最高(38.36%),采用五项联合检测后肺癌组的阳性率显著提高至70.82%,单项和五项联合检测肿瘤标志物阳性率在三组间的比较差异均有统计学意义,见表2。
3. 肺癌组、健康对照组和良性疾病组的肿瘤标志物水平比较:分析各组间肿瘤标志物血清水平的差异,CEA、NSE、SCCA、CYFRA21-1的水平在三组间的比较差异均有统计学意义,ProGRP的水平在肺癌组较高,但在各组间比较差异均无统计学意义,见表3。

4. 各病理分型肺癌的肿瘤标志物水平比较:NSE、SCCA、CYFRA21-1和ProGRP水平在肺腺癌、肺鳞癌和小细胞肺癌三组间的比较差异均有统计学意义,CEA水平在肺腺癌高于肺鳞癌和小细胞肺癌,但在三组间和组间两两比较差异无统计学意义,见表4。

5. 单项及联合检测肿瘤标志物诊断肺癌的效率分析:单项检测的特异度和阳性预测值(positive predictive value, PPV)较好,联合检测后的灵敏度、准确度和阴性预测值(negative predictive value, NPV)均高于单项检测,见表5。

6. 肿瘤标志物单项及联合检测的ROC曲线分析:ROC曲线结果(见图1)显示,诊断肺癌、肺腺癌、肺鳞癌和小细胞肺癌曲线下面积(area under curve,AUC)最大的单项指标分别为:CEA(0.709)、CEA(0.720)、SCCA(0.848)、ProGRP(0.781),联合检测诊断肺癌、肺腺癌、肺鳞癌和小细胞肺癌的AUC分别为:0.769、0.780、0.766和0.831,除SCCA单项在肺鳞癌的AUC较高外,均为联合检测的AUC高于单项检测。

图1各型肺癌单项及联合检测肿瘤标志物的ROC曲线。图A、B、C、D分别为肺癌组、肺腺癌组、肺鳞癌组、小细胞肺癌组
03讨论肺癌可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),NSCLC主要包括腺癌、鳞癌和大细胞癌,约占肺癌的80%。肺癌的5年生存率约为19%[7],SCLC患者的5年生存率低于7%[8],首次发现时多为中晚期,因此,及时准确的诊断对于肺癌的诊治及预后具有非常重要的意义[9]。近年来随着检测技术和分子生物学的发展,已经有越来越多新的肺癌肿瘤靶标应用于临床诊疗之中,如表皮生长因子受体(epidermal growth factor receptor, EGFR)、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、肉瘤致癌因子-受体酪氨酸激酶(c-ros oncogene 1, receptor tyrosine kinase, ROS-1)等基因检测以及液体活检中的细胞外囊泡,循环肿瘤细胞等[10,11,12],陆柳等[13]研究表明七项肿瘤相关自身抗体检测联用可以辅助诊断NSCLC。由于受检测方法及条件等的限制,血清学肿瘤标志物检测在临床上应用最为广泛,由于迄今尚未发现可以高特异地诊断肺癌的特异血清学肿瘤标志物,为提高临床诊断的灵敏度和特异度,一般采用多项肿瘤标志物联合检测。肺癌相关的血清学肿瘤标志物主要包括CEA、NSE、SCCA、CYFRA21-1和ProGRP[6], 本研究采用流式荧光发光技术进行检测,该技术通过在反应载体微球上标记不同比例的荧光染料,实现同时联合定量检测多个项目,由于其相比于化学发光技术面世较晚,目前关于流式荧光开展肿瘤标志物的研究较少,本研究通过评估五项肿瘤标志物在不同类型肺癌中的检测性能,为临床应用提供依据。本研究结果表明,在肺癌、肺腺癌、肺鳞癌、SCLC患者中阳性率最高的单项指标分别为:CEA、CEA、CYFRA21-1、ProGRP,与以往的研究结果基本一致[14,15,16],五项肿瘤标志物联合检测的阳性率显著高于单项检测,最高可达81.03%。各指标在HC组中阳性率低,但在BLD组中的阳性率稍高,可能与良性肺部疾病刺激促进表达相关[17]。CEA、NSE、SCCA和CYFRA21-1水平在肺癌组、HC组和BLD组间比较差异具有统计学意义,ProGRP水平在这三组间比较差异无统计学意义,但在SCLC组显著高于肺腺癌和肺鳞癌组。在各病理分型肺癌标志物水平比较中, NSE和ProGRP在小细胞肺癌与肺腺癌、小细胞肺癌与肺鳞癌比较中有统计学意义,提示可以作为小细胞肺癌与其他肺癌类型区分的预测因子;SCCA和CYFRA21-1在肺鳞癌与小细胞肺癌、肺鳞癌与肺腺癌比较中有统计学意义,提示可以作为肺鳞癌与其他肺癌类型区分的预测因子。CEA水平在肺腺癌组高于肺鳞癌和小细胞肺癌组,但在三组间比较差异无统计学意义,与Hengmin等[18]研究结果类似。联合检测诊断肺癌的灵敏度、准确率、阴性预测值均显著高于单项诊断,与文献报道[19]研究结果类似。不同临床分期患者肿瘤标志物结果显示,联合检测可以显著提高早期肺癌患者诊断的阳性率,可为患者赢得早诊断早治疗的机会。联合检测在淋巴结转移患者和远端转移患者的阳性检出率明显高于未转移患者,彭彦等[20]研究表明多项肿瘤标志物异常患者更易出现远处多部位转移。ROC曲线分析显示,单独诊断时,CEA在肺癌和肺腺癌的AUC均最大,SCCA在肺鳞癌的AUC最大,ProGRP在小细胞肺癌的AUC最大,联合检测可以提高肺癌及其病理分型临床诊断效能。综上所述,流式荧光发光法联合检测CEA、NSE、SCCA、CYFRA21-1和ProGRP,可以提高肺癌及其不同病理类型的临床诊断效能,提高早期患者的阳性率,可能具有较好的临床应用前景。但本研究存在一定的局限性,首先,本研究中大细胞肺癌病例只有2例,故无法评价对该类患者的检测效能,其次需要优化各组人群分布以及增加早期分组的标本量,同时需要在后续研究中进行更大规模的验证各标志物在肺癌诊断和治疗监测中的应用价值。所有作者均声明不存在利益冲突
,