各位领导,大家好。今天,我说课的内容是苏教版《高中化学必修四》专题三:溶液中的离子反应,第二单元:溶液的酸碱性的第二课时:酸碱中和滴定
本节课我主要采用诱导学生思考探索与定量实验研究的方法。首先创设情境,引出问题,启发质疑,引起学生好奇、惊疑,激发学生的内在动力。然后是实验探究,以准确的实验现象让学生找出其中的规律,培养学生观察实验现象、记录实验结果、分析实验现象的能力,从而让学生在学习中形成这个知识点,掌握科学原理。
一、 教材分析
1、 教材的地位和作用
本节课属于分析化学的内容,主要讨论定量分析中强酸与强碱的中和滴定。酸碱中和滴定操作简便、快速,并且有足够的准确性,因此,该方法具有很大的实用价值,在工农业生产和科学研究中被广泛使用。
2、 教学目标
【知识与技能】
①认识酸碱中和滴定的原理,掌握有关一元强酸和一元强碱中和滴定的简单计算。
情景二:将一瓶市面上常见的乌龙茶饮料倒入杯中,向里面加入柠檬水,乌龙茶的黑色迅速退去。

以上两个实验强烈的视觉冲击和神秘感使学生目瞪口呆,学生未必想得到是化学原理,于是我提问道:
这是科学还是迷信?这些看似不可思议的现象是否蕴含着一些我们从化学角度能够解释的化学原理?
学生开始思索和并且饶有兴趣的讨论和推理相关的化学原理。
待学生讨论片刻后,教师总结引导化学反应常常有颜色的变化,而酸碱中和可能引起颜色的变化,就是其中的一种。由此引入本本节课的第一个内容:常见的酸碱指示剂。
【引入本节课教学内容】
1.常见指示剂的变色范围
首先视频欣赏多种指示剂在不同ph时五彩缤纷的颜色变化,引起学生的兴趣,引入常见的酸碱指示剂
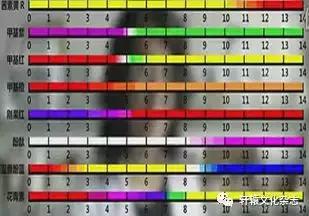

(酸碱中和学生并不陌生,但是酸碱很中和滴定这个概念是这节课的新内容,在掌握了酸碱中和要用的指示剂及其作用后,我接下来结合例题来导入和巩固酸碱中和滴定的概念。)
[知识回顾]
1.酸碱中和反应的实质是什么?
引导:中和反应的实质:H OH-=H2O
2.中和滴定的原理 以盐酸与氢氧化钠反应为例。
HCl NaOH == NaCl H2O
如果已知盐酸的浓度,测定NaOH 的浓度。
量取VB,读出VA,即可求出C(B)。
[讲解]滴定管的结构和使用方法
多媒体展示酸碱滴定管的结构


让学生观察酸碱滴定管的结构,注意以下几点。
1.酸式滴定用的玻璃活塞,碱式滴定管用的橡皮管。(思考为什么?)
2.滴定管的刻度从上往下标,下面一部分没有读数,因此使用时不能放到刻度以下。
3.酸式滴定管不能用来盛放碱溶液,碱式滴定管不盛放酸溶液。
4.滴定管的精确度为0.01mL,比量筒精确。
【使用方法】
检漏→ 洗涤→ 装液→ 调零 → 滴定
[思考讨论]怎么确定滴定终点(酸碱恰好完全反应)?
1.可用PH计
2.酸碱指示剂 溶液颜色变化后半分钟内不改变
【例题】
[示范演示]教师播放中和滴定的录像,进行操作示范,请学生认真观看,注意观察滴定步骤,识记各步的操作要点。
1.准备:检漏—→蒸馏水洗—→溶液润洗
2.注入标准液:灌液—→排气泡—→调整液面并记录
3.量取一定体积的待测液:放出待测液—→加指示剂
4.滴定: 滴定操作—→滴定终点判断—→数据读取记录
{操作要点}在教师的引导下,学生回忆操作步骤,进行心理练习,形成动作表象,强化操作顺序和操作要点,以便顺利准确地进行操作练习。
1.为什么要用待盛液润洗滴定管?怎么润洗?
2.为什么要排尽玻璃尖嘴管中的气泡,怎样操作?
3.滴定过程中用_______手控制活塞,用________手摇动锥形瓶,眼睛应注视__________
4.如何判断滴定已经达到终点?________________________________________
[活动与探究]分组完成教材P70页的“活动与探究”,并绘制出滴定过程的PH变化图。
学生分组完成,教师指导。
(.新的疑问:学生观察到常用的知识及变色范围后,会发现指示剂颜色变化的区间并不是ph=7时。因为室温下酸碱恰好中和时ph刚好等于7,那么这样的指示剂是否在酸碱中和的过程中存在着误差?)
[交流讨论]为什么滴定过程中接近终点时PH会发生突变?这个突变有什么意义?
(通过多媒体辅助教学,以往氢氧化钠中滴加盐酸为例,将实验归纳好的图像直接展现在大家眼前,让同学们清晰的看到,在加入某一滴盐酸的过程中,ph值有一个突变。可能这一滴加下去,溶液就瞬间从碱性变到酸性。而一滴溶液只有约0.05ml,因此即使指示剂的变色范围不在ph=7时,依然可以较为准确地测量出酸碱中和的终点。于是这个问题迎刃而解,同学们在我的讲解过程中慢慢明白了。)

[小结] 可通过计算得出多滴1滴或少滴1滴(约0.05mL)PH突变的原因。这种突变说明只要选择变色范围在这一范围的指示剂,不会产生很大误差,因为多滴1滴或少滴1滴PH会产生明显变化。
[巩固应用]
2、某学生中和滴定实验的过程如下:
(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)加入待测的NaOH溶液,(d)记录液面刻度的读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入2滴酚酞试液,(i)开始滴定,边滴边摇荡,(j)边注视滴定管内液面变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定。(l)记录液面刻度的读数。(m)根据滴定管的两次读数得出NaOH溶液的体积为22 mL。指出上述实验过程中的错误之处(用编号表示) 3.进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是( )
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.移液管
4.中和滴定中,视线应注视( )
A.滴定管内液面变化 B.液滴滴出速度
C.滴定管刻度 D.锥形瓶中溶液颜色变化
5.要准确量取25.00 mL稀盐酸,可用的仪器是( )
A.25 mL移液管 B.25 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
|
1、(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。 (2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。 A. 是amLB.是(50-a)mL C. 一定大于amLD.一定大于(50-a)mL |
|
[课堂小结] |
【板书设计】
第二课时酸碱中和滴定
一、酸碱中和滴定
1.定义:用已知浓度的酸滴定未知浓度的碱,或用已知浓度的碱滴定未知浓度的酸。
2.计算公式:c酸v酸=c碱v碱
二、酸碱中和滴定实验
1.主要仪器:酸式滴定管,碱式滴定管,锥形瓶,铁架台,滴定管夹
2.实验步骤:检漏→洗涤→润洗→装液→调零 → 滴定→读数→计算
3.实验要领:左手滴管右手瓶,双眼紧盯溶液中
【教后反思与总结】
1.教学设计创新之处
本节课的教学设计创新之处在于我将传统的课堂内容的顺序进行了些许的调整。将酸碱指示剂在中和滴定中的作用放在了最前面。
因为在这节课之前的很长一段时间,化学教学内容的难度一直居高不下,从比较抽象的化学平衡移动,化学平衡图像,等效平衡,一直到的纷繁复杂弱电解质的电离平衡,水的离子积常数,溶液中离子浓度的比较,再到ph的计算……可以说这段时间学生上课一直处于神经高度紧绷的状态,生怕一不留神就听不懂而被化学抛弃。我想以本节课为契机,把化学和生活中的现象结合起来,让学生眼前一亮,耳目一新,心理上放松一下,重新燃起对化学的兴趣与热爱。所以从法术“杀鬼见血”和魔术“乌龙茶变色”入手,引入酸碱指示剂,进而展开本节课的教学工作。
2.不足之处
本节课归根结底讲的是酸碱中和滴定的概念及其实验操作。整节课与平时其他内容相比较,有信息容量大,新事物多(新概念,新实验仪器,新操作方法),计算多,注意事项多(酸式滴定管,碱式滴定管的区别,检漏,润洗、,注液、排气泡的方法,滴定时左右手分别操作,眼观颜色变化…….)
这一系列内容与学生原有的旧知识关联很小,学生整个过程中无法利用旧知识进行辐射强化,在大量的新知识面前,一时间大脑一片空白,手忙脚乱,应接不暇。如何让学生在短短的一节课内掌握全部要领,做到360度无死角?我觉得我还做的不够好
3.改进措施
①酸碱中和滴定的实验仪器使用细节一开始不必事无巨细的一一告知。应该先只讲操作的大方向,让学生思路非常清晰的知道自己在做什么实验。具体操作细节等学生掌握了大方向再慢慢纠正和调整。
②将课堂一开始的“设疑激趣(7分钟) →启思诱导(4分钟)”两个环节压缩到8分钟左右,省下来时间全部用来指导学生实验
以上是我《酸碱中和滴定》说课稿的全部内容,欢迎各位领导提出宝贵意见和建议,谢谢。
(本文为作者原创,未经许可谢绝转载~)
,




