1.氧化还原反应的实质是电子的得失或电子对的偏移;特征是反应前后元素化合价的升降;所以判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征作为突破口。
2.基本概念关系
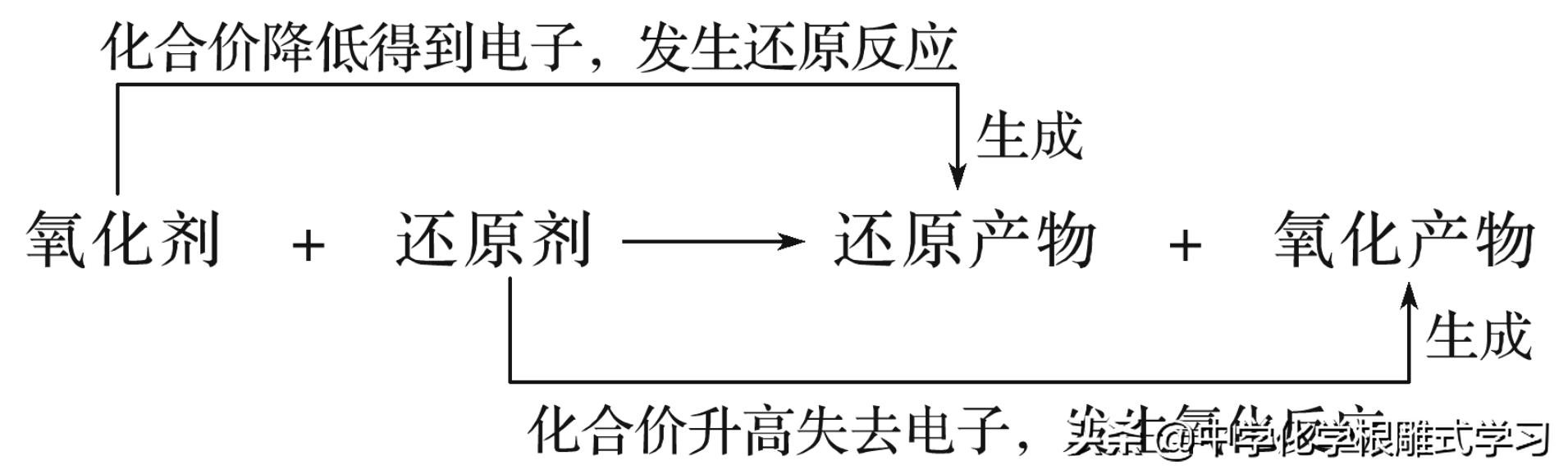
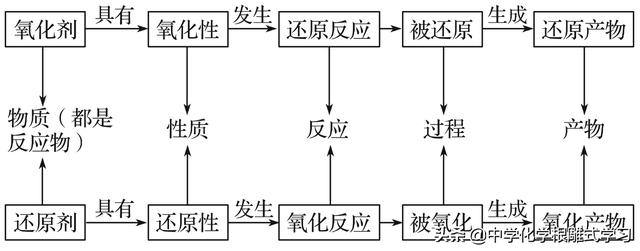
氧化剂与还原剂是反应的内在因素,氧化产物和还原产物是反应的必然结果,所以氧化还原反应反应体现了物质变化中的因果关系。
3.氧化还原反应的表示方法 (1)双线桥法
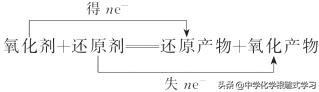
双线桥法跨越反应物和生成物中的同一种元素,必须体现得到和失去电子的数目。
(2)单线桥法

单线桥法通常在反应物中不同元素或相同元素中画出,线桥从还原剂出发指向氧化剂结束,必须标出转移电子的数目。
3,氧化性、还原性及其强弱比较
氧化性→得电子能力,得到电子越容易→氧化性越强。
还原性→失电子能力,失去电子越容易→还原性越强。
物质的氧化性或还原性的强弱只取决于得到或失去电子的难易程度,与得失电子的数目无关。








