化学好教师
高一化学是高中化学学习最为重要的阶段,学习内容不仅涉及到高中化学最为重要的两大反应——氧化还原反应和离子反应,也包括高中化学最为重要的元素化合物知识,如以钠元素为代表的碱金属元素,以氯元素为代表的卤族元素,以硫元素为代表的氧族元素等。高一化学学习中有许多难点需要突破,这些难点主要集中在一些典型问题的理解、解答与拓展上。
如何突破难点,关键是要从典型问题的解答中走出来,做到举一反三。
问题一、如何除去NaCl溶液中少量的MgCl2和Na2SO4杂质?
分析:这个问题极具代表性,同学们绝不能只限于会解答这一道习题,而是要学会解答这一类习题。显然,要除去NaCl溶液中的MgCl2和Na2SO4,实质上就是要除去

与

。除去

应该用过量的可溶性强碱溶液,除去

应该用过量的可溶性钡盐溶液。但很快又会涉及到另一个问题,即过量的

与

又该如何处理呢?
不难看出,应该选择盐酸与过量的碳酸钠溶液,且最后三步必须遵循以下顺序:加入碳酸钠溶液、过滤、加入适量的盐酸(因为最后加入盐酸,可反应掉溶液中过量的碳酸根离子)。
所以正确的操作步骤应该是:①取适量NaCl溶液;②加入过量的NaOH溶液;③加入过量的

溶液;④加入过量的

溶液;⑤过滤;⑥加入适量的盐酸。
结论:对给定物质及所含杂质性质的掌握,是解答本题的前提。在这基础之上,做好试剂的选择及确定正确的操作顺序,便可顺利解题。不仅此题如此,亦可推广到同类题目,达到举一反三、多题同法的目的。
应用:除去下列物质中的杂质。
(1)KCl溶液中含少量的

及

。
解答:①加入过量的

溶液;②加入过量的

溶液;③过滤;④加入适量的盐酸。
(2)
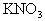
溶液中含少量的

及

。
解答:①加入过量的KOH溶液;②加入过量的

溶液;③加入过量的

溶液;④过滤;⑤加入适量的硝酸。
(3)
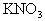
溶液中含少量的KBr及

。
解答:①加入过量的KOH溶液;②加入过量的
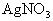
溶液;③加入过量的

溶液;④过滤;⑤加入适量的硝酸。
问题二、浓硫酸可以干燥硫化氢吗?
分析:这个问题虽然简单,但所涉及到的化学反应原理却非常典型,有关原理应用方面的问题也非常普遍。我们知道,浓硫酸的重要特性之一就是 6价硫元素具有强氧化性,而硫化氢中的-2价硫元素处于最低价态,具有较强的还原性,因而它们之间非常容易发生氧化还原反应。
结论:浓硫酸不能干燥硫化氢。由于硫元素在通常情况下有四种价态:

,根据氧化还原反应的有关原理,不同条件下,浓硫酸与硫化氢可以发生以下三种反应:
(1) 6价硫与-2价硫生成0价硫,

(2) 6价硫与-2价硫生成 4价硫,
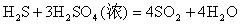
(3) 6价硫与-2价硫分别转化为 4价和0价硫,

应用:回答下列问题。
(1)漂粉精遇强酸,为什么会有氯气产生?
解答:漂粉精的主要成分为

和

,其中含有

,它们在酸性条件下可以发生氧化还原反应:
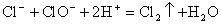
。以此类推,氯酸钾与盐酸也可以发生反应制得氯气:

。
(2)工业上为什么可以用氨气来处理含有氮氧化物的工业废气?
解答:工业废气中的氮氧化物主要是指NO和

,欲除去它们,一种有效的方法是将其转化为无毒、无公害的氮气。在一定条件下:

或

。
问题三、二氧化硫能使溴水褪色吗?
分析:

中的硫元素处于中间价态,既具有氧化性,又具有还原性。溴水中的主要溶质为

具有较强的氧化性,可以与具有还原性的

发生反应。反应结果为硫元素被氧化为最高价,生成物中有硫酸根生成。但同时也存在这样一个问题,从

到

,在书写化学方程式时,氧(原子)不够,怎么办?“氧(原子)不够,水来凑”,化学反应方程式为:

。因此,

可使溴水褪色,但我们也可以发现

不与纯溴反应。这里必须注意,溴水褪色绝不可以理解为

的漂白性作用。
结论:从

可使溴水褪色可以看出,

具有较强的还原性,它可以与多种氧化剂发生化学反应。事实正是如此,如

还可以使氯水、碘水、酸性高锰酸钾溶液等褪色。
应用:解答下列问题:
(1)

可使品红溶液褪色,
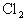
也可使品红溶液褪色,但将它们按1:1的体积比混合后通入品红溶液中,品红溶液不褪色,为什么?
解答:
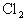
、

都具有漂白性,都能使品红溶液褪色,但当它们以1:1的体积比通入品红溶液后,便会发生如下反应:

,而生成的

与HCl都不具有漂白性,所以品红溶液不褪色。
(2)环保部门通常可以用

与

的混合溶液来检验工厂废气中是否含有

,为什么?
解答:由于

具有较强的氧化性,能将

氧化,离子方程式为:

,氧化产物

可转化为白色沉淀,离子方程式为:
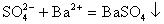
。根据产生沉淀这一现象可知,能用

的混合溶液来检验工厂废气中是否含有

。
(3)

可以使碘水褪色,有硫酸生成,浓硫酸却能与碘化氢反应生成碘,这两者是否矛盾?
解答:不矛盾。前者是因为

有还原性,生成的是稀硫酸,但后者的浓硫酸具有强氧化性,可将

氧化。
问题四、

通入到

溶液中,有沉淀产生吗?
分析:

通入到

溶液中,同学们往往会根据

与
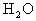
反应生成

,认为

与

反应生成

沉淀。显然,这是一种错误的理解,这种错解忽视了与

同时生成的还有盐酸,而盐酸是强酸,不可能与

同时共存。事实是,

与

溶液不发生沉淀反应。
结论:能溶于酸的沉淀是不可能与强酸同时生成的,这个结论具有较为普遍的意义。例如,向

溶液中通入
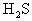
气体,向

或

溶液中通入

气体,向H3PO4溶液中滴加
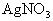
溶液,都不会产生沉淀。
应用:解答下列问题。
(1)

通入BaCl2溶液,无沉淀产生,但将

通入到

溶液中却有沉淀产生,为什么?
解答:

通入

溶液中后,由于

与水反应使溶液显酸性,而在酸性条件下,

表现出氧化性,可将

氧化为

,所以将

通入

溶液中可生成沉淀

。
(2)

通入CaCl2溶液,无沉淀产生,但将过量的

通入到饱和

溶液中却有沉淀产生,为什么?
解答:

通入到饱和

溶液中,主要发生了如下反应:

,由于

的溶解度小于

,所以会产生沉淀。
问题五、

与
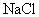
固体或
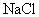
溶液共热能产生
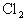
吗?
分析:实验室通常用

与浓盐酸在加热条件下反应制氯气,浓盐酸既起还原剂的作用,同时又起酸性作用,作还原剂的是
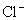
,起酸作用的是

。因此,

与NaCl相互作用,没有酸的存在是不会产生
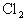
的。若在

与
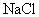
的混合固体中加入浓硫酸,则可以制出氯气。
结论:含“氧”氧化剂欲表现氧化性,一个重要的条件是必须把氧化剂中的“氧”失去,才能使表现氧化性的元素的化合价降低。因此,含“氧”氧化剂表现氧化性的条件一般有两个:一是通过高温失氧,二是在酸性条件下失氧成水,且在水溶液中,含“氧”氧化剂需要在酸性条件下才能表现出氧化性。例如,实验室通常将高锰酸钾配制成酸性溶液,又如以下几组离子不发生反应,一旦加入强酸,则反应立即发生:
(1)
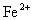
与

;(2)
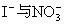
;
(3)
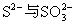
;(4)

;
(5)
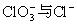
。
应用:填写下列空白。
(1)写出

与NaCl的混合固体中加入浓硫酸在加热条件下反应的化学方程式:__________________________。
解答:

(2)下列各组离子可以大量共存的有( )
A.

B.

C.

D.

解答:本题正确答案为D。选项BC,都是因为有

存在而不能大量共存,而选项A比较特殊,还原剂

可以结合氧化剂失去的氧原子使氯元素化合价降低:

,因此,

与

不能大量共存。
综上所述,解决典型问题,不能仅仅局限于问题自身的解决,要设法通过问题的解决,达到举一反三、使知识体系积累系统的目的。这既是培养思维能力与创新能力的需要,也是科学素养形成的需要,更是全面掌握知识在方法上的需要。
,




