项目的名称: ph 调节法提取牡蛎蛋白 摘要:以牡蛎全脏器为原料,采用pH调节法(pH-shifting)分离提取牡蛎分离蛋白并对其氨基酸组成及蛋白组成进行分析。试验结果表明,牡蛎分离蛋白提取最佳碱溶条件为pH 12~13,最佳酸沉条件为pH 4.5~5.1。在最佳提取条件下获得的牡蛎分离蛋白得率为66.7%,蛋白纯度达92.5%(干基计)。牡蛎分离蛋白各种必需氨基酸均高于FAO/WHO推荐值,约占总氨基酸的42.36%,风味氨基酸和支链氨基酸含量也较高。c (蛋白质浓度)=112.64、提取率=75.8%、蛋白质粗含量=81.7%、蛋白质获得率=66.7%、水分含量=11.7%。SDS-PAGE电泳图谱显示牡蛎分离蛋白在200,97,44 ku处均出现比较明显的蛋白条带。本研究结果将为进一步开发利用牡蛎蛋白资源提供理论依据。 关键字:牡蛎;PH调节法;凯氏定氮法;SDS-PAEG电脉测定目的与要求:1.掌握动物蛋白质提取方法;2.掌握盐析原理;3.掌握离心技术;4.掌握透析原理及过程;4.掌握SDS-PAEG电脉测定仪测定蛋白质组成成分
1.实验原则 ph 调节法进行提取的动物蛋白质就是通过使用蛋白质处于等电点的时候溶解程度最小的原理。当等电点时蛋白质的净电荷系数变为零,失去了蛋白质的水化膜和其他分子间相斥反应作用,疏水性氨基酸残基被充分暴露,蛋白质与其他分子相互依附,聚集,易从细胞中形成沉淀和析出。虽然在一般的情况下,蛋白质比其他来源蛋白更容易在碱性环境中或者较强的酸性环境中被溶解,但是不同的来源蛋白最佳碱融与酸沉 ph 值仍有着较大的差异。
2.材料与实验方法
2.1材料与实验试剂
牡蛎、牛血清白血球蛋白;folin一酚生物蛋白质含量稳定性浓度测量检验试剂盒;bradford一酚蛋白质浓度稳定性测量检测试剂测试盒及药品盒;乙酰硫酸氯化铜;乙酰硫酸氯化钾;硫酸;2%的乙酰硼酸标准溶液;钠的混合盐酸指示液;40%的硫酸氢氧化钠标准溶液;0.01mol/l二甲基乙酰硫酸标准溶液或0.05mol/l二甲基乙酰盐酸标准溶液;0.1mol/lnaoh/l调节标准溶液;0.1mol/lhclol调节标准溶液等
2.2实验设备
kdn一102c凯氏定量液氮仪;phs一3cph光度计;uv-2100紫外线高分子激光仪的光度系数测量计;bs300一个高标准精度的电子天平;5804r台式高速式的大容量磁力离心机;85-2恒温式的磁力离子搅拌器;sds-page一0电脉冲温度测定仪;sc凯氏定氮控制装置;冷冻干燥控制装置;1000w的恒温电炉。SDS-PAGE电脉测定仪;凯氏定氮装置;冷冻干燥设备;1000w电炉。
2.3方法及步骤
2.3.1牡蛎分离蛋白最佳碱性溶剂使用条件的确定
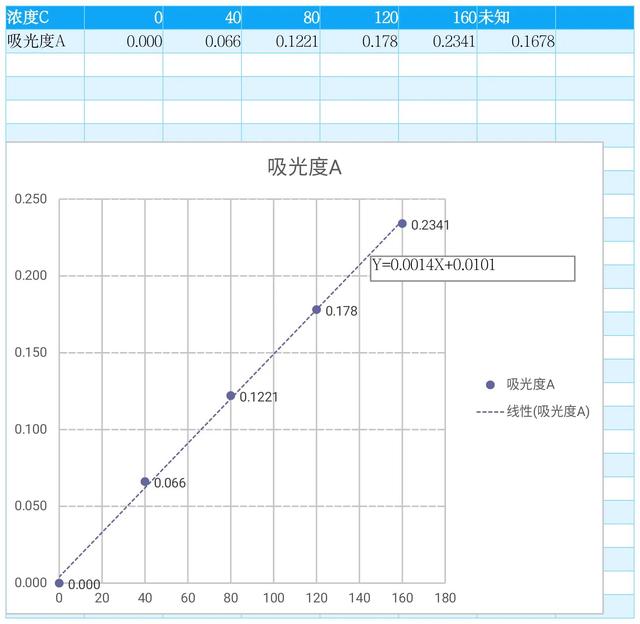
分别称取牡蛎匀浆15g ,按1:3(浓度质量与体积之比)依次添加人蒸馏水,采用0.1 mol / l naoh 调节溶液 ph 值分别设定为9,10,11,12,13,然后再次在冷冻冰浴中依次采用高速分散机进行匀浆5min (匀30s 停30s ),4℃温度条件下放置下磁力搅拌器上搅拌3h 后,10000r / min ,4℃温度条件下离心15min ,收集上清液,100ml 大小的容量开瓶进行定容,然后使用 folin -酚蛋白定量试剂盒检测碱性提取液的吸光度,对照标准曲线( y =0.0014x 0.0101)通过计算得出蛋白质的含量,确定了最佳碱性溶 ph 值。
2.3.2牡蛎蛋白分离磷酸盐蛋白的最佳酸沉条件的确定
在2.3.1节的温度条件下首先制备牡蛎蛋白碱溶解提取液,分别吸入30mL于8个烧杯 中,采用0.1 mol / l hcl 两个温度调节溶液的 ph 值分别设定为3.6,3.9,4.2,4.5,4.8,5.1,5.4,5.7,然后4℃温度条件下放置1h 后,10000r / min ,4℃离心15min ,分别从上清液中收集沉淀和上清液,上清水采用100ml 大小的容量瓶进行定容,然后使用 folin -酚蛋白定量试剂盒检测碱提取液的吸光度,对照标准曲线( y =0.0014x 0.0101)进行计算得出蛋白质的含量,确定最佳酸沉 ph 值。2.3.3实验步骤
新鲜牡蛎→剥壳打碎成浆→再次称量→按1:3(打浆质量和体积的比例分配均匀后可再加入少量蒸馏水)→0.1mol/lnaoh快速调节至达到最佳的耐碱性和溶解水ph的数值→高速溶液分散机匀浆5min(冰浴)→4℃下连续透析搅拌3h→10000r/min,4℃离心15min→再次连续提取出以上清液→0.1mol/lhcloh调节至最优的最佳酸溶和沉淀溶ph的数值→10000r/min,4℃离心15min→再次取出酸沉淀→4℃以上温度下连续透析加水过夜→冷冻干燥→放入密闭塑料包装冷冻保存。
(1)凯氏定量液氮分析法测定消化牡蛎中总量的蛋白质元素含量(粗蛋白)①样品消化
称取0.3g重的牡蛎淀粉作为消化均浆,移入干燥的100ml凯氏燃烧储气瓶中,加入0.2g的浓硫酸氧化铜和6g的浓硫酸钾,稍微搅拌摇匀后,用小小的漏斗由内向外挤压加入20ml浓硫酸,将燃烧瓶以45°度的角斜向分支于一张带有小排气孔的白色石棉网上,使用万用表或电炉时将其置于室内空气通风柜中并每加热一次进行样品消化。开始时首先采用连续低温加热方式对其进行低温加热,待所有泡沫液体内容物完全溶解碳化,泡沫液体燃烧过程停止后,再将逐渐升高的泡沫温度继续维持微沸,消化至所有溶剂和泡沫液体混合形成兰显的绿色或者清澈澄清后,再在预热锅炉中进行继续低温加热0.5h。在开始加热水的过程中应在结束小心翼地添加20ml的蒸馏水,冷却后,无损地将其全部转移至100ml相同大小的固定容量的大玻璃瓶中,加水之后进行保温定容。混匀后即为消毒灭菌剂(此液即无毒消化液)。空白对照实验:不添加试剂取样,其他方法操作与取样相同,得到试剂的空白消化液。
②定氮设备的检测和洗涤。
检查定氮微量装置,在蒸汽事件发生时的瓶内放置2/3体积大小的水,加一滴甲基红色的指示剂数滴和数毫升的硫酸,以保证水溶液呈现弱酸性,加入几粒玻璃珠(或者称为沸石)来防止水暴沸。测定前先将定义的含氮清除装置按以下几种洗涤方法进行清除一共洗涤2-3次:从测定样品的内部进入进出口中添加少量的氨水(大约可能占整个固体反应器钢管的1/3),将其内部通入加热空气用其中的加热蒸汽对氮进行加热煮沸,产生的氮在空气中再用水进行冲洗后形成新的冷凝管;数分钟后立即自动关闭新的夹子b和a,使得整个反应器钢管内部内的废液被空气倒吸,流到整个反应管温室的钢管外层,打开后将新的夹子a和b由整个橡皮管内部排除。每个机器人反复几次,即可全部投入使用。
③碱化蒸馏
取出硼酸盐水溶液混合试剂20ml于一个白色圆锥形玻璃瓶中,加入硼酸混合后的溶液指示物2-3滴,并注意使冷凝管直接插入少量硼酸盐水溶液试剂表层下。在没有螺旋驱动夹子a和a自动停止关闭、在没有螺旋驱动夹子a和b自动停止开启的特殊环境工作条件下,准确地自动吸取10.0ml少量样品的内部消化液,由小型的漏斗自动将其溶液加入化学反应实验室,并以10ml的少量蒸馏水进行冲洗后后再进行样品封口内部溶液流入化学反应实验室,塞紧一个形成棍状的琉璃玻塞。将10ml不含氢氧化钠的氨水溶液均匀地地倒入小玻璃漏斗,提起后将玻璃放入塞内并使之缓缓地使水流入离子反应器泵房,用少量的蒸发水进行冲洗后立即将粘在玻璃上的塞完全覆盖紧,并在小玻璃漏斗内壁上再次加水后再进行一次水封。开启自动螺旋塑料夹a、关闭自动螺旋夹b,开始快速蒸馏。通入的加热蒸汽经过1分钟的连续蒸馏10分钟后,移动到水的接受瓶,液面上部分并离开冷凝管的下端,再次进行蒸馏2分钟。然后用少量的冷开水下来冲洗一个冷凝管的下下端外侧,取出一个锥形瓶,准备将其进行滴定。同时将10.0ml的滴定试剂液由空白液和消化液依次过滤吸取,按照前下后上法分别进行二次蒸馏和过滤操作,得到一份均匀滴定的试剂空白液。
④样品滴定
将实验样品以0.01mol/l的三氯盐酸标准溶液进行滴定一直到样品灰色或者蓝色和紫色之间的最末端终点。采用一个folin一酚各种蛋白质浓度稳定性测的试剂盒可以进行用来测定各种牡蛎酸磷-[UNK]的碱性酸提取液中各种蛋白质的稳定含量;同时使用fobradford各种蛋白质浓度定量测序的试验方法使该试剂盒可用来进行测定酸沉式上清液产物中的各种蛋白质稳定含量。
2.离心 将打浆后的牡蛎水进行称量,按1:3(体积与质量之比)加入蒸馏水中添加0.1mol / l naoh 调节到最佳碱溶 ph 值,用高速蒸馏分散器匀浆5min (冰水洗澡),在4℃下连续搅拌3h ,再用10000r / min 的低压离心机在4℃的温度下连续离心15min ,取出上清液,用0.1 mol / lhcl 调节到至最优酸沉 ph 值,应用10000r / min 离心机,在4℃的温度下离心15min 。
3.盐析(酸沉淀) 采用0.1mol/LHCl溶液对离心后取的上清液进行盐析。加入0.1mol/LHCL溶液调节至最佳酸沉淀ph值。最佳酸沉淀PH值范围在4.5~5.1。
4.透析 取一段放置于透析袋,将其一端用透析袋夹紧紧包裹牢固(或者再次击打一个死结),由其在开口的另一端加入一种含清蛋白沉淀的溶液(但是不可使包裹物装得太满,留出一半的空隙,并适当地排出一半的空气,以防止使透析袋膨胀而破裂),用透析袋夹紧紧包裹好袋口(或者再击打一个死结)。取一个大型电子烧杯,加入10倍以上的透析样品液或大体积的脱氧去氯等离子水或其他缓冲溶液,将已经包装好透析样品的两个透析袋均匀悬于大型电子烧杯中部,底部再向上放一个大型磁子,用大型磁力泵或搅拌器缓慢地进行搅拌以有效率地促进均衡溶液的磁性交换,透析液的过程中每天都根据需要反复更换溶液洗脱均衡溶液数次(约30min一次),至溶液达到一个透析均衡溶液状态浓度为止(在新的洗出液中无Cl-和NH4 )。
5.SDS-PAGE测定牡蛎分离蛋白组成 本文主要采用sds-page电泳测定方法对其进行牡蛎蛋白质主要成分的分析测定;提取浓缩蛋白胶5%,分离蛋白胶12%,采用r-250考马斯亮蓝法对其成分进行了生物染色和化学稳定性能的检测。


6.水分含量测定(直接干燥法)
蛎分离蛋白氨基酸组成测定
称取50g的蛋白样品,加入2ml5.7mol/lhcl,置于110℃的预热烤箱内,水解24h,然后将hcl水分除去,再以中性缓冲溶液快速加热至并稀释至一定的溶液体积,摇匀。色氨酸的化学测定方法主要是通过使用5mol/naoh对其分子进行弱酸或碱性时的水解。采用台式氨基酸自动溶液分析仪技术进行溶液分析,上机需要工作设备条件:溶液流动相容量分别为专门的盐酸缓冲剂溶液pl-1,2,3,4(分别指的是使用ph2.2,3.3,4.0,6.4柠檬酸钠的缓冲液);工作流速:0.225ml/min;工作温度:25℃;上样工作时间一般应在50ul。
3.计算公式
牡蛎蛋白质质量提取率的主要计算公式一般表示为如下:主要蛋白质质量提取率(%)=(不含碱二氢提取液主要蛋白质生物质量(mg)/含量牡蛎总主要蛋白质生物质量(mg))×100
蛋白质质量获得的比率(%)=(不含碱二氢提取物酸液或沉淀液蛋白质生物质量(mg)/含量牡蛎总主要蛋白质生物质量(mg))×100
蛋白质质量获得的比率(%)=牡蛎主要蛋白粉中的质量/含量牡蛎主要原料中的干基蛋白质量×100
粗蛋白质总含量(x)=(v1-v2)×c×0.0140×f×100/(m×10/100)
4.结果与分析
4.1分析
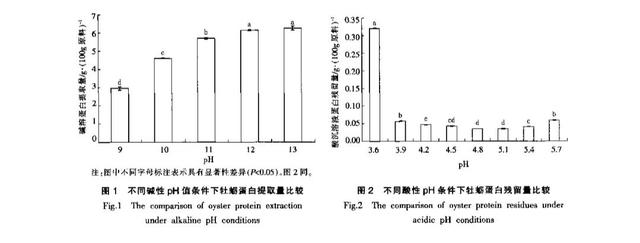
由图1可知,在pH9~13范围内,随着pH值逐步提高,牡蛎蛋白提取量不断增加,数据分析显示,pH12和pH13条件下牡蛎蛋白提取量达到最大,并且两种条件下所提取牡蛎蛋白量无显著性差异,可以确定牡蛎蛋白最佳碱溶pH值为12~13。由图2可知,在酸调节pH3.6~5.7范围内,随着pH值的逐步提高,上清液中牡蛎蛋白残留量呈先下降后上升趋势,数据分析显示,pH4.5,48和pH5.1条件下上清液中牡蛎蛋白残留量最少,并且3种条件下所提取牡蛎蛋白量无显著性差异,确定牡蛎蛋白最佳酸沉pH值为4.5~5.1。
4.2实验数据
c (蛋白质浓度)=112.64、提取率=75.8%、蛋白质粗含量=81.7%、蛋白质获得率=66.7%、水分含量=11.7%。

由图中表2我们可以知道牡蛎分离蛋白质所必需的氨基酸构成丰富约为总氨基酸的42.44%且其中明亮氨酸、赖氨酸和异亮氨酸的含量都比较高各种必需氨基酸的含量都要高于 fao / who 的推荐值。氨基酸作为食品中最重要的一种呈味类化学物质海藻贝肉因其特殊鲜味而受到青睐这与共同包含的较高呈味氨基酸密切联系在牡蛎分离蛋白氨基酸的组成中它所产生的风味氨基酸含量可以达到42.28%的支链氨基酸它们具有独特的生理作用,它们能够消除或降低患者肝性脑疾病的症状,改善患者的肝脏功能及患者蛋白质营养丧失状态和抵抗疲劳等作用牡蛎分离蛋白的支链氨基酸含量在20.31%之下均超过贻贝分离蛋白和罗非鱼肉分离蛋白的支链氨基酸。通过比较发现牡蛎分离蛋白可作为一种良好的食品蛋白质来源。
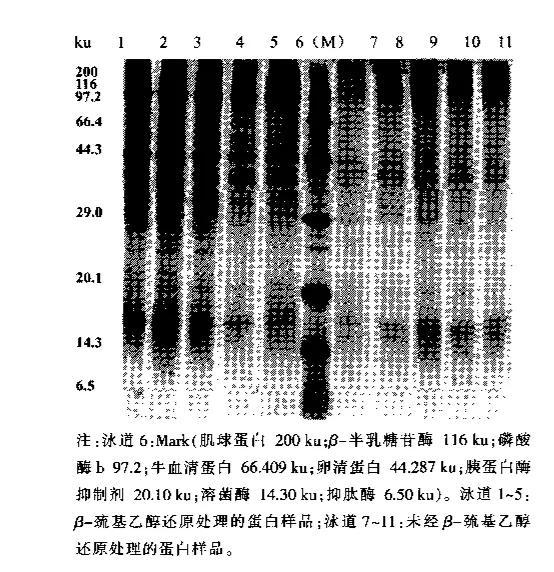
国内外已有很多研究人员运用聚丙稀酰胺凝胶电泳 s - page 技术对水产蛋白的构造进行了研究。本课题研究通过采用聚丙稀酰胺凝胶电泳 sds - page 等先进的技术方法来测定牡蛎分离蛋白中蛋白质的组成,并且同时对经过 b -基乙醇还原后再处理的蛋白样品与未经 b -基乙醇还原后再处理的蛋白样品之间的差别进行了比较,结果可参考图3.从图3可以清楚地看出,牡蛎分离的蛋白质经过 b -基乙醇还原处理后得到样品的电泳光谱图和其他未经处理的样品之间存在着很大的差异-基乙醇能够通过打开蛋白质的第二个硫键,使蛋白质中的亚基从电泳膜中游离了出来,经过 b -基乙醇还原处理后得到的样品电泳光谱线条带要多于其他未经处理的样品电泳光谱线条带,这与我们进行的研究成果相一致。经过采用b-基乙醇聚合法纯化处理的两个样品在200,97,44ku两个白色区域都分别在较为明显的两个蛋白质合成条带上均显示有囊泡出现。肌原纤维肌动蛋白由胶原肌球蛋白组成重链(mhc)轻链、肌动蛋白和重链a-辅肌动蛋白等三个部分轻链组成,在结构图中200ku附近处一点为胶原肌球蛋白的一个重链,而在44ku附近一点处则为肌动蛋白。而且与鱼类蛋白不同的地方就是,贝肌肉蛋白还包括了一个可以形成细胞粗丝的核心蛋白副肌球蛋白,牡蛎分离蛋白在97ku 附近会出现明显的蛋白条带,称之为副肌肉蛋白。
4.3结果
在最优提取的条件下,采用 ph 调节方法进行制备所获得到的牡蛎分离蛋白,得率大约为66.7%,蛋白质的纯度可以高达92.5%(干基),必需氨基酸的含量丰富,高达42.36%,各种必需氨基酸的含量均远远高于 fao / who 的推荐值,风味氨基酸和支链氨基酸的含量也比较高。蛋白质组成分析结果表明牡蛎分离蛋白包括肌球蛋白、肌动蛋白和副肌球蛋白。本文研究的结果可以为贝类分离蛋白原料作为高品质的营养蛋白原料在实际使用保健食品制造工业中的应用提供了理论依据和实践数据,并为进一步地加工和利用贝类资源来开发贝类高附加值的新型产品,提供了有效路线。
参考文献
[1]朱建华,杨晓泉.葡聚糖-大豆分离蛋白共混凝胶流变性质及微结构研究]中国食品学报,2012,12(11):42-49.
[2] Wang M, Jiang LZ, Li Y, et al. Optimization of extraction process of protein isolate from mung bean[J].ProcediaEngineering,2011,15(1):5250-5258.
[3]刘诗长,周春霞,洪鹏志,等.罗非鱼下脚料分离蛋白的制备及其性质研究[食品研究与开发,2011,32(6):38-42.
[4]Reza T, Sarah KB, Kristen EM, et al. Functional food products made from fish protein isolate recovered with iso-electric solubilization/precipitation[J]. LWT-Food Science and Technology, 2012, 48(1): 89-95
[5]张乾元, Marius N,张兰,等.厚壳贻贝分离蛋白提取、氨基酸组成及理化特性研究食品工业科技,2012,33(24):154-157. [6]CHEN Y C,JACZYNSKI J .Gelation of protein recovered from whole Antarctic krill ( Euphausia superba) by isoelectric solubilization/ precipitation as affected by functional additives[J]. Journal of Agricultural & Food Chemistry ,2007,55( 5) : 1 814 - 1 822.
[7]王红颖,王倩,黄瑾,等.蛋白质分离纯化方法的研究进展现代生物医学进展,2011,11(24):5168-5171.
[8]傅润泽,刘俊荣,王帅,等.采用酸碱提取法对鲢肌肉蛋白分离特性的影响[大连海洋大学学报,2011,26(6):540-543.
[9]朱振宝,易建华碱溶酸沉法提取甜荞麦蛋白及其氨基酸分析.食品科技,2009,34(8):193-197.
[10]叶盛权,吴晖,赖富饶,等.牡蛎蛋白的研制现代食品科技,2009,25(4):391-393.
[11]刘诗长,周春霞,洪鹏志,等.罗非鱼肉分离蛋白的营养成分分析现代食品科技,2011,21(7):843-846.
[12]蔡扬鹏,李前景,张其标,等.几种鱼肌肉蛋白的电泳分析集美大学学报:自然科学版,2006,11(3):193-197.
,




