5.1弱酸弱碱溶液
上一节讲了不同的酸碱理论(这一章重点用到酸碱质子理论)和pH值的定义及计算。这一节我们讲在弱酸弱碱中的解离平衡
5.1.3弱酸弱碱的解离平衡与解离常数
5.1.3.1电解质:强电解质、弱电解质
强电解质:在水溶液中(或者熔融状态下)完全电离的电解质,在溶液中完全以离子的形式存在
例:强酸(HCl、H2SO4、HNO3等)/强碱(NaOH、Ba(OH)2等)/盐类(NaCl、KNO3等)
不考虑溶解度大小,只要溶解的那部分完全电离就是强电解质,比如BaSO4,其溶解度极小,但溶解的那部分是以钡离子和硫酸根离子的形式存在,它也是强电解质。
弱电解质:在水溶液中(或者熔融状态下)部分电离的电解质,在溶液中分子和离子共存的形式存在
例:弱酸(HF、HClO、HAc等)/弱碱(NH3·H2O等)/H2O
5.1.3.2解离平衡
除少数强酸、强碱外,大多数酸和碱溶液都存在解离平衡,其平衡常数称为解离常数Ka或Kb,其值可由热力学数据求算,也可由实验测定。
以一元弱酸为例

解离平衡常数是标准平衡常数的一个特例
对Ka值进行求对数,得到的数值叫做pKa,pKa=-lgKa(和pH的定义很像),并且依据pKa值的大小把酸分为强酸、中强酸(中等强度的酸,简写为:中强酸)和弱酸三种。一般认为Ka值大于4的,是弱酸;一般认为Ka值小于4但大于1的,是中强酸;一般认为Ka值小于1的,是强酸
碱也是相同的分类,不同的是它使用的Kb和pKb
5.1.3.3解离度与离子浓度计算
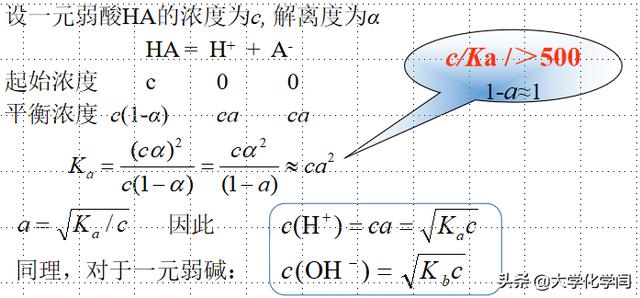
不同教材里,出于对误差率要求不同的原因,对c/Ka值的范围要求也不同
解离度和浓度、解离平衡常数之间的关系式是最常用的公式,但在使用前要区分是酸还是碱。
溶液的酸度(H 离子浓度)常用pH值表示, pH=-lg[c(H ) /cө]
溶液的碱度(OHˉ离子浓度)可用pOH表示。
解离度: α=弱电解质已解离浓度/弱电解质解离前的浓度×100%
举例如下:例1

弱酸的解离平衡
例2

熟练了之后可以直接套用公式
共轭酸碱对之间的解离常数

共轭酸碱对之间的解离平衡常数之间的关系
比如上例中,铵离子的Ka值是5.65*10-10(5.65乘以10的-10次方),铵离子的共轭碱是NH3,那么NH3的pKb值是1*10-14/5.65*10-10=1.77*10-5
5.1.3.4解离平衡常数也是一种平衡,可以用热力学方式求解
弱酸弱碱的解离平衡常数是特殊的标准平衡常数,所以关于标准平衡常数的知识在这里都可以使用

5.1.3.5多元弱酸弱碱的解离
多元酸:在水溶液中,可以给出2个或者2个以上的H ,就此成为多元酸
H2S,H2CO3,H3PO4等
多元酸的解离特点:分步进行

如果Ka1/Ka2>500以上,在求解pH值的时候,可以不考虑其第二步解离。如果是求解其他值,能否忽略第二步解离要看具体情况。
下一节讲弱酸弱碱平衡中的同离子效应和缓冲溶液
,




