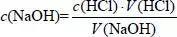1.下列不能说明氯元素比硫元素的非金属性强的有( )
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强 ③沸点:H2S>HCl ④Cl原子最外层有7个电子,S原子最外层有6个电子 ⑤Cl2与Fe反应生成FeCl3,S与Fe生成FeS ⑥HCl的酸性比H2S的酸性强 ⑦Cl2能与H2S反应生成S ⑧S2Cl2中元素的化合价
A.7项 B.6项 C.5项 D.4项
2.(2019·郑州模拟)已知34Se、35Br位于同一周期,根据元素在周期表中的位置,下列说法正确的是( )
A.还原性:Cl->Br-
B.酸性:H2SeO4>HBrO4>HClO4
C.原子半径:Cl>Br>Se
D.气态氢化物的稳定性:H2S>H2Se
3.下列实验不能达到实验目的的是( )
|
选项 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
向MgCl2、AlCl3溶液中分别通入氨 |
比较镁、铝的金属性强弱 |
|
C |
测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
Fe、Cu分别与稀盐酸反应 |
比较铁、铜的金属性强弱 |
4.下列事实不能作为元素金属性和非金属性判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C.酸性:H2CO3<H2SO4,判断硫与碳的非金属活动性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱
5.(2020·全国高三单元测试)短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是( )

A.甲一定是金属元素
B.庚的最高价氧化物对应水化物的酸性最强
C.乙、丙、丁的最高价氧化物对应的水化物可以相互反应
D.气态氢化物的稳定性:庚>己>戊
6.(2019·江西丰城九中高三期中)X、Y、Z为三种单质。已知Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物的水溶液中置换出来。由此可以推断下列说法中可能正确的是( )
①单质的氧化性:Y>Z>X ②单质的还原性:Y>Z>X
③对应离子的氧化性:X>Z>Y ④对应离子的还原性:X>Z>Y
A.① B.②③
C.①④ D.①②③④
7.(2020·成都附属实验学校月考)W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Y同族,X和Z同族,X的简单离子和Y的简单离子具有相同的电子层结构,W和X、Z均能形成共价化合物,W和X、Y分别形成的化合物溶于水均呈碱性。下列说法错误的是( )
A.4种元素中Y的金属性最强
B.最高价氧化物对应的水化物的酸性:Z>X
C.简单阳离子氧化性:W>Y
D.W和Y形成的化合物与水反应能生成一种还原性气体
8.(2021·河北定州一中高三月考)某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入足量的0.1 mol·L-1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式:____________________________________________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?______,并说明理由:________________________________________________________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_______________________________________________________________。
(4)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加Na2SiO3,观察到C中的实验现象为有白色沉淀物生成。离子方程式为__________________________
__________________________________________________(假设所通气体是过量的)。
,