
Melflufen于2021年2月26日被美国食品药品监督管理局(FDA)批准与地塞米松联联合用于成年复发难治性多发性骨髓瘤(RRMM)患者的治疗。接下来跟小编一起来了解一下《Drug Design, Development and Therapy》上发表的一篇有关骨髓瘤新兴疗法的综述——聚焦melflufen:一种治疗骨髓瘤的新兴疗法,文中介绍了melflufen的化学成分、药代动力学、作用机制、临床前和临床进展。
研究背景
MM的治疗一直在不断改进,越来越多有效新药被研发出来并被纳入当下MM的治疗。Melphalan (L-PAM)是半个多世纪前开发的一种有效治疗MM药物,随着时间的推移人们对其了解增多。各种药物中,L-PAM仍然是MM治疗的原型药,在缓解疾病方面有很好的效果,对疾病的进展没有任何影响。由于L-PAM可增加肿瘤细胞死亡,影响肿瘤耐药,随后开发了大剂量L-PAM静脉制剂。虽然一些研究成果(例如深层应答)使人们对符合移植条件的新诊断MM患者是否强制给予ASCT产生顾虑,但对于符合移植条件的MM患者来说,高剂量L-PAM仍然是ASCT的标准治疗方案。
Melflufen是一种比L-PAM更有效的抗肿瘤新药,其烷基化能力与L-PAM相同。Melflufen是一种首创的肽偶联药物(PDC),具有良好的亲脂性,可以轻松进入肿瘤细胞并靶向细胞内的氨肽酶,提高骨髓瘤细胞的杀伤力,从而具有比L-PAM更高的成本效益,并很好地满足既往使用过/耐L-PAM37或不同类别新药的MM患者治疗需求。
药理学和药代动力学
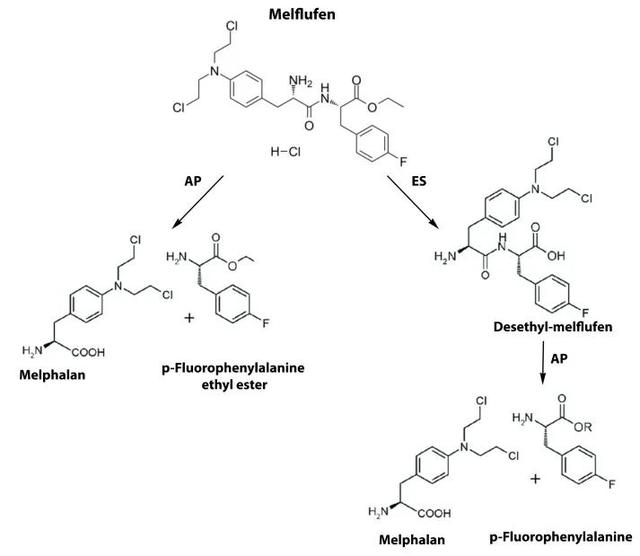
Melflufen(曾命名为J1)是一种二肽的乙酯,由烷基化合物L-PAM和4-氟-L-苯丙氨酸组成(图1)。L-PAM通过在DNA鸟嘌呤碱基上进行烷基化,诱导DNA组分之间的异常连接,导致DNA断裂,最终抑制其合成。由于L-PAM的亲水性导致其不能轻易进入细胞膜,限制了其充分发挥抗肿瘤作用的潜力。相反,melflufen由于具有高亲脂性,能快速渗透癌细胞,并能水解氨肽酶,能有效地诱导L-PAM的细胞内捕获,其细胞毒性IC50值大大低于L-PAM。与早期抑制氨肽酶的疗法不同,melflufen利用增加MM细胞中的氨肽酶活性,选择性地将烷基导入肿瘤细胞。
在一项针对癌症患者的I-II期研究中,29名患者接受了50个周期的melflufen治疗,剂量范围25毫克-130毫克。静脉给药后,melflufen很快从外周血中消除。Melflufen的峰值浓度通常是在药物输注结束前检测到的,而L-PAM的Tmax基本上是在melflufen输注结束后5-15分钟发生。Cmax和AUC显示,在注射0-0.5 h内,melflufen向melphalan快速转化。melflufen输注结束后,melphalan血药浓度持续增加达10分钟。
临床前研究
将melflufen对多种肿瘤细胞株进行活性测试,实体和血液肿瘤细胞的半数抑制浓度(IC50)总平均值为0.41 uM, 远低于L-PAM (18 uM)。耐药肿瘤细胞系的体外研究表明melflufen的有效性比L-PAM大约提高了300倍。对原发肿瘤细胞进行体外研究,melflufen对乳腺癌、卵巢癌和非小细胞肺癌样本比肾癌和结肠癌样本更容易产生细胞毒性效应。同样,L-PAM IC-50的总体平均水平也显著提高。在骨肉瘤细胞中,melflufen的细胞毒性效应与氨肽酶活性水平之间存在明显的相关性。Melflufen在甲氨蝶呤或依托泊苷耐药的骨肉瘤细胞中也被证明具有更强的细胞毒活性,这证实了melflufen在去除化学耐药瘤变中的潜在用途。多柔比星能够上调氨肽酶的表达,与melflufen的细胞毒活性产生协同作用,这可以作为支持多柔比星与melflufen联合化疗的理论基础。
考虑到L-PAM在治疗多发性骨髓瘤中不可置疑的作用,本研究转移到骨髓瘤细胞上。首先,在MM细胞系中建立了氨肽酶的活性以及随后氨肽酶依赖的melflufen卵裂。其次,研究表明,骨髓瘤细胞株RPMI-8226和阿霉素耐药细胞株的L-PAM耐药亚克隆对melflufen的敏感性分别提高了10倍和2.5倍,这是由于L-PAM累积和暴露。Melflufen克服L-PAM耐药机制的方式尚未完全阐明。第三,melflufen抑制血管内皮生长因子诱导的骨髓瘤细胞迁移。最后,利用人浆细胞瘤MM.1S异种移植小鼠模型对melflufen的体内药效进行实验,结果显示melflufen显著抑制了骨髓瘤生长,从而延长小鼠生存期。
这些体外和体内的临床前研究报告表明,melflufen可以诱导更快、更强、永久性的DNA损伤,从而克服MM细胞对L-PAM的耐药性。综上所述,melflufen可以与常用的抗骨髓瘤药物(如来那度胺、硼替佐米和地塞米松)产生协同作用,这为临床试验铺平了道路。
临床研究
首次人体I/II期临床试验
一项前瞻性、首次在人体内进行的剂量探索I/IIa期研究,设计用于晚期和进行性肿瘤患者,主要是乳腺癌、卵巢癌淋巴瘤和肺癌。临床I期试验中,在45例患者中用melflufen进行6个周期每三周一次的30分钟静脉输液来确定II期试验中melflufen的推荐剂量,II期试验的目的是评估melflufen的安全性及药动学特征,以及肿瘤反应结果。在25mg和50 mg时没有观察到剂量限制性毒性,而在高剂量时,可逆性中性粒细胞减少和血小板减少是主要的剂量限制性毒性,在重度治疗患者中更为显著。因此,II期最终的推荐剂量为50mg。每三周给癌症患者服用50mg melflufen是安全的,其毒性与烷基化剂相似。
多发性骨髓瘤的临床试验
表1显示了使用melflufen治疗RRMM患者的主要发表试验。

O-12-M1 试验
O-12-M1 (NCT01897714)是一项开放标签、多中心、国际I/II期研究,旨在确定melflufen联合地塞米松的剂量和给药方案,并评估后线治疗难治性RRMM患者的反应。该试验纳入了75名既往治疗过的MM患者。
在I期试验中,每周分为4个剂量水平(15,25,40,55mg)静脉输注melflufen 30分钟,同时口服地塞米松40mg,每周期为21天。由于6例接受55mg剂量的患者中有4例出现4级剂量限制性血液毒性,故推荐剂量为40 mg。在II期试验中,共纳入58例患者;45例患者在每个周期的第1天接受40 mg melflufen 每周一次40 mg地塞米松的治疗,每周期为21天,13例患者在每个周期的第1天接受melflufen单药40 mg 的治疗。
将28例(62%)患者纳入联用队列,数据安全监测委员会修订了方案,将周期长度增加到28天,以允许周期之间的血液学恢复。随后17例(38%)患者接受28天周期的治疗。ORR[≥部分缓解(PR)]为31%(14/45例),中位缓解持续时间(DOR)为8.4个月。在接受>2剂(14/34例)研究治疗的患者中,ORR为41%。仅接受melflufen患者的ORR为8%。中位随访时间为27.9个月, DOR为8.4个月,中位无进展生存期(PFS)为5.7个月,中位总生存期(OS)为20.7个月。在随后的分析中,中位随访时间为46个月,中位OS为20.7个月,至后续(二线)治疗时间为7.9个月。最常见的不良事件(AEs)是血小板减少(73%)、中性粒细胞减少(69%)、贫血(64%)、发热(40%)和虚弱(31%)。38%的患者发生严重AEs (SAEs);最常见的SAE为肺炎(11%)。最常见的melflufen 相关3/4级AEs是血小板减少(58%)和中性粒细胞减少(58%)。因此,在既往治疗过的MM患者中,melflufen联用地塞米松是可管理的。
HORIZON (OP-106) 试验
HORIZON (OP-106)是一项关键的单臂、多中心、II期研究,旨在评估melflufen联用地塞米松对泊马度胺和/或抗CD38单克隆抗体难治RRMM患者的疗效和安全性。患者在每周期(28天)的第1天静脉滴注40mg melflufen ,口服地塞米松。共纳入157名患者。中位年龄为65岁; 中位既往治疗线数为5。157例患者中有119例(75.8%)为三重难治性患者,97%为后线难治性患者。总ORR为29%,三重难治性患者的ORR为26%,中位随访14个月,DOT、中位PFS和中位OS分别为5.5个月、4.2个月和11.6个月。最常见的3/4级急性AE是血液学事件:中性粒细胞减少(79%)、血小板减少(76%)和贫血(43%),而最常见的3/4级非血液学急性AE是肺炎(10%)。
该试验以及O-12-M1试验证实了melflufen和地塞米松联合治疗既往治疗RRMM患者的临床疗效和可管理的安全性,包括那些三重难治性患者。
ANCHOR 试验 (OP-104)
基于达雷妥尤单抗和硼替佐米对melflufen的作用机制不重叠的假设,设计了ANCHOR试验(OP-104;NCT03481556)。这项I/II期试验研究了melflufen、地塞米松联合达雷妥尤单抗或硼替佐米在RRMM患者中的安全性和有效性。符合条件的患者必须是IMiD和/或蛋白酶体抑制剂难治性患者(仅适用于达雷妥尤单抗组的患者),并且既往接受过1-4线治疗。被分配到达雷妥尤单抗组的患者既往未接受过抗CD38单抗治疗。在每个周期(28天)的第1天静脉注射melflufen,剂量为30或40毫克。蛋白酶体抑制剂组中,在第1、4、8、11天皮下注射硼替佐米1.3 mg/m2和地塞米松20 mg(≥75岁患者为12 mg) ,在第15和22天皮下注射地塞米松40mg(≥75岁患者为20mg)。达雷妥尤单抗组中,以16 mg/kg的剂量每周静脉注射达雷妥尤单抗(8剂),随后每2周注射一次(8剂),最后每4周注射一次并联合每周40mg地塞米松(≥75岁患者为20mg)。在43例入组患者中,10例患者接受melflufen (30 mg, n=3;40 mg, n=7)联合硼替佐米和地塞米松治疗,33例患者接受melflufen (30 mg, n=6;40mg, n=27)联合达雷妥尤单抗和地塞米松治疗。
硼替佐米组的10例患者中位年龄为71岁,中位既往治疗线数为2.5。40%的患者具有高危细胞遗传;70%为后线治疗难治性患者,30%的患者接受了ASCT。未观察到剂量限制性毒性。ORR为60%,3例患者达到VGPR, 3例患者达到PR,未报道PFS数据。最常见的3/4级治疗相关AE是临床可管理的血液学事件:血小板减少(80%)、中性粒细胞减少(60%)和贫血(40%),而3/4级非血液学治疗相关AE不常见。6例(60%)患者观察到严重的治疗相关AEs,最常见的是肺炎(20%)。
达雷妥尤单抗组的33例患者中位年龄为64岁,中位既往治疗线数为2。42%的患者表现出高危细胞遗传;61%为后线治疗难治性患者,79%的患者接受了ASCT治疗。没有剂量限制性毒性报告。ORR为70%,其中1例达到严格的完全缓解,1例达到完全缓解,10例达到非常好的部分缓解(VGPR),11例达到PR。中位随访时间为11.9个月,中位PFS为11.5个月(95% CI, 6.7-未达到[NR])。DOR为12.5个月(95% CI, 8.3-NR)。最常见的3/4级治疗相关AE是血液学事件:中性粒细胞减少(58%)、血小板减少(55%)和贫血(24%),而3/4级非血液学治疗相关AE不常见。在20例(36%)患者中观察到严重的治疗相关AEs,最常见的是感染性疾病。流感占9%,肺炎、副流感病毒感染和发热性中性粒细胞减少各占6%。这些初步结果表明,这两种三联疗法在既往治疗过RRMM中都具有令人鼓舞的抗肿瘤活性,且耐受性良好。
附加临床试验
OCEAN 试验
OCEAN试验(OP-103;NCT03151811)是一项随机、头对头、优势、开放标签的全球III期研究,旨在评估melflufen 地塞米松与泊马度胺 地塞米松对既往接受过2-4线治疗且来那度胺和后线治疗难治RRMM患者的安全性和有效性。第一个参与者在2017年6月被随机分配到这项试验研究中。该研究预计将于2022年3月完成。在2021年5月,一份新闻稿宣布,根据独立审查委员会评估,melflufen在PFS的主要终点上不劣于泊马度胺, 其风险比为0.817。Melflufen的ORR为32.1%,而泊马度胺为26.5%。Melflufen的安全性与既往研究一致,两种方案由AEs导致的停药率相似。
BRIDGE 试验
BRIDGE (OP-107; NCT03639610)是一项多中心、II期试验,旨在评估melflufen联合地塞米松治疗RRMM患者的药代动力学、安全性和有效性。纳入标准的患者必须接受过至少2线治疗并伴有肾功能损害,肌酐清除率在30 mL/min-45 mL/min之间的患者被分配到队列1, 15mL/min - 30 mL/min之间的患者被分配到队列2。该研究于2018年8月开始,一共纳入25名患者。最后一名患者预计将于2021年3月登记。由于肾功能损害是MM患者的常见并发症,BRIDGE研究将证明melflufen在肾功能不全RRMM患者中的应用情况。
LIGHTHOUSE 试验
LIGHTHOUSE (OP-108)是一项多中心、随机、开放标签的3期研究,比较了melflufen和地塞米松联合达雷妥尤单抗皮下制剂和达雷妥尤单抗皮下制剂在双重IMiD和PI难治性(或不耐受)或接受过包括IMiD和PI≥3线既往治疗RRMM患者中的疗效和安全性。该试验旨在证实ANCHOR研究的初步结果,即melflufen、达雷妥尤单抗和地塞米松在与达雷妥尤单抗单药治疗适应症特征相似的RRMM患者中存在相关性。
安全性和耐受性
由于MM疾病和既往治疗的副作用,RRMM患者的骨髓储备减少,melflufen治疗期间的血液毒性是最常见的。Melflufen治疗后最常见的毒性是血细胞减少,建议进行监测、并提供适当的管理和支持护理,包括生长因子支持和输血。虽然melflufen是烷基化剂依赖的作用机制,但似乎不引起脱发和临床上显著的黏膜炎。
监管状态
2021年2月,美国FDA批准melflufen联合地塞米松治疗既往至少4线治疗和至少1种蛋白酶体抑制剂、1种免疫调节剂和1种抗CD-38单克隆抗体治疗的成人RRMM。2021年4月,向欧洲药品管理局提交了melflufen在欧洲上市许可的申请。
结论
虽然患者和血液学专家都在致力于解决有效治疗方案的便利性,但MM的异质性仍然带来了不少挑战。尽管治疗方案不断改善,仍有部分患者出现治疗反应缩短、复发、总生存期缩短。大多数可能是三重难治患者,已经给予了三联或四联有效药物治疗。FDA已经批准melflufen联合地塞米松用于RRMM患者的治疗,这些患者已经既往接受了至少4线治疗,并且至少有一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38单克隆抗体难治性。其他联合治疗方案,如硼替佐米和达雷妥尤单抗(ANCHOR试验)的联合治疗效果显著,后续的试验(LIGHTHOUSE试验或OCEAN试验)正在进行中,以验证有临床意义的有效结果以及安全性。Melflufen未发生脱发和临床上显著的黏膜炎,且感染率低。最终,Melflufen可以被加入新疗法的名单。
参考文献:
1.Morabito F, et al. Spotlight on Melphalan Flufenamide: An Up-and-Coming Therapy for the Treatment of Myeloma. Drug Des Devel Ther. 2021 Jul 8;15:2969-2978.
,




