可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 S—32 Cl—35.5 K—39 Fe—56 Cu—64
第I卷(选择题 共48分)
一、选择题(本题共16小题,每小题3分,共48分。在每小题列出的四个选项中,只有一个选项是最符合题目要求的。)
1. 曾有报道,科学家用有机分子和球形笼状分子C60制成了只有3至4纳米见方的“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是 ( )

A.这种“纳米车”在高温下也不会燃烧
B.这种“纳米车”内一定含有共价键
C.“纳米车”的“零件”之一C60是一种新原子
D.“纳米车”的硬度比金刚石还大
1.B 用一个有机分子和4个球形笼状分子“组装”而成的“纳米车”是一种分子,属于分子晶体,硬度小于原子晶体金刚石;其“组装”材料有机分子和C60均具有可燃性、内部以共价键结合在一起。
2.学习了元素周期表,“类推”也就成了同学们常见的一种学习方法,但不小心有时会产生错误的结论,下列类推结论中正确的是( )
A.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;
则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性序是:HF>H2O>NH3;
则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.极性分子中必含有极性键;则非极性分子中必含有非极性键
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
2.B NH3分子间含有氢键,沸点反常的高,CH4分子中仅含有极性键但是非极性分子,SiO2是原子晶体。
3. 禽流感病毒一种极易传染的病毒,作用于该病毒的药物是根据神经氨酸苷酶N2 和N9的晶体结构设计的。现在, N4 和N8的结构也已经确定。其中N4分子的结构与白磷相似,一个N4分子中的四个氮原子位于正四面体的四个顶点。下列说法中正确的是
A.N4的熔点高于白磷
B.N2 、N4 、N8、 N9的分子内均含有共价键
C.N4稳定性比白磷差
D.N4属于原子晶体
3.B N2 、N4 、N8、 N9均为分子晶体,分子内各原子以共价键结合;由于N4和白磷均为分子晶体且二者结构相似,白磷的相对分子质量大于N4,故N4的熔点低于白磷。
4.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

下列叙述中正确的是
A.字母i所代表的元素在常温下形成的晶体硬度很大
B.字母a、c、d、h所代表的元素形成的单质可能都是电的良导体
C.b与j形成的化合物中不可能含有非极性键
D.上表14种元素中m元素失去核外第1个电子需要的能量最少
4.B 字母i(P元素)所代表的元素在常温下形成分子晶体,b与j形成的H2O2中含有非极性键,m(Ar元素)最外层已达稳定结构,失去核外电子需要的能量最多。
5.短周期元素M、R为两种主族元素,已知M2-离子与R+离子核外电子数之和为20,下列说法正确的是
A.若M在第3周期,则R一定在第2周期
B.只由M、R形成的化合物中一定只有离子键而没有共价键
C.M2-可能比R+的离子半径小
D.R元素形成的晶体内一定含有阴、阳离子
5.A 符合条件的有:O2-与Na ,S2-与Li ,Na2O2中既有离子键又有共价键,金属晶体由金属阳离子和自由电子组成。
6. 结构复合材料主要作为承力结构使用的材料,如碳氮化合物材料。用激光将置于铁室中石墨靶上的碳原子炸松,同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜,这种化合物比金刚石更坚硬,其原因可能是
A、碳、氮原子构成网状结构的晶体 B、碳、氮的单质化学性质均不活泼
C、碳、氮原子构成层状结构的晶体 D、氮原于最外层电子数比碳原于多
6. A碳氮化合物构成网状结构的晶体,而且化合物中碳氮键比金刚石中的碳碳键更短,键能更大。
7.近年来研制的NF3气体可用作氟化氚(TF)高能化学激光器中的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3 3F2=NF3 3NH4F。 下列说法不正确的是 A.NF3的形成过程用电子式可表示为:

B.在上述制取NF3的反应中,还原产物为NF3 C.NF3分子为极性分子
D.NH4F中既有离子键又有极性共价键
7.B 在反应4NH3 3F2=NF3 3NH4F 中,还原产物为NF3和NH4F。
8.下列说法中正确的是
A.某元素的离子外层电子数与次外层电子数相同,该元素一定位于第三周期
B.已知硫化羰(化学式为COS)结构与CO2相似,分子中所有原子最外层均满足8电子结构,则硫化羰的结构式为S=C=O
C.食盐和蔗糖熔化所克服的微粒间的相互作用属于同种类型
D.同一主族元素的最高价氧化物,所含的化学键类型相同
8、B A中可举反例K+、Ca2 ;食盐熔化克服的是离子键,蔗糖熔化克服的是分子间作用力;同一主族元素的最高价氧化物,如:H2O和Na2O,化学键类型不一定相同。
9. 元素A、B位于周期表中短周期,原子序数依次增大且相差8,下列有关判断错误的是
A. A、B一定位于同一主族 B. A、B可能形成分子晶体AB
C. A、B可能形成原子晶体AB D. A、B可能形成分子晶体AB3
9. A 短周期中原子序数相差8的两种元素不一定位于同一主族:氢和氟,二者可形成分子晶体HF,A错、B对;符合条件的碳和硅可形成原子晶体SiC,C对;符合条件的氧和硫可形成分子晶体SO3,D对。
10. 富勒烯由于特殊的结构和性质,在超导、磁性、光学、催化、材料及生物等方面表现出优异的性能,得到广泛的应用。厦门大学郑兰荪院士合成了C50Cl10分子(如图)。有关C50Cl10的说法不正确的是( )


A.C50Cl10与C60互为同素异形体
B.C50Cl10属于分子晶体
C.C50Cl10相对分子质量为955
D.C50Cl10的熔点一定低于金刚石
10. A.C50Cl10是一种共价化合物,属于分子晶体,熔点比较低,一定低于原子晶体金刚石。
11. 天然石墨具有许多优良的性质,因而广泛应用于国民经济各部门,尤其在冶金、机械、电器、化工工业中得到广泛的应用。石墨能与熔融金属钾作用,形成石墨间隙化合物(K原子填充在石墨各层碳原子中)。青铜色的石墨间隙化合物是常见的一种,其化学式可写作CxK,其平面图形见图,。则x值为

A. 8 B、 12 C、24 D、60
11.A 该图中共有6个×1/2+1个=4个K原子,4个K原子围成的六边形中共有32个C原子,故二者之比为1:8,x值为8。
12. 氯化铯是种白色粉末状结晶,在电子工业、医药等方面有广泛的应用,CsCl晶胞(晶体中最小重复单元)见图。 下列说法中正确的是:

A..1个CsCl晶胞中含有1个Cs 、4个Cl—;
B.氯化铯晶体的熔点低于氯化钠;
C.氯化铯晶体是由一定数目的CsCl分子构成;
D.氯化铯晶体内至少含有两种以上的微粒间作用力。
12. B 由图知,每个CsCl晶胞实际拥有1个Cs (8个×1/8=1个)、1个Cl—;氯化铯晶体为离子晶体,不含分子,内部只存在离子键这一种作用力;由于Cs 半径大于Na ,故氯化铯晶体内离子键弱,其熔点低于氯化钠。
13.化学用语是应用化学知识的基础,下列表述正确的是
A. 丙烷的分子结构模型示意图:
B. Na2S的电子式:

C.NH4Cl 晶体内只有离子键
D.只有非金属元素组成的化合物不可能含有非极性共价键
13.A Na2S为离子化合物,其电子式为

;NH4Cl内既有离子键,又有共价键;只有非金属元素组成的化合物可能含有非极性共价键,如H2O2。
14.晶体类型与化学键类型关系密切,关于二者的下列叙述中,正确的是
A.离子晶体可以含共价键 B. 离子键可能存在于原子晶体中
C.离子晶体中只能含离子键 D.分子晶体中可以含离子键
14. A 含离子键的晶体就是离子晶体,但离子晶体可以含共价键, 如NaOH这样的离子晶体既含有离子键,又含有共价键。
15. 下列有关晶体的叙述中正确的是
A.分子晶体在任何条件下也不能导电
B.属于离子晶体的物质都溶于水
C.由分子组成的晶体其熔点比较低
D.金属晶体的熔点一定高于分子晶体
15.C 很多化合物形成的分子晶体(如HCl)在水溶液中共价键被破坏,形成自由离子而导电, A错;CaCO3、BaSO4等属于离子化合物,为离子晶体,却难溶于水,B错;金属晶体汞常温下为液体,熔点低于白磷等很多分子晶体,D错。
16.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是
A.WZ2分子中所有原子最外层都为8电子结构
B.WX2、YX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.W元素形成的一种单质为电的良导体
16.B W为碳,X为氧,Y为硅,Z为硫;石墨为电的良导体。

第Ⅱ卷(非选择题,共52分)
二、非选择题(本题包括6个小题,共52分)
17.(12分)超氧化钾是氯化钠型粉末状晶体(KO2晶胞的结构如图),有吸湿性、顺磁性。超氧化钾虽与水剧烈反应但不溶于有机溶剂,进行一简单可行的实验,具体方法步骤如下:①将固体超氧化钾研细,干燥后,准确称取m g 超氧化钾固体并转移到定容仪器A中 ②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出超氧化钾固体的体积为V mL。回答下列问题:
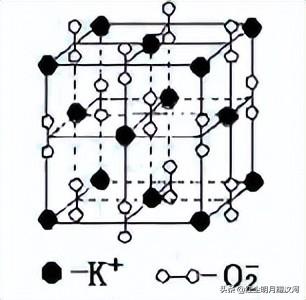
(1)步骤①中A仪器最好使用 。(填序号) A.量筒 B.烧杯 C.容量瓶 D.试管(2) ①超氧化钾晶体中每个K+周围有_______个O2-,每个O2-周围有_______个K+ ;
②根据题中条件,求出超氧化钾的化学式为_____________。
(3) 利用上述方法可求得阿伏加德罗常数,已知经X射线衍射测得晶胞中最邻近的K 和O22-平均距离为acm,则NA=_____________。
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的主要原因。假设某KO2纳米颗粒的大小和形状恰好等于KO2晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的比例为_____________。
17.【解析】该实验中应选择精确测量仪器——容量瓶,故(1)问选 C;(2)问,在超氧化钾晶体中,每个K+周围有6个O2-,每个O2-周围有6个K+,所以其化学式为KO2;
(3)问,由图可知KO2晶胞中含K 和O22-均为4个,故该晶胞质量为m(晶胞)=71g/mol÷NA×4;该晶胞体积为(2a)3cm3=8a3 cm3, V mL KO2固体含K 和O22-均为V/8a3个,V mL固体的质量为71g/mol÷NA×4×V/8a3=m g,所以NA=71V/2 a3m mol-1。
(4)问,该晶胞中共有27个微粒,只有1个在内部(体心),其余均在表面,故这种纳米颗粒的表面原子占总原子数的比例为26∶27 。
【答案】(1)C(2分)(2)6,6(每空1分);KO2(2分)
(3) 71V/2 a3(4分)
(4) 26∶27 (2分)
18.(8分)原子序数依次增大的A、B、C、D、E都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。E和其它元素既不在同周期也不在同主族,D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B形成的化合物中含有非极性共价键的是 ,属于 晶体。
(2)元素B、C形成的单质中熔点较高的是 。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式 。
(4)如图所示由上述五种元素中的两种元素所形成的离子化合物的晶胞(晶胞是在晶体中具有代表性的最小重复单元)。阴离子(用“· ”表示)位于该正方体的顶点和面心;阳离子
(用“○”表示)均位于小正方体中心。该化合物的化学式可能是 、 。
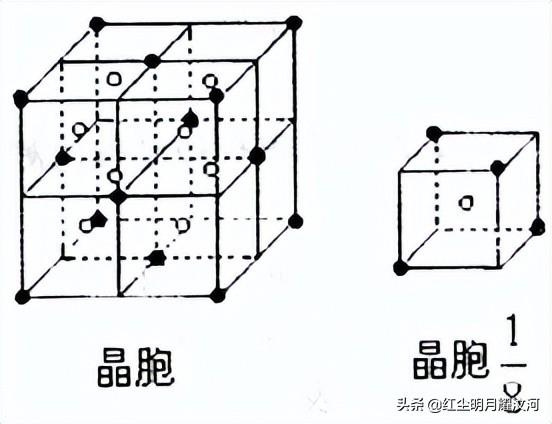
18.【解析】“B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水”且B、C、D原子序数依次增大,可知C的最高价氧化物对应的水化物具有两性,即Al(OH)3,故C为Al;Al(OH)3只能和强碱反应,故B为Na;A的原子结构中最外层电子数是电子层数的3倍,A为氧;A、D同主族,D为硫;E为前20号元素,在五种元素中原子序数最大且和其它元素既不在同周期也不在同主族,E为钙。所以,A、B、C、D、E依次为O、Na、Al、S、Ca。(1)问,水分子含有氢键,沸点高于硫化氢;Na2O2含有非极性共价键,属于离子化合物,为离子晶体。(2)问,钠和铝同为金属晶体,由于铝的原子半径小且价电子数多,金属键强,故铝的熔点较高。(4)问,在晶胞的1/8中,含阴离子1/8×4=1/2,含阳离子1个,故阴、阳离子为1:2,即Na2O、Na2S。
【答案】(1)D;Na2O2,离子 (每空1分)
(2)铝或Al(1分)
(3)Al(OH)3 OH-=AlO2- 2H2O(2分);
(4)Na2O、Na2S(每空1分)
19. (8分)现有A、B、C三种物质,A、B为气态氢化物,它们之间具有以下转化关系:
①A B→C,C与碱液共热放出A;②C的水溶液滴入AgNO3溶液会产生白色沉淀,加入稀HNO3酸化后沉淀无变化。请回答下列问题:
(1)A的分子式为___________,它为___________分子(填极性或者非极性),其稳定性___________PH3(填>或者<)。
(2)B的电子式为___________,其水溶液的酸性___________H2S(填>或者<)。
(3)C的名称为___________, C物质中含有的化学键类型为___________, C在一定条件下形成___________晶体(填晶体类型)。
19. 【解析】A是碱液中生成的气态氢化物,故A一定为碱性气体NH3,B为可与NH3 反应的气态氢化物,且产物与AgNO3溶液会产生白色沉淀,故B为HCl,C为NH4Cl。
【答案】 (1) NH3, 极性, >;(2)

,>;(3)氯化铵 ,极性键 、离子键 , 离子(每空1分)

20. (8分)铁是生活中常用的一种金属材料,在不同温度下铁晶体的晶胞(晶体的基本结构单元)不同。1183 K以下纯铁晶体的晶胞如图1所示,1183 K以上转变为图2所示的晶胞结构,但在两种晶体中最邻近的铁原子间距离相同。


(1)在1183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为___________;
(2)纯铁晶体在晶型转变前后(1183 K以下与1183 K以上)熔点___________(填:升高、降低、不变),二者晶胞的边长之比为(1183 K以下与1183 K以上之比)________。
20. 【解析】(1)问,由图1知,一个铁原子周围与其等距离且最近的铁原子数为8个铁原子,在图2中,若找准位于顶点的铁原子,则与之 等距且最近的铁原子为面心铁原子,一维方向上有四个,共有4个×3=12个;(2)问,由于在两种晶体中最邻近的铁原子间距离相同,故在晶型转变前后熔点不变;若铁原子的半径为a, 由图1知1183 K以下晶胞的边长为2a,由图2知1183 K以上晶胞的边长为

,故二者之比为

【答案】(1)8,12(2)不变,

(每空2分)
21. (6分)下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息回答下列问题:
|
元素 |
X |
Y |
Z |
W |
|
原子半径(nm) |
0.102 |
0.16 |
0.074 |
0.071 |
|
最高正价或最低价 |
6 |
2 |
-2 |
-1 |
⑴判断下列说法中正确的是
①.HW是热稳定性最强的氢化物 ②.元素X形成的单质与元素Z形成的单质可直接化合形成XZ2 ③.元素Y、Z形成的化合物YZ内含有共价键 ④.表中四种元素形成的单质中只有Y的单质能导电 ⑤.表中四种元素形成的单质中熔点最高的是Y
⑵ 原子半径最小的元素与表中的某两种元素可分别形成分子甲和离子乙。分子甲含10个电子、2个原子,它与离子乙含有相等的电子数,且二者可以发生反应生成分子丙和离子丁,丙、丁也与离子乙含有相等的电子数。
①请写出甲、乙反应的离子方程式 。
②原子半径最小的元素可与表中某种元素形成一种四核阳离子,该离子带有一个单位正电荷,当某溶液中该离子的浓度大于离子乙的浓度时,向该溶液中滴加小苏打溶液会有何现象? ,相应的离子方程式为 。
21.【解析】根据化合价与原子半径可判定:X为S,Y为Mg,Z为O,W为F。
(1)HF是热稳定性最强的氢化物,单质S在O2中燃烧生成SO2,MgO只含离子键,金属镁为电的良导体,其晶体的熔点高于其他三种分子晶体。(2) 原子半径最小的元素为H,结合题给条件分析得,甲为HF,乙为OH-,丙为H2O,丁为F-;带有一个单位正电荷的四核阳离子为H3O+,简写为H+。
【答案】 (1) ①②④⑤ (2分)
(2) ①HF OH- ﹦H2O +F-(2分) ②溶液中有气泡冒出(1分),HCO3-+H3O+﹦2H2O+CO2↑或者HCO3-+H+﹦H2O+CO2↑(1分)
22.(10分)俗话说,金无足赤,人无完人。具有规则几何外形的固体称为晶体,但很多晶体存在缺陷。晶体中最基本的重复单位称为晶胞,NaCl晶胞结构如图所示。在晶体FexO中既有Fe2 ,又有Fe3 ,其晶胞为NaCl型,由于晶体缺陷,x等于0.92。已知FexO晶体密度ρ为5.71 g·cm-3。回答下列问题:

(1) 确定该晶体的化学式(化学式中表示出Fe2+和Fe3+的个数)。
(2) 求该晶体晶胞的边长。
22.解: (1)设Fe2+为y个,则Fe3+为(0.92-y)个。
因为2y+3×(0.92-y)=2 所以 y=0.76(2分)
即Fe2+和Fe3+的个数比为19:4,故化学式为19 FeO·2Fe2O3。(4分)
(2)设该晶体晶胞的边长为a,由于Fe0.92O晶体晶胞为NaCl型,故1个晶胞中含4个Fe0.92O(2分)。
Fe0.92O的摩尔质量为67.5 g·mol-1,故5.71 g·cm-3×a3÷4 ×6.02×1023=67.5 g·mol-1(4分),
所以a=4.28×10-10 m(6分)。






