
1.弱电解质的电离平衡
电离平衡也是一种动态平衡,当溶液的温度、浓度改变时,电离平衡都会发生移动,符合勒夏特列原理,其规律是
(1)浓度:浓度越大,电离程度越小。在稀释溶液时,电离平衡向右移动,而离子浓度一般会减小。简记为“越稀越电离”。
(2)温度:温度越高,电离程度越大。因电离是吸热过程,升温时平衡向右移动。简记为“越热越电离”。
(3)同离子效应:如向醋酸溶液中加入醋酸钠晶体,增大了CH3COO-的浓度,平衡左移,电离程度减小;加入稀盐酸,平衡也会左移。
(4)能反应的物质:如向醋酸溶液中加入锌或NaOH溶液,平衡右移,电离程度增大。
2.电离常数(电离平衡常数)
以CH3COOH为例,

K的大小可以衡量弱电解质电离的难易,K只与温度有关。对多元弱酸(以H3PO4为例)而言,它们的电离是分步进行的,电离常数分别为K1,K2,K3,它们的关系是K1≫K2≫K3,因此多元弱酸的强弱主要由K1的大小决定。
【例1】 下表是几种常见弱酸的电离方程式及电离平衡常数(25 ℃)。

A.温度升高,K减小下列说法正确的是( )
B.向0.1 mol·L-1CH3COOH溶液中加入少量冰醋酸,c(H+)/c(CH3COOH)将减小
C.等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(CH3COONa)>pH(Na3PO4)

答案 B
3.电离平衡的移动与电离平衡常数K、离子浓度的关系

【例2】 在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:
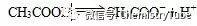
对于该平衡体系下列叙述正确的是( )
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡正向移动
答案 B
,




