作者:L. Carone1, G. M. Danesino1, L. Pietrobono1, A. Corsico1, M. Bonardi2, L. Sammarchi1, F. Zappoli1; 1Pavia/IT, 2Pavia, Pavia/IT
目的:综述骨愈合的生理机制,及其与不同阶段的多形态成像结果(从急性期到最终结果),并回顾失败/延迟修复的主要原因和相关的成像。
骨骼在人体内具有支撑身体、保护内脏、完成运动和参与代谢等作用。 人体是由不同骨骼通过关节、韧带等联系成的一个整体。特别是脊椎,它像一根“柱子”支撑着人体。没有脊柱,人类就不可能站立和走路。 骨骼在支撑人体的同时,还保护着体内的各种脏器,如颅骨保护着大脑,肋骨保护着心、肺,骨盆保护着子宫、膀胱等。没有骨骼的保,,外来的冲击可使内脏受损伤的机会大为增加。
正是因为骨骼的这些属性,造成了骨骼经常受到意外的伤害,创伤和非创伤(例如创伤,肿瘤,骨炎,延迟愈合,非结合,截骨术,关节融合术),导致骨质破坏。
骨折或截骨术致使骨骼连续性的完全或不完全断裂,最终导致机械不稳定:骨折通常伴有周围软组织的损伤,破坏骨骼的血液供应,并导致肌肉 - 骨骼功能的损害。
正常骨折通常由于剧烈的创伤而发生,其他还有一些特定的预先存在的因素,如骨质疏松症或局灶性潜伏性病变,即使在轻微的创伤中也会增加骨折的风险。
骨愈合病理生理学 BONE HEALING PHYSIOPATHOLOGY
一般将骨折愈合分为 3个阶段,即血肿机化期、原始骨痂形成期和骨痂改造塑形期;也有根据骨折愈合过程的组织学和生理学特征分为撞击期、诱导期、炎症期、软骨痂期、硬骨痂期和改建期 6 个不同的阶段。
1 .血肿机化期 骨折后,因骨折本身及邻近软组织的血管断裂出血,在骨折部形成了血肿,血肿于伤后 6- 8 小时即开始凝结成血块,与局部坏死组织引起无菌性炎性反应。骨折断端因血循环中断,逐渐发生坏死,约有数毫米长。随着纤维蛋白的渗出,毛细血管的增生,成纤维细胞、吞噬细胞的侵入,血肿逐渐机化,形成肉芽组织,并进而演变成纤维结缔组织,使骨折断端初步连接在一起,这就叫纤维连接,约在骨折后 2 ~ 3 周内完成。 同时,骨折端附近骨外膜的成骨细胞伤后不久即活跃增生, l 周后即开始形成与骨干平行的骨样组织,并逐渐向骨折处延伸增厚。骨内膜亦发生同样改变,只是为时稍晚。
2、原始骨痂形成期 原始骨痂形成或骨内膜和骨外膜的成骨细胞增生,在骨折端内、外形成的骨组织逐渐骨化,形成新骨,称为膜内化骨。
随新骨的不断增多,紧贴骨皮质内外面的骨细胞增生逐渐向骨折端生长,彼此会合形成梭形,称为内骨痂和外骨痂。骨折断端及髓腔内的纤维组织亦逐渐转化为软骨组织,并随软骨细胞的增生、钙化而骨化,称为软骨内化骨,而在骨折处形成环状骨痂和髓腔内骨痂。
两部分骨痂会合后,这些原始骨痂不断钙化而逐渐加强,当其达到足以抵抗肌收缩及成角、剪力和旋转力时,则骨折已达到临床愈合,一般约需 4-8周。此时 x 线片上可见骨折处四周有梭形骨痂阴影,但骨折线仍隐约可见。对骨外膜的损伤均对骨折愈合不利。
3、骨痂改造塑形期 原始骨痂中新生骨小梁逐渐增加,且排列逐渐规则和致密,骨折断端经死骨清除和新骨形成的爬行代替而复活,骨折部位形成骨性连接。这一过程一般约需 8 ~ 12 周。随着肢体活动和负重,应力轴线上的骨痂不断得到加强,应力轴线以外的骨痂逐渐被清除,并且骨髓腔重新沟通,恢复骨的正常结构 ,最终骨折的痕迹从组织学和放射学上完全消失。

表1
近年来研究表明,多种骨生长因子与骨折愈合有关,它们共同作用可刺激成骨细胞的活性,调节局部成骨。如胰岛素生长因子 I 、Ⅱ (IGF — I 、 IGF 一Ⅱ ) 、血小板衍生生长因子 (PDGF) 、碱性成纤维细胞因子 (bFGF) 、 B 转化生长因子 (TGF — B) 等在炎性阶段可进一步刺激间充质细胞聚集、增殖及血管形成。
骨形态发生蛋白 (BMP) 有较强的跨种诱导成骨活性( 即诱导未分化的间充质细胞分化形成软骨或骨 ) 和骨损伤修复作用,其作用无种属特异性。 骨折的临床愈合标准和骨性愈合标准 掌握骨折的临床愈合和骨性愈合的标准,才有利于确定外固定的时间、练功计划和辨证用药。
( 一 ) 骨折的临床愈合标准 1 .局部无压痛,无纵轴叩击痛。 2 .局部无异常活动。 3 . x 线照片显示骨折线模糊,有连续性骨痂通过骨折线。 4 .在解除外固定情况下,上肢能平举 lkg 达 1 分钟,下肢能不扶拐在平地连续徒手步行 3 分钟,并不少于 30 步。
5 .连续观察两周骨折处不变形,则观察的第 1 天即为临床愈合日期。
异常骨折修复过程
异常骨折修复过程 ABNORMAL FRACTURE REPAIR PROCESS
骨折愈合过程可能发生病理变化,最终导致延迟修复或异常修复过程(表2)。

表2
骨折超过预期的时间没有愈合,被称为延期愈合(delayed union)。不同部位的骨折愈合的时间也不相同,该时间标准通常为 3 ~ 6 个月。美国 AAOS 的诊断标准为:骨折后至少 9 个月,或连续 3 个月动态观察,未见到骨折有明显的愈合征象。骨不连的最终状态是滑膜假关节的形成。
有几种不同的分类系统,但骨不连最常分为肥厚性不愈合和萎缩萎缩性不愈合两类。
在肥厚性不愈合,也称为超血管不愈合,骨折边缘血管化并具有生物活性的潜力。有证据表明骨折区域周围有愈伤组织形成,这被认为是对骨折部位过度微动的反应。
在萎缩性不愈合,也称为无血管不愈合,骨折边缘无血管或血供不足, 因此没有或最小的愈伤组织形成和断裂线仍然明显。除了足够的固定以实现愈合之外,这种类型的不结合需要通过骨移植进行生物增强。 射线照相外观的变化可能很小,因此应评估射线照相月度监测以证明最终的进展。
骨折的愈合分为一期愈合与二期愈合:
一期愈合(直接愈合):影像学上仅能看到极少量的骨痂甚至没有骨痂形成,由破骨细胞和成骨细胞在骨折断端直接开始重建哈弗氏系统。
二期愈合(间接愈合):由微动引起骨折断端吸收,并通过以新生骨痂为主导的愈合方式进行骨折修复。二期愈合可以看到大量的骨痂。
骨不连的全身因素:高龄;慢性疾病,如糖尿病等;吸烟;酒精依赖;内分泌疾病,如甲状腺功能低下等;营养不良;放疗后;血管病;长期应用非甾体类药物、氟喹诺酮类抗生素、抗血小板药等。
骨不连的局部环境因素:
血供障碍:特殊部位骨骼的营养血管为单一血供,其中的一个骨折端将缺乏血供,影响骨折愈合。如胫骨下三分之一骨折、腕舟骨骨折、股骨颈骨折等。高暴力导致的骨折合并严重的软组织损伤,甚至血管断裂;过多的显露骨折断端,等因素均可造成骨折端的血供障碍。
机械稳定性:高能量导致的开放性骨折,骨质缺失可导致内固定术后机械稳定性差
感染:骨折端和周围软组织感染是骨不连的直接原因。
创伤中的诊断性成像 DIAGNOSTIC IMAGING IN TRAUMA
诊断成像提供了骨骼和软组织的详细图片,对于患者损伤和随访的适当临床管理至关重要,以便识别正常或异常的愈合过程,从而安排适当的医疗或手术治疗。诊断成像可以包括X射线(数字射线照相),多探测器计算机断层扫描(MDCT)扫描,磁共振成像(MRI)和正电子发射断层扫描(PET)。
射线照相 RADIOGRAPHY
尽管存在局限性,但放射线照相评估仍然是评估骨折愈合进展的关键成像方式。 在两个视图中获得射线照相,如果需要,可以使用倾斜位置投照。 放射学检查结果包括愈伤组织证据和大小、皮质桥接和骨折部位骨折线的逐渐丧失(图1,2,14)。 X射线随访也可以检测到不全骨折(图12)。

图1:胫骨单纯骨干骨折伴有螺旋骨折线:平片:a)创伤时,显示骨折; b)矫形铸造术后; c)和d)在3个月和6个月时,显示骨折部位的愈伤组织证据和大小,皮质桥接和骨折线的逐渐丧失。

图2:股骨中间骨干的螺旋骨折:平片:a)术后; b)和c)在3个月和6个月时,显示骨愈合过程的进展以肥厚性骨膜愈伤组织结束。
尽管先进的成像技术在定量和定性评估骨愈合方面取得了进展,但普通射线照相术仍然是用于此诊断的最广泛使用的诊断成像工具。这是由于与其他成像方式相比,成像成本更低,可用性更广,并且放射线照相的患者辐射暴露更小。
多伦多大学和麦克马斯特大学的研究小组提出了两种射线照相评分系统,髋关节射线照相联合评分(RUSH)和胫骨射线照相联合评分(RUST):它们显示了骨科医生和放射科医师在评估骨愈合方面的一致性增加。他们表明,评估愈伤组织桥接皮质的数量在确定愈合方面具有更高的可靠性; 因此,他们开发的系统主要基于平片上的皮质外观。实际上,RUST和RUSH评分是基于AP和侧位X线片上观察到的4个皮质的愈伤组织形成和骨折线的可见性。RUST和RUSH在研究医学方面都很有前途,但是他们需要更大的临床研究来将他们的数据与其他治疗结果测量结果进行比较,例如体检结果,其他成像方式和生物力学数据。
计算机断层摄影术 COMPUTER TOMOGRAPHY
多检测器计算机断层扫描(MDCT)在评估愈合,和具有丰富的钙化骨膜愈伤组织时,在显示骨折方面优于放射线照相术。在MDCT中,X射线束穿过感兴趣区的整个体积,并且使用各向同性分辨率,允许在任意空间平面上使用多平面重建(MPR)进行体积成像(图3)。

图3:股骨的多碎片骨干骨折:a)创伤时的平片; b)MDCT扫描,轴向和多平面重建图像显示该复杂骨折的错位; c)3D VRT重建显示了骨折全景图。
放射摄影通常是一种不可靠的诊断方式,并不足以作为临床管理骨质愈合过程中,患者疑似异常的专有放射技术。相反,MDCT为评估临床怀疑延迟愈合,或不愈合的患者的骨愈合提供了有价值的数据,特别是当放射摄影是模棱两可的时(图4,13)。有多项研究表明,CT扫描在临床环境中评估骨折愈合,更具有准确性和有效性。


图4:股骨的多碎片远端骨干骨折:a)X线平片,自术后3个月; b)和c)MDCT扫描,多平面重建和轴向图像显示骨缺失与不完全的跨片段桥和骨组织的局灶性损失。
过去的研究文献中表明,CT扫描比常规X线片更早的发现正常愈合的迹象,例如骨折边缘模糊和骨膜愈合组织形成。当测试不愈合时,CT具有非常高的灵敏度(100%),但有62%的低特异性的局限性。CT的局限性是由于内部和外部固定内置物引起的束硬化伪影。尽管使用现代软件在图像质量方面取得了进步,但在评估金属外科内置物附近的骨组织时仍然会影响分辨率。CT扫描的另一个限制是成本和辐射剂量,显着高于放射线照相。
磁共振成像 MAGNETIC RESONANCE IMAGING
磁共振成像(MRI)在评估骨折方面与MDCT相当,甚至更好,特别是在检测放射学隐匿(不完全骨折和应力性骨折)和细微骨折方面。实际上,CT和MRI显示骨折的诊断特异性高达100%,而MRI的敏感性高于MDCT。现在,人们普遍认识到MRI在检测隐匿性骨折方面优于任何其他成像模式的优越性能。
MRI在检测骨折相关软组织异常(即韧带损伤)方面,也非常敏感和特异。然而,由于时间限制和高成本,MRI可能仅在具有X射线阴性的患者中作为二级成像执行。在X射线能过显示细小改变前几周,隐匿性骨折的MRI征象就很显著。通常,隐匿性骨折在T1W图像上显示为线性低信号,MRI还可以显示骨折线周围的骨髓异常,如骨髓水肿,骨内出血或肉芽组织,T1W图像显示为低信号,流体敏感序列显示为高信号(图5,15,16)。

图5:第5跖骨隐匿性骨干骨折:a)X线平片,未显示骨折线; b)T1-w MR序列显示微小的低强度骨干螺旋线断裂; c)TIRM MR序列显示骨折线周围的骨髓水肿。
MRI对于骨折愈合过程的检测非常敏感,因为它对骨髓变化很敏感。 通常,MRI上的愈合外观被视为,由代表血运重建的线性带包围的骨折线。 血运重建的失败几乎总是与最终的不结合有关。 即使愈合进展,MRI通常会继续显示稳定骨折周围的异常信号。 愈合的唯一标志是正常的骨髓信号的恢复,和骨折线区骨质连续性恢复。
感染中的诊断性成像 DIAGNOSTIC IMAGING IN INFECTIONS
骨折通常对感染有抵抗力,但是可能由于创伤,菌血症,手术或异物而发生骨髓炎。 骨髓炎的特征在于进行性的骨质破坏吸收和重建,最常见的是由化脓菌和分枝杆菌引起的。 骨髓炎的临床特征取决于患者的年龄,特定的微生物,受累的解剖区域,受影响的骨段,污染途径,全身和局部宿主因素,最终的合并症。
急性骨髓炎的早期诊断至关重要,因为及时的抗生素治疗可以预防骨坏死。影像信息对诊断和治疗计划都非常有帮助。几种成像方式都可用于评估疑似骨髓炎的患者,横断面成像技术(CT,MRI)现在被认为是骨髓炎诊断的标准:它们具有非常高的灵敏度和特异性。这些成像方式为感染区域(骨骼节段和周围软组织)提供了极好的信息。核医学技术虽然高度敏感,但有时并不具体。
当临床上怀疑骨髓炎时,评估通常从常规放射照相开始。 平片可能提示正确的诊断,排除其他诊断,或提供共存病理状况的线索。确认可疑骨髓炎的射线照相特征可能是软组织变化,肌肉肿胀和软组织间隙模糊。在化脓性感染中,骨异常表明感染过程已存在至少2至3周。一般而言,骨髓炎必须损害30%至50%的骨矿物质含量,才能在平片上产生明显的变化。早期发现可能很细微,直到1或2周才可能稍有显示。典型的早期骨骼异常是:骨膜增厚,溶解性病变,骨内膜扇形,骨质减少和新骨产生。单个或多个射线可透性脓肿在骨髓炎中明显可见(图6)。慢性骨髓炎的典型发现是坏死骨,平均10天形成,然而传统的X线摄影好几个星期可能无法检测到死骨。慢性骨髓炎的其他特征是:骨膜炎,内脏形成和瘘管。

图6:跟骨的骨髓炎:平片显示由周围的骨硬化反应以及中间脓肿形成。
在慢性骨髓炎中,CT显示骨性皮质异常增厚,伴有硬化改变,髓腔延伸和慢性引流瘘。 CT优于传统的X线摄影,因为它可能比普通X线片更早地显示出这些变化(图7)。

图7:跟骨的骨髓炎:与图6中相同的患者:MDCT多平面重建,显示跟骨体中的硬化变化,延伸,以及跟骨足底的慢性引流瘘。
在慢性骨髓炎中,CT成像在检测骨切片中起主要作用,因为在常规放射线照相中,坏死骨可能被周围的骨质异常所掩盖:事实上,坏死骨的检测有助于指导治疗选择。在检测死骨,包膜,或骨内的气体时,CT优于MRI,并且成像可以指导活检和关节抽吸。在用于评估慢性骨髓炎的不同研究中,CT成像技术显示灵敏度为0.67,置信区间为95%(0.24至0.94),特异性为0.50(0.03至0.97)。在CT成像中,在骨髓炎区域中或附近存在金属(即关节置换植入物),由于束硬化伪影而导致图像分辨率的显着损失,因此降低了诊断准确性。
MRI对骨髓炎的诊断非常有帮助,它可以检测急性骨髓炎的早期感染迹象,它可以评估骨感染和周围软组织各个阶段的疾病介入程度和活动程度。MRI被认为是骨髓炎中最有用的成像技术,因为在检测骨髓异常时,它能够提供极好的结构清晰度和空间分辨率。 早在感染发作后3至5天,MRI对于检测骨髓炎非常敏感。MRI可以通过评估坏死组织的范围,以及确定所涉及的邻近关键结构来帮助进行手术计划,这需要不同的手术管理以避免发病和并发症。
在MRI中,金属的存在(即关节置换植入物)可能产生降低诊断质量的局部伪影。MRI结果可变,取决于脉冲序列(T1加权或T2加权)和疾病阶段。不同的脉冲序列和成像方案可用于评估肌肉骨骼系统。 STIR和T1自旋回波序列的组合显示出对骨髓炎检测的高灵敏度和特异性。
MRI上急性骨髓炎的最早特征是骨髓信号强度异常,可在感染发病后1至2天检测到,髓质空间中的水肿和渗出物在T1加权图像上产生不明确的低信号强度,在STIR序列上产生高信号。
在MRI上,在T1加权和STIR序列上检测到低信号强度区域为死骨, 周围肉芽组织的特征在于T1加权图像的中低信号强度,STIR或T2加权序列的高信号强度。 使用静脉内造影剂(钆),肉芽组织增强,而死骨的特征在于低信号强度。骨化的骨膜组织和腔内的坏死皮质骨在所有序列上具有低信号强度,骨膜反应和皮质骨在STIR序列上通过线性分离,为高信号强度(图8)。

图8:跟骨的骨髓炎:与图6相同的患者:MRI扫描:a)T1-W矢状位图像显示跟骨体内的骨脓肿; b)和c)TIRM轴向和冠状图像显示骨脓肿周围的骨髓水肿和足底方面软组织中的瘘开口。
检测STIR序列上骨髓的增加的信号强度,可以代表手术后或感染后的肉芽组织,并且不一定是持续性感染。 然而,如果在连续MRI研究中存在这种骨髓异常的进展,该发现表明骨髓炎活动。MRI可能偶尔无法区分传染性和反应性炎症。通过金属植入物,例如关节假体或感染部位的固定装置,可以降低其诊断准确性。
骨移植,骨质疏松症,骨移植和骨转移的诊断性成像 DIAGNOSTIC IMAGING IN BONE GRAFTS, SCAFFOLDS, BONE SUBSTITUTES AND BONE TRANSPORT
骨移植材料广泛用于整形外科手术以促进新骨形成和愈合,并且作为抗生素在受损部位的传递介质。
骨移植材料的目标是通过新骨形成,促进骨缺损的愈合。因此,骨移植物材料提供了一种支架,新骨可通过该支架通过成骨,骨诱导和骨传导的过程生长。 在骨诱导中,周围组织潜在的间充质细胞分化成成骨细胞, 这种转化是由移植物内的生长因子介导的。在骨传导中,可再吸收或永久性植入物用作支架,以促进血管形成和宿主骨细胞的迁移。当形成新的骨组织时,移植物可以部分或完全地逐渐再吸收。
骨移植物材料的结合取决于新的骨形成,和响应于机械应力的宿主骨骼组织的重塑:这些过程在与骨折愈合中类似的连续阶段中进展。
有三种主要类型的骨移植材料:自体移植(来自宿主骨骼的移植物),同种异体移植(来自尸体骨骼的移植物)和合成骨移植替代物。
在自体移植物中,从患者自身的骨骼中取出松质骨、皮质和皮质松质骨颗粒和骨髓,它们不仅提供骨量,还提供能够通过骨形成,骨诱导和骨传导过程形成新骨的骨基质细胞。骨自体移植的主要部位是髂嵴和腓骨,但移植材料也可以从其他长骨中取出。
同种异体移植物(尸体骨移植物)提供缺乏骨诱导特性的骨传导基质。移植物被肉芽组织包围并经历血管和骨细胞侵袭。同种异体移植物移植物和宿主肉芽组织之间的界面是骨 - 碎屑活动的部位。当维持骨溶解和骨形成之间的平衡时,移植成功掺入可能会进展。骨同种异体移植具有特定的局限性,如宿主免疫应答和移植物排斥,不成功的掺入,经济成本。同种异体移植物用作骨空隙填充物,抗生素递送系统,复合移植物和嵌体移植物。 在人工假体骨折或大骨切除术中,将同种异体移植物用作骨支架。并发症可能包括骨折不愈合或移植骨折。在整形外科重建中,骨同种异体移植物通常与固定装置一起放置; 但是,移植失败可能会对硬件产生过大的机械负荷,从而导致硬件故障。
移植物组合通常用于获得骨传导和骨诱导过程。同种异体移植物可以与自体富含血小板的血浆(PRP)混合,该血浆是一小部分血浆中的人血小板浓度,其通过提供生长蛋白来增强骨诱导。
合成替代物可分为三组:脱矿质骨基质和复合材料(陶瓷)。
脱矿骨基质通过脱矿酸过程由骨产生,以形成骨生长因子,非胶原蛋白和胶原蛋白的复合物。脱矿质骨基质具有骨诱导性质,但由于矿物质成分的损失而缺乏结构刚性。
陶瓷由硫酸钙,羟基磷灰石,磷酸三钙或其组合组成; 它们有各种形式,如颗粒,水泥和糊状物。
陶瓷提供骨传导框架但缺乏骨诱导特性。这些产品设计用于逐步替代,包括在愈合过程中用骨替换陶瓷。
骨自体移植物的成像特征取决于移植物的类型,组成和年龄; 最初看起来像射线照片上的骨片; 血管化腓骨自体移植物显示出长骨的特征,具有确定的皮质和髓管。
同种异体移植物显示出类似于皮质的密度,当与PRP组合使用时,在射线照片上只有同种异体移植物材料是明显的,因为富含血小板的血浆是射线可透过的。
脱矿骨基质在常规X射线照片中是射线可透的,因为其固有的矿物成分不存在。
在X光片上,陶瓷看起来比相邻的原生骨更密集(图10)。在术后期间,移植物 - 宿主界面处的射线可透区域明显,并且移植物的边缘和内部结构清晰。随着骨向内生长,射线照片的进展显示植入物周围的射线可透区域的消失,并且植入物边缘的清晰度丧失。这些变化是骨 - 碎屑活动和骨质向内生长的结果。

图10:用合成骨移植物(陶瓷颗粒)治疗的慢性骨髓炎:在平片上陶瓷颗粒比天然骨组织致密。
在MDCT扫描中,自体移植物的密度类似于相邻皮质骨的密度, 如在放射线照相中血管腓骨自体移植物显示管状骨的解剖结构,具有确定的皮质和髓管。
同种异体移植物在MDCT扫描中具有与皮质类似的密度。整块同种异体移植物最初表现为具有确定的皮质和髓管的长骨。碎片形式的移植物是骨缺损内的高密度聚集体。在开始时,宿主和移植物之间的射线离散可透界面是可识别的,然而,随着愈合的进行,由于骨向内生长,移植物 - 宿主界面消除。
在放置后立即获得的MDCT扫描中,硫酸钙陶瓷具有类似于骨皮质的密度,然而,随访扫描显示在30-60天内逐渐再吸收。
在MR成像上,自体移植物具有可变的术后外观。在T1加权MR图像上,自体移植物与天然骨的固体融合,可以通过延伸通过手术部位的正常骨髓信号强度和完整的皮质边缘来证明。自体移植物中的信号在T1加权MR图像上可能是高强度的,在T2加权MR图像上可能是低强度的。自体移植物的MR成像外观是其内部存活骨髓的结果,这是其他移植物材料中不存在的特征。由于肉芽组织的坏死和向内生长,T1加权图像上的低信号强度和T2加权图像上的等强度到高强度,可能在自体移植物中是明显的。血管腓骨自体移植物应具有骨髓相似的T1和T2加权信号强度。
在术后立即MRI检查,同种异体移植物在T1和T2加权图像上都具有低信号强度。MR成像也可用于评估骨髓信号强度的存在或不存在,这可以是移植物掺入或失败的证据。在移植物掺入的后期,造血组织替代正常的脂肪骨髓,红骨髓信号证明该过程的存在。
当陶瓷颗粒用于整形外科手术时,在术后扫描中获得的MR图像上,术后部位中信号强度的弥散增强是预期的发现:这可能是由血管化肉芽组织向内生长引起的。无论MR序列如何,硫酸钙颗粒都呈现低强度和肿块样(图11)。

图11:用合成骨移植物(陶瓷颗粒)治疗的慢性骨髓炎:与图10相同的患者:MRI扫描:T1-w冠状图像:陶瓷颗粒呈低信号。

图12:髋臼骨折。(a)术后X线片显示髋臼骨折固定; 随访X线评估(b,c)显示由于血管功能障碍,引起不全骨折,其头部塌陷导致的进行性进行性股骨畸形
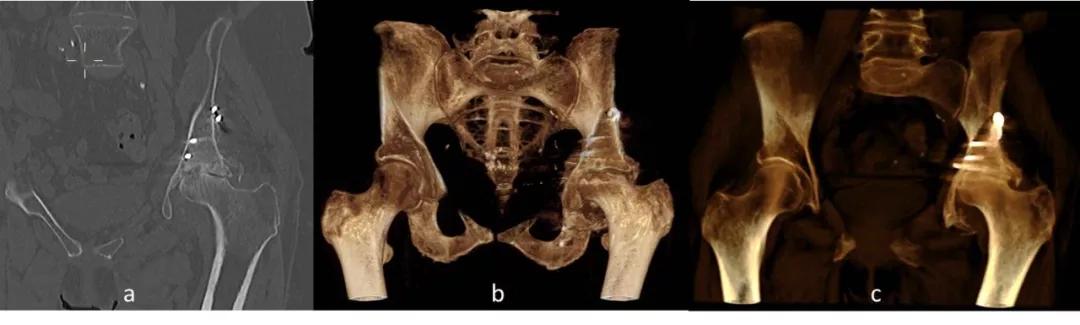
图13:冠状面(a)MPR CT图像(骨窗)显示确认左侧股骨头塌陷,伴有上方畸形和硬化,以及髋臼创伤后退行性变化。 VRT图像(b,c)提供受伤的左髋 - 股骨关节的全景图和左髋臼中的矫形硬件的位置。 (图12中的同一患者)

图14:增生性愈合组织和假性硬化症:AP(a)和LL(b)X射线视图显示尺骨桡骨骨折。 术后AP(c)和LL(d)X射线视图显示骨折固定。 6个月的随访AP(e)和LL(f)X射线视图显示由于假关节导致的骨折部位的增生性愈合组织。

图15:舟骨骨折:右侧腕部创伤和舟骨部位疼痛的患者:平片(a)和冠状CT MPR图像(b)未显示骨折迹象。 MR T1w(c)和TIRM(d)冠状图像显示非移位舟状骨折伴骨髓水肿,关节腔内可见积液。

图16:图15中的同一患者MRI跟踪:骨折时冠状PD(a)和T1w(b)图像。 随访3个月(c,d)显示由于常规骨修复反应引起的骨髓水肿增加。 随访6个月(e,f)显示,由于愈合的进展,反应性骨髓水肿几乎完全消退,无骨坏死。
参考文献1. B. Weissman, Orthopedic Radiology, W B Saunders Co, 2nd Edition (March 1, 2002).
2. A. Greenspan and L. S. Steinbach, Orthopedic Imaging: A Practical Approach, Wolters Kluwer, 5th Edition.
3. L. Qin, H.K. Genant, J.F. Griffith, K.S. Leung, Advanced Bioimaging Technologies in Assessment of the Quality of Bone and Scaffold Materials, 2007 Springer-Verlag Berlin Heidelberg.
4. E. Y. L. Waese, R. R. Kandel, W. L. Stanford, Application of stem cells in bone repair, Skeletal Radiol (2008) 37:601–608 DOI 10.1007/s00256-007-0438-8.
5. L. A. Hackney, S. D. Dodds, Assessment of scaphoid fracture healing, Curr Rev Musculoskelet Med (2011) 4:16–22 DOI 10.1007/s12178-011-9072-0.
6. T. W. Bauer, Bone graft substitutes, Skeletal Radiol (2007) 36:1105–1107 DOI 10.1007/s00256-007-0377。。。。等等
来源: 医疗互动
【版权声明】本平台属公益学习平台,转载系出于传递更多学习信息之目的,且已标明作者和出处,如不希望被传播的老师可与我们联系删除
,




