《空气中氧气体积分数的测定》实验,是九年级化学学习的第一个实验,涉及到具体的实验原理、实验设计、实验操作和误差分析。因此,这个实验也成为第一学期期中考试、期末考试的重点实验。
同时,对该实验的拓展装置的考察可深可浅,难度设置可大可小,也成为模拟考试、中考的切入点。
本文就该实验的基本原理和拓展装置做了整理、汇总及比较,资料来源自历年中考真题、网络上获取的各位老师的科研文章。
1 化学反应原理利用磷燃烧消耗空气中的氧气,从而使容器内形成负压,打开止水夹后,水进入容器内。进入容器中的水的体积,可粗略地认为是空气中所含氧气的体积。将不可见的气体体积的变化转换成可见的液体的体积。
2 实验仪器集气瓶、燃烧匙、烧杯、玻璃管、乳胶管、止水夹
3 实验药品红磷、水;注意:碳、硫、磷、铁、镁……等的燃烧不可用来作为测定空气中氧气的含量的实验药品的选择。
4 基本实验装置
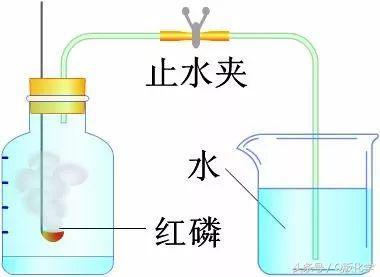
文字表达式:红磷 氧气-点燃→五氧化二磷
关键点:装置不漏气,产物是固体,红磷要充足,冷却到室温,再测定体积。
5 装置的缺陷(1)该实验装置可能发生气体泄漏的地方太多,加之燃烧的红磷伸入集气瓶中加热了内部的空气,使之外逸,都会导致实验的误差
(2)反应物浓度越小,反应的速率越慢。当燃烧持续进行时,氧气的浓度越来越小,氧化的速率也越来越小。维持红磷燃烧需要的氧气浓度相对较高,利用燃烧,无法除尽空气中的氧气
(3)装置外点燃红磷产生的五氧化二磷会污染空气
6 误差分析(1)为什么有时气体减少的体积小于1/5呢?
导致结果偏低的原因可能有:①红磷的量不足;②未冷却至室温就打开弹簧夹,使进入瓶内的水的体积减少。;③装置漏气(如塞子未塞紧、燃烧匙和橡皮塞之间有缝隙等),使外界空气进入瓶内;④瓶内氧气没有耗尽(思考:燃烧匙的位置问题)⑤打开止水夹后,导管中有少量水留在导管中(未事先在导管内充满水)
(2)为什么有时气体减少的体积大于1/5呢?
导致结果偏高的原因可能有:①点燃红磷后,插入燃烧匙时,瓶塞子塞得太慢,使得瓶中空气受热膨胀,部分空气溢出。②实验开始时,未夹止水夹(或未夹紧)。
7 实验的优化(装置的优化和药品的优化)

目前100000 人已关注加入我们
















点击这里阅读原文即可下载
,




