150年前,门捷列夫发现了化学元素之间的关系

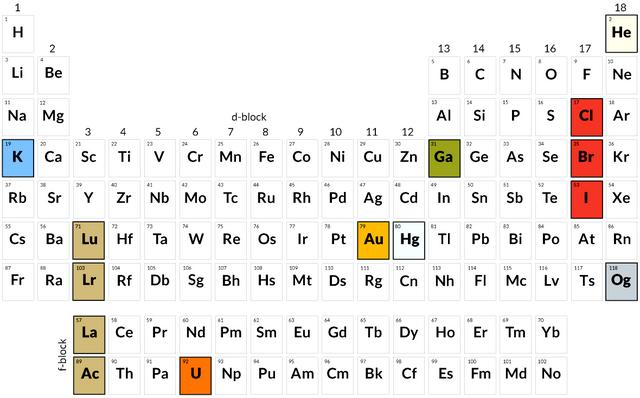
俄国科学家门捷列夫(Dmitrii Mendeleev, 1880年左右)是第一个公布元素周期表的人,它将已知元素按逻辑顺序排列,并为尚未发现的元素留出空间。
每一个科学领域都有值得纪念的重要日子。
对于物理学来说,是1687年的牛顿定律,它介绍了运动和重力定律;
生物学是庆祝达尔文的《物种起源》(1859年)和他的生日(1809年);
天文爱好者纪念1543年哥白尼将太阳置于太阳系中心;
对于化学来说,没有什么比元素周期表的起源更值得庆祝的了。150年前的3月,俄国化学家门捷列夫发明了元素周期表。
门捷列夫的表格对化学专业的学生来说已经变得像电子表格对会计一样熟悉。它用100个左右包含符号和数字的方块概括了整个世界。它列举了构成地球上所有物质的元素,并将其排列以揭示其性质,从而指导了化学研究在理论和实践上的追求。
“元素周期表,”化学家彼得·阿特金斯(Peter Atkins)写道,“可以说是化学中最重要的概念。”
门捷列夫的表格看起来像一个特别的图表,但他想用这个表格来表达他发现的一个深刻的科学真理:周期律。他的定律揭示了已知化学元素之间深厚的家族关系——当按原子量的顺序排列时,它们在有规律的间隔(或周期)内表现出类似的性质——并使门捷列夫能够预测尚未发现的元素的存在。
门捷列夫宣称:“在元素周期表出现之前,化学元素在自然界中只是零星的、偶然的事实。”“周期性定律首先使我们能够在过去化学视觉无法到达的距离上感知未发现的元素。”
门捷列夫的表格不仅预示了新元素的存在。它还证实了当时备受争议的原子存在的观点。它暗示了亚原子结构的存在,并预测了作为物质规则基础的数学仪器,最终在量子理论中显现出来。他的桌子完成了化学科学从中世纪魔法炼金术神秘主义到现代科学严谨领域的转变。元素周期表不仅象征着物质的成分,而且象征着所有科学的逻辑说服力和原则合理性。
有序的开始(愿景)

门捷列夫的元素周期表发表于1869年,是一张垂直的图表,按原子量排列了63种已知元素。这种安排将具有类似属性的元素放置到水平行中。书名为《元素体系草案:基于它们的原子质量和化学特性》“Draft of system of elements: based on their atomic masses and chemical characteristics”。
奠定基础传说门捷列夫在一天之内构思并创造了这一切:1869年2月17日(俄国日历)世界上大部分地区是3月1日。但这可能有些夸张。门捷列夫多年来一直在考虑对元素进行分组,在过去几十年里,其他化学家也多次考虑过元素之间的关系。
事实上,早在1817年,德国化学家约翰·沃尔夫冈·杜贝雷纳就注意到了元素组合的特殊性。在那个年代,化学家还没有完全掌握原子的本质,正如英国教师约翰·道尔顿在1808年提出的原子理论所描述的那样。在他的新化学哲学体系中,道尔顿通过假设每种基本物质都是由某种特定类型的原子构成来解释化学反应。
道尔顿提出,当原子断开或连接时,化学反应产生新的物质。他推断,任何给定的元素都完全由一种原子组成,与其他原子的重量不同。氧原子的重量是氢原子的8倍;道尔顿认为,碳原子的重量是氢的六倍。当元素合成新的物质时,利用这些原子量就可以计算出反应的量。
道尔顿在一些重量上错了——氧的重量是氢的16倍,而碳的重量是氢的12倍。但他的理论使原子的概念变得有用,激发了一场化学革命。在接下来的几十年里,精确地测量原子量成了化学家们的首要任务。

当考虑这些权重时,杜贝雷纳注意到,特定的三组元素(他称之为三元组)显示出一种特殊的关系。例如溴的相对原子质量介于氯和碘的质量之间,这三种元素都表现出相似的化学行为。锂、钠和钾也是三元组。
内在秩序这张表上的每一个元素都有自己的故事。总之,它们囊括了所有已知的化学知识。
其他化学家发现了原子量和化学性质之间的联系,但直到19世纪60年代,人们才对原子量有了足够的了解和测量,从而产生了更深刻的见解。在英国,化学家约翰·纽兰兹(John Newlands)注意到,按照增加原子量的顺序排列已知元素,每八种元素就会产生一种重复的化学性质,他在1865年的一篇论文中把这种模式称为“八度定律”。但是纽兰兹的音型在前两个八度之后就不怎么适用了,这使得一位评论家建议他应该试着把这些元素按字母顺序排列。显然,正如门捷列夫很快意识到的那样,元素属性和原子量之间的关系要复杂一些。
组织元素

门捷列夫1834年出生在西伯利亚的托博尔斯克(他父母的第17个孩子),过着相对自由的生活,追求多种兴趣,并沿着一条曲折的道路走向卓越。在圣彼得堡一所教学机构接受高等教育期间,他差点死于一场重病。毕业后,他在中学教书(这是他在教学机构获得奖学金的一个要求),在教授数学和科学的同时,他还为自己的硕士学位努力。
然后,他做了一名导师和讲师(同时还有一些科普写作),直到获得了在欧洲最著名的大学化学实验室进行长期研究的奖学金。
当他回到圣彼得堡时,他没有工作,所以他写了一本关于有机化学的书,希望能赢得一大笔奖金。1862年德米多夫奖(Demidov Prize)为他带来了丰厚的奖金。他还找到了一份为各种化学工业编辑,翻译和顾问的工作。最终,他重返研究领域,1865年获得博士学位,之后成为圣彼得堡大学(University of St. Petersburg)教授。
不久之后,门捷列夫开始教授无机化学。在准备掌握那个新领域时,可用的教科书并没有给他留下深刻的印象。所以他决定自己写。组织文本需要组织元素,因此如何最好地安排这些元素是他考虑的问题。
到1869年初,门捷列夫已经取得了足够的进展,认识到一些类似的元素群的原子量有规律地增加;其他原子量大致相等的元素具有相同的特性。按照元素的原子量排序似乎是对它们进行分类的关键。
在门捷列夫自己的叙述中,他将63种已知元素的每一种属性都写在一张便条卡上,以此来组织自己的思维。然后,通过一种化学纸牌游戏,他找到了他要寻找的模式。将卡片从较低的原子质量排列到较高的原子质量的垂直列中,在每一行中放置具有类似性质的元素。门捷列夫周期表诞生了。3月1日,他画出了第一张草图,并把它送进了打印机,继而把它纳入了即将出版的教科书中。随后他很快准备了一篇论文提交给俄罗斯化学学会。

粗略的草图
门捷列夫在他的论文中宣称:“根据原子量大小排列的元素具有明显的周期性。”“我所做的所有比较……使我得出结论,原子量的大小决定了元素的性质。”
与此同时,德国化学家洛塔尔·迈耶(Lothar Meyer)也一直在研究元素的组织。他准备了一张类似于门捷列夫的图,甚至比门捷列夫更早。但是门捷列夫首先发表了。
比打败迈耶更重要的是,门捷列夫利用他的表格对未发现的元素做出了大胆的预测。门捷列夫在收拾桌子的时候,发现有些便条卡不见了。他不得不留出空白来让已知的元素正确对齐。在他的一生中,这些空白中有三个是由以前不为人知的元素镓、钪和锗填补的。
门捷列夫不仅预言了这些元素的存在,而且准确地描述了它们的性质。例如,1875年发现的镓的原子量(当时的测量值)为69.9,密度是水的6倍。门捷列夫预测了一种元素(他称之为eka-铝),其密度和原子量为68。他对埃卡硅的预测与1886年发现的锗的原子量(预测72,观察72.3)和密度(5.5对5.469)非常接近。他还正确地预测了锗与氧和氯的化合物的密度。
门捷列夫的周期表成了神谕。这就像游戏结束时拼字游戏的小块拼出了宇宙的秘密。当其他人已经瞥见了周期律的威力时,门捷列夫是利用它的大师。
门捷列夫的成功预言为他赢得了化学之父的传奇地位。但今天,历史学家们对预测元素的发现是否巩固了人们对他的周期律的接受提出了质疑。元素周期表的正确可能更多地是因为它有权力解释已确立的化学关系。无论如何,门捷列夫预测的准确性肯定引起了人们对他的表格优点的关注。

到19世纪90年代,化学家们普遍认为他的定律是化学的里程碑。1900年,未来的诺贝尔化学奖得主威廉·拉姆齐(William Ramsay)将其称为“化学领域迄今为止最伟大的归纳”。
也许这一切早已超出了门捷列夫的预期。
数学映射在科学史上的许多例子中,基于新方程的宏大预测被证明是正确的。不知何故,数学在实验人员发现一些大自然的秘密之前就已经揭示出来了。反物质是一个例子,宇宙膨胀是另一个例子。在门捷列夫的例子中,新元素的预测没有任何创造性的数学计算。但事实上,门捷列夫发现了一幅深刻的自然数学地图,因为他的表格反映了量子力学的含义,即支配原子结构的数学规则。
门捷列夫在他的教科书中指出,“组成原子的物质的内部差异”可能是元素周期性重复特性的原因。但他并没有遵循这一思路。事实上,多年来他一直在喋喋不休地说原子理论对他的研究有多重要。
但其他人能读懂表格上的信息。1888年,德国化学家约翰内斯·维斯利塞努斯(Johannes Wislicenus)宣布,按重量排列的元素特性的周期性表明,原子是由更小的粒子的规则排列构成的。因此,在某种意义上,门捷列夫的表格确实预测到了(并为)原子复杂的内部结构提供了证据,而在那个时候,没有人知道原子到底是什么样子,甚至根本不知道它是否有内部结构。

到1907年门捷列夫去世时,科学家们已经对原子有了一些了解:带负电荷的电子,加上一些带正电荷的部分,使原子具有电中性。1911年,英国曼彻斯特大学(University of Manchester)物理学家欧内斯特·卢瑟福(Ernest Rutherford)发现了原子核。不久之后,曾与卢瑟福共事的物理学家亨利·莫斯利(Henry Moseley)证明了原子核中正电荷的数量(包含的质子数,或“原子数”)决定了元素周期表中元素的正确顺序。
原子量与莫斯利的原子序数密切相关——足够接近,按重量排序的元素与按数量排序的元素只差几个点。门捷列夫坚持认为这些重量是错误的,需要重新测量,在某些情况下,他是对的。虽然仍存在一些差异,但莫斯利的原子序数澄清了这一问题。
与此同时,丹麦物理学家尼尔斯·玻尔(Niels Bohr)意识到,量子理论支配着原子核周围电子的排列,而最外层的电子决定着一种元素的化学性质。

物理学家Niels Bohr于1922年修订了元素周期表
外层电子的类似排列会周期性地重现,这就解释了门捷列夫的表格最初揭示的模式。波尔在1922年根据电子能量的实验测量(以及周期律的一些指导),创造了他自己的版本。
波尔的表格增加了自1869年以来新发现的元素,但本质上仍然是门捷列夫发现的周期性排列。门捷列夫在对量子理论一无所知的情况下,创建了一张表,反映了量子物理学所规定的原子结构。
丹麦物理学家尼尔斯·玻尔1922年版的元素周期表,改编自丹麦化学家朱利叶斯·汤姆森的一张表。右边的空框标记了一组元素的预期发生情况,这些元素在化学上类似于前一列中的稀土元素(编号58-70)。
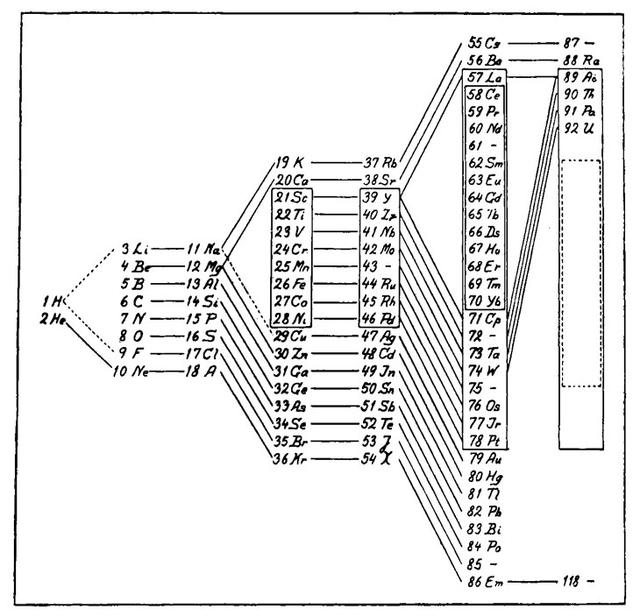
N. BOHR,1922年
波尔的新表既不是门捷列夫最初设计的第一个也不会是最后一个变种。周期表的数百个版本已经被设计并出版。现代形态是一种横向设计,与门捷列夫最初的纵向设计形成对比,直到二战后才开始广泛流行,这主要归功于美国化学家格伦·西博格(Glenn Seaborg)的工作。
西博格和他的合作者综合产生了几个新的原子序数超过铀的元素,铀是表中最后一个自然存在的元素。西博格发现这些元素,超铀元素(加上铀之前的三种元素)需要在表中增加一行,这是门捷列夫没有预见到的。西博格的表在稀土元素的类似行下面添加了这些元素的行,而稀土元素的正确位置也一直不是很清楚。“巴克·门捷列夫需要很大的勇气,”西博格在1997年的一次采访中说,他于1999年去世。
西博格对化学的贡献为他赢得了与自己同名元素的荣誉,钅喜xǐ[Sg],第106号。它是为数不多的以纪念一位著名科学家命名的元素之一,当然,这个名单还包括由西博格和他的同事在1955年发现并命名为钔【Md】的元素101号。

西博格
在他的修订版中,美国化学家西博格将周期表横向变为水平,并在铀之外添加了几种合成元素。

该表仍在继续扩张中,在最近的2016年有四个元素被命名。破坏边界的研究工作以及科学的奥秘仍然存在。
,




