高尔基体加工后的蛋白被分类运往溶酶体、分泌颗粒和质膜等目的地。其中溶酶体蛋白的定位标签比较独特,是修饰的糖链。
经典的溶酶体定位标签是甘露糖6-磷酸(M6P)。这需要蛋白质中具有特定序列(Asn-X-Ser / Thr),经内质网和高尔基体连续加工修饰产生。M6P由甘露糖受体(MPR)识别。MPR有两种类型(CD-MPR和CI-MPR),共同参与溶酶体蛋白的运输过程。
也有些蛋白通过非M6P-MPR依赖的途径靶向到溶酶体。例如溶酶体整合膜蛋白(LIMP-II)负责运输溶酶体β-葡萄糖脑苷脂酶(β-GC),Sortilin可以转运神经降压素(NT),脂蛋白脂肪酶和鞘脂激活蛋白(ProSAP)等。

参与溶酶体蛋白运输的受体。Biochim Biophys Acta. 2009 Apr;1793(4):605-14.
在高尔基体反式网络(TGN),带有M6P修饰的蛋白与MPR结合,其它蛋白与sortilin或LIMP-II结合,然后被包装到带有网格蛋白的囊泡(CCV)或运输载体(TC)中,带到内体。
内体的酸性pH使这些蛋白与其受体解离。释放的蛋白保留在管腔中,MPR和sortilin通过逆行运输囊泡(retromer)从内体回到TGN,而LIMP-II无法回收,最终成为溶酶体限制性膜的组成部分。
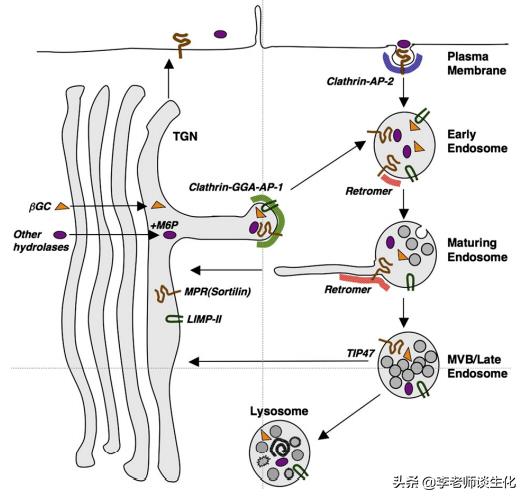
溶酶体蛋白的定位途径。Biochim Biophys Acta. 2009 Apr;1793(4):605-14.
还有一些MPR从TGN逃逸到质膜,可将带有M6P的分子从胞外传递到内体,最后进入溶酶体。
TGN是高尔基体向外运输蛋白的总枢纽,分泌蛋白也是在这里形成胞吐小泡,然后与质膜融合,从而将其释放到胞外。不过分泌途径比较复杂,有不同支路,定位标签也不唯一。
分泌蛋白的经典加工成熟过程需要经内质网核心糖化和高尔基体末端糖化等修饰。其中新生肽链进入内质网的方式主要是由信号肽引导,属于伴随翻译的易位(cotranslational translocation)。

分泌蛋白的折叠和成熟。Genetics. 2013 Feb; 193(2): 383–410.
现在已经发现了一些特殊的进入内质网方式,都属于翻译后易位(post-translational translocation)。一种情况是由胞质Hsp70 ATPases(例如Ssa1),将新生的分泌蛋白维持在去折叠的易位状态,通过Sec62 / Sec63 / Sec71 / Sec72形成的Sec63复合体进入内质网。
还有一种情况是所谓的GET途径(Guided Entry of Tail-anchored proteins),这也是C端锚定膜蛋白嵌入膜中的三条途径之一。据估计,真核生物基因组中约有5%的整合膜蛋白需要这条不依赖SRP的途径,包括与细胞内膜融合事件密切相关的SNARE蛋白。

分泌蛋白进入内质网的三条途径。Genetics. 2013 Feb; 193(2): 383–410.
在细胞质中,Sgt2、Get4和Get5形成亚复合体,将C端锚定蛋白底物加载到靶向因子Get3。后者将其引导至膜上的Get1 / Get2复合物,然后消耗ATP穿过ER膜。
参考文献:
1. Thomas Braulke, et al. Sorting of lysosomal proteins. Biochim Biophys Acta. 2009 Apr;1793(4):605-14.
2. Charles K. Barlowe, et al. Secretory Protein Biogenesis and Traffic in the Early Secretory Pathway. Genetics. 2013 Feb; 193(2): 383–410.
3. Yihong Ye. Regulation of protein homeostasis by unconventional protein secretion in mammalian cells. Semin Cell Dev Biol. 2018 Nov; 83: 29–35.
- Federica Brandizzi, et al. Organization of the ER–Golgi interface for membrane traffic control. Nat Rev Mol Cell Biol. 2013 Jun; 14(6): 382–392.





