氧化还原反应
|
考纲展示 |
考情分析 |
|
1.了解氧化还原反应的本质是电子的转移。 2.了解常见的氧化还原反应。 3.掌握常见氧化还原反应的配平和相关计算。 |
1.高频考点: ①氧化还原反应基本概念。难度:易;题型:以选择题形式出现。 ②氧化还原反应的重要规律及应用。难度:中等;题型:以选择题、填空题形式出现。 2. 一般考点:氧化还原反应的相关计算。难度:中等或难;题型:以选择题、填空题形式出现。 |
知识梳理
一、氧化还原反应中的主要规律
1.守恒规律
氧化还原反应中化合价升降总数相等,得失电子数目相等,在离子方程式中还体现在正(负)电荷守恒。
2.先后规律
一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先反应。如:
一定量Cl2通入FeBr2溶液中,先发生反应2Fe2 Cl2===2Fe3 2Cl-,再发生反应2Br- Cl2===Br2 2Cl-。
3.价态归中规律
同种元素不同价态之间发生氧化还原反应时,遵循“高价 低价[击掌]中间价”或“只靠拢,不交叉”的规律。如:

同种元素相邻价态之间不发生氧化还原反应,如浓H2SO4不能氧化SO2。
4、强生弱规律
在氧化还原反应中,强氧化剂+强还原剂=弱氧化剂(氧化产物)+弱还原剂(还原产物),只有氧化剂的氧化性比氧化产物强,该反应才能发生。如Fe3 的氧化性比I2强,可知反应2Fe3 +2I-=2Fe2 +I2可以发生;而Fe3 的氧化性比Cl2弱,故反应2Fe3 +2Cl-=2Fe2 +Cl2不能发生。
5、难易规律
越易失电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。如氧化性: Cl2 > S,则还原性:Cl-<S2-;还原性:Fe>Cu,则氧化性:Fe2 <Cu2 。
二、物质氧化性、还原性强弱的判断规律
1、依据氧化还原反应进行的方向来判断
一般而言,氧化还原反应总是朝着强氧化性物质与强还原性物质反应生成弱氧化性物质与弱还原性物质的方向进行。即在同一个氧化还原反应中, 氧化性: 氧化剂 > 氧化产物;还原性: 还原剂 > 还原产物 。
技巧:左边>右边,但一定注意正确确定要比较的物质。
2、根据金属或非金属活动性顺序判断
(1)金属活动性顺序(常见元素)

(2)非金属活动性顺序(常见元素)

3、依据元素周期表

4、依据反应条件及反应的剧烈程度
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
例如:2Na 2H2O===2NaOH H2↑,Mg 2H2O=(需要加热)Mg(OH)2 H2↑
由上述反应条件的不同,可判断还原性:Na>Mg。
5、根据生成物中元素的价态确定
相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化剂的氧化性强;不同还原剂作用于同一种氧化剂,还原产物价态低的其还原剂的还原性强。
如:根据2Fe 3Cl2=(需要加热)2FeCl3,Fe S=(需要加热)FeS,可推知氧化性:Cl2>S;根据Cu 2Fe3 ===Cu2 2Fe2 ,3Zn 2Fe3 ===3Zn2 2Fe,可推知还原性:Zn>Cu。
6、根据原电池、电解池的电极反应判断
①两种不同的金属构成原电池的两极。还原性:负极>正极。
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,而在阳极先放电的阴离子的还原性较强。

【典例1】 今有下列三个氧化还原反应:①2FeCl3 2KI===2FeCl2 2KCl I2,②2FeCl2 Cl2===2FeCl3,③2KMnO4
16HCl(浓)===2KCl 2MnCl2 8H2O 5Cl2↑。若某溶液中含有Fe2 、I-、Cl-3种离子,要除去I-而不影响Fe2 和Cl-,则可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
解析:本题解答思路是寻找一种氧化剂,其氧化性应大于I2的氧化性,而小于Cl2和Fe3 的氧化性(也可等于Fe3 的氧化性)。
法一:由①知氧化性Fe3 >I2;由②知氧化性Cl2>Fe3 ;由③知氧化性MnO4->Cl2。由此推知氧化性强弱顺序为:KMnO4>Cl2>FeCl3>I2,故FeCl3只氧化I-,选C。
法二:将四个选项代入,Cl2能氧化Fe2 ,排除A;KMnO4可氧化Cl-和Fe2 ,排除B;HCl不能氧化I-,排除D。故选C。
答案:C
【趁热打铁】
1.下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4 16HCl→2KCl 5Cl2↑ 2MnCl2 8H2O

对实验现象的“解释或结论”正确的是
|
选项 |
实验现象 |
解释或结论 |
|
A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
|
B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
|
C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
|
D |
e处变红色 |
还原性:Fe2+>Cl- |
解析:a处变蓝、b处变红棕色,说明Cl2分别与KI、NaBr作用生成I2、Br2,可证明氧化性:Cl2>I2、Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,A项错误;C处先变红,说明氯气与水生成酸性物质,后褪色,则证明氯气与水生成具有漂白性物质,B项错误;d处立即褪色,也可能是氯气与水生成酸性物质中和了NaOH,C项错误;D处变红说明Cl2将Fe2 氧化为Fe3 ,Fe2 将Cl2还原为Cl-,可证明还原性:Fe2 >Cl-,D项正确。
答案:D
2.(双选题)下列物质中既有氧化性又有还原性的是( )
A.HClO B.Al2O3 C.N2O3 D.SiO2
解析:在化合物中,元素处于中间价态时,既可表现氧化性,又可表现还原性,HClO中Cl元素为 1价,N2O3中N元素为 3价,满足题意要求。
答案:AC
3、在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )
A.①②③ B.②①③ C.③②① D.③①②
解析:①大气固氮:其中氮元素的化合价升高被氧化;
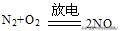
②硝酸银分解:,其中氮元素的化合价降低被还原;
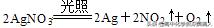
③实验室制氨气:2NH4Cl+Ca(OH)2=(需要加热)CaCl2 2NH3↑ 2H2O,其中氮元素的化合价既不升高也不降低,故既不被氧化又不被还原。
答案:A
4.(双选) 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2 H2O2 2H =2Fe3 2H2O ,2Fe3 H2O2=2Fe2 O2↑ 2H 。下列说法正确的是( )
A.H2O2的氧化性比Fe3 强,其还原性比Fe2 弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2 和Fe3 的总量保持不变
D.H2O2生产过程要严格避免混入Fe2
解析:结合A、B两个方程式根据氧化性、还原性强弱比较规律可得 H2O2的氧化性>Fe3 的氧化性, H2O2的还原性>Fe2 的还原性,A错;2H2O2=2H2O O2↑,分解过程中,Fe2 作催化剂,溶液pH值不变,B错;在H2O2分解过程中,Fe3 或Fe2 作催化剂,所以二者总量不变,C对;因为Fe2 可导致H2O2分解,所以H2O2生产过程要避免混入Fe2 ,D对。
答案:CD






