文|煮酒
图|煮酒
冬季温暖,降雪减少,增加了温带地区土壤冻融循环的频率。土壤微生物对冻融循环的反应各不相同,其中一些变化可以通过微生物对先前冬季条件的调节来解释,但这种联系在很大程度上仍未得到探索。我们研究了温度历史的差异如何影响响应冻融循环的微生物群落组成和活性。
收集了云杉冷杉林中在较冷(高海拔)和较暖(低海拔)温度条件下形成的土壤微生物群落,然后在实验室微观实验中将这些土壤微生物群落添加到无菌块状土壤中。接种高海拔寒冷和低海拔温暖微观世界进行昼夜冻融循环或恒定高于冰点的温度9 d。然后,所有微观世界都经历了7天的冰点以上恢复期。
总体而言,我们发现,相对于低海拔温暖群落,高海拔冷群落的微生物呼吸减少较小(CO2助焊剂)在冻融循环期间。此外,平均而言,高海拔寒冷群落经历的冻融诱导的细菌死亡率低于温暖群落,并且可能通过增加脂质膜流动性部分适应冻融循环。冻融处理期结束后,两个微生物群落的呼吸迅速恢复,土壤可提取碳或氮没有变化。
我们的研究结果提供了证据,证明过去的土壤温度条件可能会影响土壤微生物群落对冻融循环的反应。在较冷温度条件下发育的微生物群落比在较高温度条件下发育的群落更能耐受冻融循环,尽管这两个群落都表现出一定程度的复原力。综上所述,我们的数据表明,随着冬季变暖,适应冬季土壤温度不那么极端的微生物群落可能最容易受到冻融状态的快速变化的影响。

1. 采样点
我们从美国佛蒙特州的一片低海拔和高海拔温带森林获得了用于冻融微观实验的土壤。这两片森林经历了不同的冬季气候条件,以红云杉红云杉和香脂冷杉Abies balsamea为主。高海拔地点位于佛蒙特州亨廷顿绿山骆驼峰附近的西坡上(海拔1074米,北纬44°19′19“,西经72°53′27”),低海拔地点位于佛蒙特州达克斯伯里的佛蒙特州土地信托场地(海拔498米,北纬44°15′40“,西经72°49′26”)。骆驼驼峰遗址具有沙质壤土质地的孢多索尔(莱曼-马洛复合体);土壤pH值为4.33和矿质土壤(0-10厘米)总C为20.2%,总氮为1.2%。低海拔地点的土壤也是具有沙质壤土质地的孢子索尔,土壤pH值为4.64,总C为6.4%,总氮为0.4%(测量值同上)。
与低云杉地点相比,高云杉地点在一年中较长时间的土壤和气温较低。0—4年,低云杉地点的日平均最低和最高气温分别为0.1±11.1°C和0.1±0.9°C,高云杉地点的日平均最低和最高气温分别为-0.1±8.2°C和0.1±2000.2019°C。我们使用屏蔽式Thermochron iButton温度传感器和数据记录器测量了土壤采集现场的当地树冠下空气和土壤温度。传感器悬挂在离地表1.5米的树上,埋在土壤表面以下5厘米处(每个地点5-6个传感器)。从 1 年 2020 月到 2021 年 4 月,每隔 5 小时记录一次空气和土壤温度。高云杉地点的日平均最低气温为-0.6±1.5°C,低云杉地点为-0.6±1.2°C。高云杉地点的日平均最低土壤温度为0.2±4.6°C,低云杉地点为0.3±1.0°C。在土壤收集的一年中,土壤温度从未低于1°C,尽管该地区可能发生土壤冻结。。
2.土壤取样
为了获得土壤微生物群落,我们于0年10月5日至6日从有机层下方提取了矿物土壤核心(2020-2厘米)。我们使用土壤取芯器(AMS微型土壤探针;直径2厘米;AMS, Inc.)并将它们组合在一个塑料袋中(每个地点的土壤分开)。来自每个地点的土壤立即被运送到实验室,通过筛分(网孔尺寸20毫米)均质化,并储存在-2002°C直至用作接种剂。当无法使用新鲜土壤时,其他冻融培养研究将土壤储存在冷冻条件下,调查处理前储存条件对土壤和微生物特性影响的研究表明,储存在 −2007°C 下,以防止底物逐渐耗尽,同时限制对微生物群落的储存影响。我们承认这可能影响了对冷冻敏感的微生物,但两个微生物群落都是在寒冷季节收集的,暴露在相同的储存条件下,并允许一个平衡期从储存中恢复。
为了创建用于所有微观世界的单一无菌块状土壤,我们使用小铲子从每个地点(0-10厘米)收集额外的矿物土壤,并将其运送到冰上的实验室。我们通过筛分(网孔尺寸2毫米)分别对每个地点的土壤进行均质化。我们手工混合了两个地点的土壤(体积比为1:1),并将合并的土壤干燥至60%的田间容量。然后,我们将合并的土壤在123°C下高压灭菌两次,持续30分钟(间隔24小时)。这种无菌的混合田土壤用于所有微观世界。土壤总碳和氮浓度分别为13.9%和0.9%(测量值同上)。
3.微观实验与微生物呼吸测量
我们建立了一个微观实验,以确定温带森林中的土壤微生物遗产是否会影响冻融反应。首先,我们将无菌散装土壤与高云杉或低云杉接种物混合。接下来,我们将 16 克高云杉或低云杉接种的土壤添加到未加盖的 60 ml Nalgene 聚乙烯瓶中,创建了 30 个高云杉和 30 个低云杉接种土壤子样品。将两个高云杉或低云杉土壤子样品放入24个装有铝盖(即微观世界)的1-L玻璃罐中。该方法产生了具有2个微生物群落/位点(高云杉和低云杉)×2个处理(对照或冻融循环)×6次重复的因子设计,总共24个微观世界(每个包含2个子样品)和每种处理组合的样本量为6个微观。为了测量初始微生物生物量、群落组成和土壤特性(即在平衡期结束时但在冻融期开始之前),我们建立了另外 12 个微观世界,6 个包含高云杉接种的子样品,6 个包含低云杉接种的子样品。
微观世界在恒定的10°C下孵育在冻融期前2周,以使微生物群落建立和平衡。在平衡期结束时,我们收获了12个微观世界,每个微生物包含一个土壤子样本,以测量初始重量土壤湿度,微生物生物量和群落组成,TIN和可提取的有机C和N。
我们使用黑暗的恒温器调节培养箱对剩余的 24 个微观世界进行两种温度处理之一:
(1) 每 12 小时在 4°C 和 -7°C 之间交替的昼夜冻融循环;
(2) 恒定 4°C。该冻融期持续9天,然后在7°C下进行4天的恢复期,以评估冻融循环对微生物呼吸的滞后影响。
在冻融期结束时和实验结束时,从24个微观世界中的每一个收获一个土壤子样品,以测量重量法土壤湿度,TIN和可提取的有机碳和氮。我们还测量了冻融期后收集的土壤子样品中的微生物生物量和群落组成。
在冻融和恢复期间,我们使用红外光声光谱气体分析仪。我们通过单独的隔膜将两个不锈钢输液针插入罐盖中,其中一根连接到PAS入口,另一根连接到出口。计算一氧化碳的变化2每个24小时周期的浓度(即呼吸速率),我们每天在时间= 0小时(初始测量)和时间= 24小时(最终测量)对顶空进行采样。呼吸测量值一式两份并取平均值。在每天的最后一次测量(时间= 24小时)之后,立即将每个罐子开盖并通过扇动用环境空气冲洗1分钟,然后重新盖上盖子以进行下一个24小时周期的初始测量。这个过程每天都在重复。在冲洗期间,隔膜在实验中途更换。测量期间房间的平均温度为17°C,微观世界每天暴露在该温度下总共≈5分钟,包括最终 初始测量和冲洗。
每天的初始 CO 和最终 CO 之间的差异2随时间变化的浓度(通常≈24小时)用于计算微生物呼吸速率(CO2助焊剂):
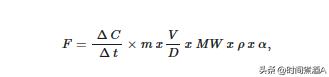
4.营养物提取和化学分析
在平衡、冻融和恢复期后,用 5 ml 50 M KCl 摇动 2 g 湿土壤 1 小时,然后使用预浸出的 Whatman 1 号滤纸进行重力过滤,提取土壤子样品。将提取物储存在-20°C直至营养分析。我们通过在5°C下干燥60克湿土壤子样品48小时来确定重量法土壤湿度。
我们使用总有机碳分析仪通过燃烧测量提取物中总有机C和总(有机 无机)N的浓度。由于这些分析是在过滤的土壤提取物上进行的,因此它们产生了可提取的有机C和总(有机 无机)可提取N的浓度。我们对土壤NH进行了比色分析4 -N 和否3−酶标仪上的-N(BioTek Synergy HTX,BioTek Instruments,Inc.)。不3−-N是使用钒(III)转化为亚硝酸盐和/或一氧化氮后测量的。新罕布什尔州4 -N使用Berthelot颜色反应(改编自Forster,1995)测量。不3−-N水平非常低(3μgNO)3−-N g 干燥土壤−1与 118 微克 NH 相比4 -N g 干燥土壤−1平均而言),不受治疗的影响。因此,我们合并了NH4 -N 和否3−-N 计算 TIN,我们在数字和分析中使用了它。我们通过从总可萃取氮中减去TIN来计算可萃取有机氮的量。我们以每克干土为基础计算所有土壤可提取的C和N值。
5 .PLFA
我们使用磷脂脂肪酸(PLFA)分析测量了平衡和冻融期后的微生物生物量和群落组成。我们从1.5克过筛的,无根的,新鲜重量的土壤中提取微生物脂质,这些土壤在分析开始之前一直储存在-20°C。提取带有磷酸盐缓冲液的氯仿进行初始收集。我们将硅酸色谱柱上的这些脂质提取物分馏成中性脂质、糖脂质和极性脂质。仅收集极性脂质,然后用0.2 M甲醇KOH甲基化以形成脂肪酸甲酯(FAMEs)。我们使用瓦里安 3800 GC-FID 根据保留时间数据以及每个目标标记物的已知标准品来鉴定和量化 FAME。
我们选择了 i15:0、a15:0、i16:0、i17:0、a17:0、16:1ω7c、18:1ω7 和 cy19:0PLFAs表示细菌生物量。在这些标记中,我们将前五个分配给革兰氏阳性细菌,后三个分配给革兰氏阴性细菌。我们选择了18:2ω6,9和18:1ω9的PLFAs来表示真菌生物量。我们根据其分组的PLFA特征的总和计算了真菌:细菌比率(F:B)。我们选择了10Me16:0表示放线菌,并且未将此PLFA包括在任何其他分类微生物分组或比例中。我们还计算了革兰氏阳性:革兰氏阴性(Gram :Gram−)和饱和:单不饱和脂肪酸(Sat:Mono)作为潜在压力指标的比率。我们以每克干燥土壤为基础计算脂肪酸。
6. 统计分析
对于每日微生物呼吸速率,我们分别分析了冻融期和恢复期的数据。我们使用线性混合效应模型进行全因子方差分析重复测量,包括一天的主效应(作为连续变量;受试者内)、温度状况(以下简称“温度”;受试者间)、微生物群落/位点(以下简称“位点”;受试者间)以及上述所有相互作用。
微观世界身份和微观世界身份×天分别嵌套在温度和地点作为随机效应,以解释同一微观世界随时间推移的非独立测量。对于所有其他响应(微生物生物量,TIN,可提取有机氮和C),我们对冻融后和恢复后数据(如适用)进行了单独的全因子方差分析,包括温度和位点的主效应以及温度×位点相互作用。采用T检验分析平衡后收获的6个高云杉和6个低云杉微观世界之间微生物生物量、TIN和可提取有机N和C的初始差异。检查数据是否存在方差的正态性和同质性假设。我们使用统计分析软件进行了所有分析。
结果1. 微生物呼吸
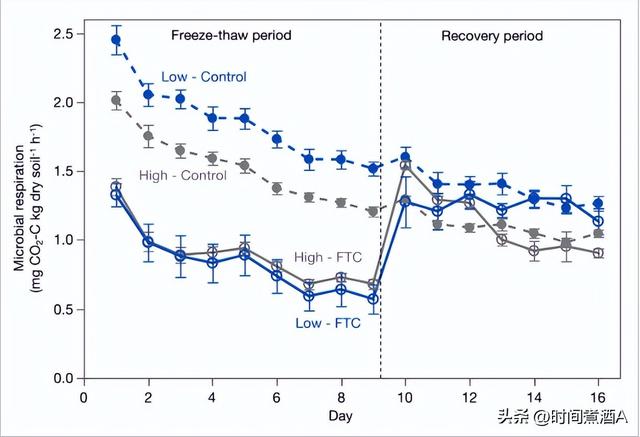
冻融循环降低了所有微观世界中的每日微生物呼吸速率,在冻融期间,低云杉减少了53%,而高云杉减少了37%。高云杉和低云杉微观世界的响应幅度在白天略有变化,但始终为负值。这些下降虽然两个微生物群落之间的幅度不同,但将呼吸降低到相似的绝对速率。具体而言,虽然低云杉对照组的呼吸量平均比高云杉对照组高23%,但冻融循环将低云杉的呼吸速率降低到0.83±0.05毫克一氧化碳2-C 公斤土壤−1h−1和高云杉至 0.89 ± 0.03 毫克一氧化碳2-C 公斤土壤−1h−1平均而言。在恢复期间,我们在前三天观察到高云杉的呼吸脉冲,然后恢复到基线水平并在最后一天适度降低。低云杉的呼吸速率在恢复第一天恢复到基线水平,没有出现脉搏。绝对呼吸速率随时间推移的下降可能是由于底物逐渐耗尽。

2. 土壤可萃取氮和碳
冻融处理在冻融或恢复期后均未显着影响TIN、可萃取有机氮或可萃取有机C,尽管在低云杉微观世界的冻融循环后存在可萃取有机氮和碳增加的趋势。在实验之前和整个实验过程中,相对于低云杉微观世界,高云杉中的TIN但不是可提取的有机N或C更大。
3.微生物生物量与群落组成
在冻融期之前,低云杉和高云杉的群落组成相似。唯一的显着差异是低云杉相对于高云杉的放线菌生物量低17%。
我们无法检测到冻融循环对总(真菌 细菌)生物量的影响,尽管冻融循环使低云杉的生物量平均减少了14%。当分别分析细菌和真菌生物量时,我们检测到冻融循环对细菌的负面影响,这在低云杉微观世界中最为明显。https://besjournals.onlinelibrary.wiley.com/doi/10.1111/1365-2435.14273 - fec14273-tbl-0002冻融循环使高云杉和低云杉微观世界中的革兰氏阳性细菌平均减少了24%,与对照组相比,高云杉的Gram :Gram-平均减少25%,低云杉微观世界平均减少16%。与对照组相比,冻融循环还使高云杉的Sat:Mono平均减少了13%,低云杉微观世界减少了3%。https://besjournals.onlinelibrary.wiley.com/doi/10.1111/1365-2435.14273 - fec14273-tbl-0002


综上所述,我们的发现提高了对土壤微生物遗产如何影响冻融反应的理解。低云杉群落对冻融循环的脆弱性更大,可能与相对于更耐寒的高云杉群落而言冬季土壤温度升高的历史有关。尽管我们在实验期间控制了土壤湿度,但田间土壤水分历史的调节也可能影响微生物对冻融循环的反应。
不耐寒的微生物群落,如来自我们的低云杉地点的微生物群落,最终是否会通过生理和/或群落结构变化适应更频繁的冻融条件,以更好地维持活动,以及这种调整发生的时间尺度,是未来研究的一个重要领域。尽管微生物呼吸和群落组成因冻融循环而发生变化,但一些变量(例如真菌生物量、土壤可提取的C和N)反应迟钝,呼吸迅速恢复,表明微生物群落可能同时表现出脆弱性和对冻融循环的适应能力。
综上所述,我们的研究结果表明,随着冬季温暖和积雪消失,适应冬季土壤温度升高的土壤微生物群落可能最容易受到冻融状态快速变化的影响,但如果死亡率低,它们可能能够迅速恢复。确定气候历史将如何影响微生物对整个系统冬季气候变化的反应,以及这些影响是否规模化以影响养分可用性,水质以及生态系统和区域碳平衡仍然是未来研究的关键未满足挑战。
参考文献:
Aanderud, Z. T., Jones, S. E., Schoolmaster, D. R., Jr., Fierer, N., & Lennon, J. T. (2013).土壤呼吸和微生物群落对降雪改变的敏感性。土壤生物学与生物化学,57,217-227。
Adair, E. C., Barbieri, L., Schiavone, K., & Darby, H. M. (2019).粪肥施用决策会影响非生长季节解冻期间的一氧化二氮和二氧化碳排放。美国土壤科学学会杂志,83,163-172。
巴奥特,E.(2003). 利用中性脂质脂肪酸指示土壤真菌的生理条件.微生物生态学,45,373-383。
,