引言
原子吸收光谱(AAS)法,又称原子吸收分光光度法,是基于物质的原子蒸气对同种原子发射的特征辐射(谱线)的吸收作用而建立起来的分析方法。分析过程:用(锐线光源)同种原子发射的特征辐射照射试样溶液被雾化和原子化的原子蒸气层,测量(特征辐射)透过的光强或吸光度,根据吸光度对浓度的关系计算试样中被测元素的含量。
AAS可以测定70多种元素,具有准确度高、灵敏度高、选择性好、抗干扰能力强等优点,并且设备操作简单、分析速度快。广泛应用于地质、冶金、机械、化工、农业、食品、轻工、生物医药、环境保护、材料科学等各个领域。但是,AAS也有一定的局限性,对难熔元素、非金属元素测定困难,对复杂样品分析干扰也较严重,且不能同时测定多元素。

原子吸收分光光度计基本构造示意图
基本原理
一切物质的分子均由原子组成,原子由原子核与核外电子构成。原子核内有中子和质子,质子带正电,核外电子带负电,电子的数量和构型决定了该元素的物理和化学性质。当原子处于正常状态时,每个电子趋向占有低能量的能级,这时原子所处的状态叫基态(Eo)。当原子所处的环境发生变化,受到热能、电能或光能的影响,原子中的电子吸收一定的能量,处于低能态的电子被激发跃迁到较高的能态,原子此时的状态叫激发态(Eq)。

不同元素,包含的原子种类和分布情况不同,形成的波长和频率也不同。因此,可运用原子中电子排列结构的差异性形成的光谱线,对不同的元素进行区分,并判断元素的含量,形成元素强度与含量的谱线可以作为元素分析的依据。原子吸收光谱分析技术的应用,便是运用不同的元素形成的不同谱线,对其进行区分,获得相应的检测结果。
原子吸收光谱分析仪器的基本原理,是通过火焰、石墨炉等设备将待测样本在高温环境下变成原子蒸汽,再由光源灯将待测样本的特征光线辐射到相应的环境下,与待测元素的原子蒸气结合,发生光谱吸收的反应,按照元素的浓度和强度分别形成不同的光谱图,经过仪器的光路分析系统,将每种不同的谱线区分开来,再运用光电转换器将光信号转变为电信号,由电路系统进行放大和处理,经过电脑对信息数据进行采集和分析,最后输出分析结果。
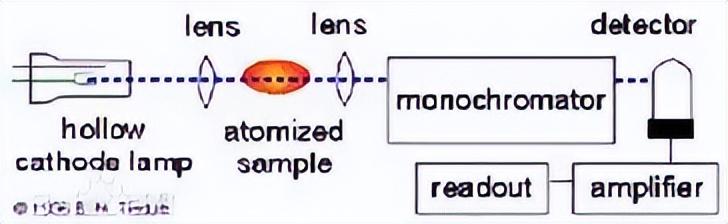
原子吸收光谱原理图
分析
定性依据
由于各元素的原子结构和外层电子的排布不同,不同元素的原子从基态激发至第一激发态(或由第一激发态跃回基态)时,吸收(或发射)的能量不同,因而各元素的共振吸收线具有不同的特征。
定量依据
光强度的变化符合比耳-朗伯定律(Beer-Lambert):A = log (I0/ It) = abc,可进行定量分析。A∝c,其中A=吸光度,a=吸收系数,I0=初始光强,b=样品在光路中的强度,It=透过光的强度,c=浓度。
分析方法
1、标准曲线法:标液配制。
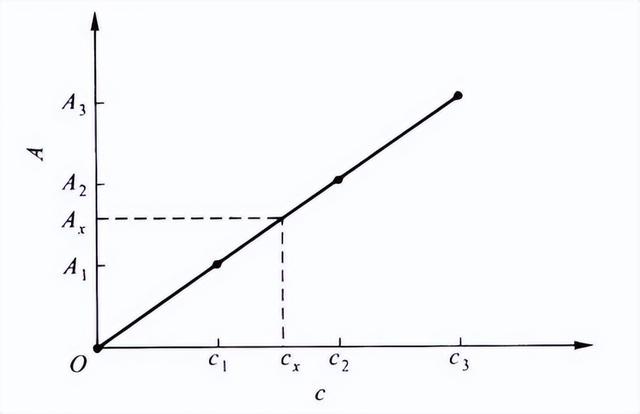
标准曲线法原理示意图
方法:设定条件,测定一系列已知浓度的样品的吸光度数值,并作图。在相同条件下,测定样品的吸光度,由标准曲线求得样品待测元素浓度。
注意事项:
①合适的浓度范围;
②扣除空白;
③标样和试样的测定条件相同。
2、标准加入法:主要是为了克服标样与试样基体不一致所引起的误差(基体效应)。

标准加入法原理示意图
方法:若试样基体组成复杂,且基体成分对测定又有明显干扰,此时可采用标准加入法。取若干份等量的试样溶液,分别加入浓度不等的标准溶液,测定吸光度,由吸收曲线外推得到原始样品浓度。
注意事项:
①须线性良好;
②至少四个点(在线性范围内可用两点直接计算);
③只消除基体效应,不消除分子和背景吸收;
④斜率小时误差大。
3、内标法:
优点:消除气体流量、进样量、火焰湿度、样品雾化率、溶液粘度以及表面张力等的影响,适于双波道和多波道的AAS。
干扰及其消除方法
1、物理干扰
产生原因:试样粘度、表面张力的不同使其进入火焰的速度或喷雾效率改变引起的干扰。
消除方法:
①可通过控制试液与标准溶液的组成尽量一致的方法来抑制。试样组成不详时,采用标准加入法。
②尽可能避免使用粘度大的硫酸来处理样品;采用稀释的办法。
2、化学干扰
产生原因:被测原子与共存元素发生化学反应生成难挥发的化合物所引起的干扰,主要影响原子化效率,使待测元素的吸光度降低。有两种类型:①待测元素与共存物质作用生成难挥发或难解离的化合物,致使参与吸收的基态原子减少。②待测元素原子发生电离反应,生成离子,不产生吸收,总吸收强度减弱,电离电位≤ 6eV的元素易发生电离,火焰温度越高,干扰越严重。
消除方法:
①选择合适原子化方法。提高原子化温度,可使难解离的化合物分解;采用还原性强的火焰与石墨炉原子化法,可使难解离的氧化物还原、分解。
②加入释放剂,与干扰元素生成更稳定化合物使待测元素释放出来。如磷酸盐干扰Ca,加入La或Sr时,可释放出Ca。
③加入保护剂,使待测元素不与干扰元素形成难挥发化合物,使待测元素被保护起来。保护剂大多是配合剂。
④加入基体改进剂。石墨炉原子化法,在试样中加入基体改进剂,使其在干燥或灰化阶段与试样发生化学变化,其结果可能增加基体的挥发性或改变被测元素的挥发性,以消除干扰。
⑤化学分离法。当以上方法都不能消除化学干扰时,只好采用化学方法将待测元素与干扰元素分离。常用的化学分离方法有溶剂萃取、离子交换和沉淀分离等。
3、电离干扰
产生原因:高温导致原子电离,从而使基态原子数减少吸光度下降。
消除方法:加入消电离剂(主要为碱金属元素化合物),产生大电子,从而抑制待测原子的电离。
4、光谱干扰
产生原因:待测元素的共振线与干扰物质谱线分离不完全,这类干扰主要来自光源和原子化装置。
消除方法:
①在分析线附近有单色器不能分离的待测元素的邻近线,可以调小狭缝的方法来抑制这种干扰。
②空心阴极灯内有单色器不能分离的干扰元素的辐射,可以换用纯度较高的单元素灯减小干扰。
③灯的辐射中有连续背景辐射,可以用较小光谱通带或更换灯。
制样技术
样品大致可以分为无机固体样品、有机固体样品和液体样品三大类。对试样溶剂的要求:溶液要澄清、无悬浮物、稳定。溶液的酸碱度要求:酸度应该在0.1%以上,一般不要超过5%,尽可能标准溶液的酸度保持一致。溶液介质:尽可能用盐酸或硝酸溶液。
1、无机试样的分解
①水溶解:可溶性无机物可直接用水溶液制成待测溶液,考虑到溶液的稳定性及与标准溶液的酸度一致,往往加入一些酸。
②酸分解:大多数无机化合物、金属、合金、矿石等式样用酸溶解。常用的溶剂有HCI、HNO3、H2SO4、H3PO4、HCIO4、HF及它们的混合酸等。其中HNO3和HCl的干扰比较小,因此通常使用HNO3和HCI来溶解样品。为了提高溶解效率,还可以在溶解过程中加入某些氧化剂(如H2O2),盐类(如铵盐)或有机溶剂(如酒石酸)等。
③高温熔融:如石英、锡石SnO、金红石、锆英石等,分解这些样品必须用碱熔融。常见的溶剂有NaOH、LiBO2、Na2O2、K2S2O7等。
④焙烧、烧结:在低于溶剂熔点的温度下分解试样。烧结的溶剂有碳酸钠、碳酸钙、过氧化钠、氧化镁等。
2、有机试样的消解
①干法灰化:使有机物燃烧,其中的金属元素转化为无机盐,然后用适当的酸溶解灰分制成稀酸溶液,用于原子吸收测定。不适于挥发性元素的测定。
②湿式消解:用浓无机酸或再加氧化剂,在消化过程中保持在氧化状态的条件下消化处理样品。常用的消化剂有HNO3、HNO3 HCI、HNO3 H2SO4、HNO3 HCI H2O2等。湿法消解法中样品挥发损失比干法灰化要小一些,但对于Hg、Se、Fe等易挥发金属元素仍有较大损失。
③高压密封罐消解:加热温度一般在120~160℃,加热数小时,消解周期较长。
④微波消解:在密封容器内加压进行,避免了挥发性元素的损失,减少了试剂消耗量,不污染环境,消解速度比传统加热消解快4~100倍,且重复性好。
应用






